Цианобактерии - древнейшая группа среди живых организмов. Остатки организмов, близких современным цианобактериям, найдены среди строматолитов - слоистых меловых отложений, возраст которых составляет около трех миллиардов лет [15]. Морфологически цианобактерии разделяются на одноклеточные, колониальные и многоклеточные (нитчатые) формы. Размеры клеток колеблются от менее 1 до 50 мкм. Большинство цианобактерий образуют колонии или многоклеточные нити. Химический состав биомассы цианобактерий отличается высоким содержанием протеина (до 70% органического вещества) [16, 20], наличием термоустойчивых ферментов (в том числе ДНК-полимеразы) [17], пигментов, витаминов [1]. Будучи космополитами, цианобактерии являются типичными обитателями горячих источников.
Сообщества цианобактерий с другими микроорганизмами, развивающиеся в гидротермах, все более привлекают внимание с флористической и геохимической точек зрения [4, 9, 21]. Приспособленность термофильных организмов к активной жизни при высокой температуре базируется на своеобразии физико-химических, структурных и функциональных свойств всех компонентов клетки. Термофильные цианобактерии могут функционировать при температуре до 74-80оС [22] и выше благодаря своеобразному коллоидному состоянию протоплазмы, которая очень медленно коагулирует [12, 13].
Для описания сообществ цианобактерий с другими бактериями применяют термин «циано-бактериальный», относя «циано-» к цианобактериям, а «бактериальный» - к другим бактериям. В гидротермальных проявлениях цианобактериальные сообщества могут образовывать циано-бактериальные маты («мат» от англ. «ковер»), составляющие автономные специфические биоценозы.
Целью исследований являлось изучение целесообразности культивирования термофильных цианобактерий для использования в биотехнологии.
Материалы и методы исследований
Нами были изучены циано-бактериальные сообщества гидротерм Паратунского гидротермального месторождения южной Камчатки. Для определения видового состава циано-бактериальных сообществ образцы отбирали в горячих источниках и на прилегающих к ним термальных полях. Подготовку образцов осуществляли по методикам микробиологических исследований [18]. Определение таксономической принадлежности компонентов сообществ проводили по определителям [5, 14] при использовании микроскопа «Zasilacz ZM 6/50». Химический состав биомассы цианобактерий исследовали стандартными методами.
Результаты исследований
Воды Паратунского геотермального месторождения могут быть отнесены к типу сульфатно-натриевых, характеризуются невысокой минерализацией. На всех участках имеет место самоизлив горячих вод из скважин. Месторождение разделяется на северный, нижний, средний и верхний участки. Термальные воды характеризуются температурой 25-80оС, в высоконагретых потоках - 100-105оС.
В исследованных гидротермах Паратунского месторождения были определены цианобактерии родов Microcystis, Phormidium, Aphanothece, Gloeocapsa, Oscillatoria, Chamaesiphon, Lyngbya. В источниках Верхней и Средней Паратунки доминировали цианобактерии родов Oscillatoria и Phormidium. Они образовали пленочные и нитчато-волокнистые обрастания изумрудно-зеленого и оливково-зеленого цветов. В бассейнах Нижней Паратунки доминировали цианобактерии рода Phormidium, а именно Ph. ambiguum, образующие слоистые плавающие маты оливково-зеленого цвета толщиной до 20 мм.
Для оценки биоразнообразия и численности видов цианобактерий гидротерм Паратунского месторождения определили значение индекса разнообразия Шеннона. Результаты представлены в таблице 1. Из данных таблицы следует, что индекс видового разнообразия Шеннона, степень доминирования выше для цианобактерий рода Phormidium, из 17 обнаруженных видов которых девять видов относилось к данному роду.
Таблица 1. Биоразнообразие и численность видов цианобактерий гидротерм Паратунского месторождения
|
Рода цианобактерий |
Число видов |
Индекс разнообразия Шеннона (в битах) |
(%) и степень доминирования |
|
Phormidium |
9 |
1,74 |
(53,0) 0,53 |
|
Oscillatoria |
2 |
0,39 |
(11,8) 0,12 |
|
Gloeocapsa |
2 |
0,39 |
(11,8) 0,12 |
|
Lyngbya |
1 |
0,19 |
(5,9) 0,59 |
|
Microcystis |
1 |
0,19 |
(5,9) 0,59 |
|
Aphanothece |
1 |
0,19 |
(5,9) 0,59 |
|
Chamaesiphon |
1 |
0,19 |
(5,9) 0,59 |
|
Суммарное значение |
17 |
3,28±0,23 |
- |
Примечание: данные достоверны при доверительной вероятности Р = 0,99 или уровне значимости α = 0,01.
Для решения вопроса о целесообразности культивирования цианобактерий определяли накопление биомассы в единицу времени на единицу площади. Нами было проведено определение скорости накопления биомассы цианобактериями Ph. ramosum в Средне-Паратунских гидротермах в зимний и летний периоды. Накопление биомассы почти не зависело от сезона года - в зимний и летний периоды динамика прироста была практически одинаковой. Прирост биомассы происходил достаточно активно и достигал 74,6 мг/м2/ч сухого вещества. При пересчете урожайности Ph. ramosum в т/га/год получили 4,818 т, что близко урожайности пшеницы (4 т/га/год). В то же время при пересчете урожайности Ph. ramosum по белку получили 1,690 т/га/год, что ненамного ниже урожайности сои (2,4 т/га/год), так как содержание протеина в биомассе Phormidium, выделенных из Паратунских гидротерм, достигает 35,1% органической части [7]. Следовательно, в качестве ресурсного объекта с целью получения кормового и пищевого белка и биологически активных веществ (витаминов, ферментов, пигментов), а также биосорбентов [2] перспективно промышленное культивирование цианобактерий рода Phormidium.
Для выбора способа культивирования нами были изучены существующие способы, применяемые для микроорганизмов и микроводорослей.
Промышленное культивирование цианобактерий и одноклеточных водорослей осуществляется в настоящее время в нескольких странах [6, 19]. При значительных различиях все современные методы культивирования фототрофов основаны на обеспечении клеток достаточным количеством света, углекислоты, питательных веществ [10, 11, 23].
В настоящее время применяются два способа получения биомассы цианобактерий и микроводорослей: массовая культура под открытым небом и интенсивное культивирование в замкнутых аппаратах в полностью контролируемых условиях.
Основным недостатком получения биомассы в открытых установках является зависимость от погодных условий, из-за чего невозможно длительное, стабильное снятие урожая. Другими серьезными недостатками являются подверженность культуры инфекциям (бактерии, личинки насекомых, различные виды водорослей), а также порой негативное влияние химического состава естественного субстрата на химический состав биомассы.
В 60-х годах прошлого века был разработан ряд установок и аппаратов высокоинтенсивного культивирования в полностью контролируемых условиях [3]. Главным преимуществом этих методов культивирования является возможность вести длительное непрерывное выращивание культуры с поддержанием постоянной плотности суспензии на оптимальных значениях. Максимальная продуктивность является главным преимуществом этого метода. Однако в связи с большими затратами электроэнергии стоимость получаемой биомассы весьма высока.
Нами предложен способ культивирования термофильных цианобактерий рода Phormidium, при котором регулирование температуры и химического состава субстрата осуществляется путем подачи термальных вод природных источников Паратунской геотермальной системы при обеспечении их проточности. Использование термальных вод позволяет исключить подготовку искусственной питательной среды и выделение чистой культуры, так как в качестве питательной среды используются термальные воды природных источников Паратунской геотермальной системы, а в качестве культуры - цианобактерии рода Phormidium, выделенные из этих же природных высокотемпературных источников. Особенности метаболизма термофильных цианобактерий при высокой температуре (45-65оС) и слабощелочной реакции среды (рН 7,5) позволяют исключить операцию стерилизации питательной среды. Снижение энергетических затрат достигается за счет отсутствия необходимости подогрева питательной среды, а также необходимости принудительной ее проточности, так как давление термальных вод на выходе из скважин достигает 3 - 8 атм.
Предложенный способ культивирования [8] был отработан в лабораторной, а затем в пилотной установке (рис. 1).
Для запуска установки через патрубок 1 с помощью ручного открывания клапана 2 в рабочую емкость 3 подавался субстрат температурой 65оС (термальные воды), поступающий по трубопроводу за счет естественного напора. По мере прохождения субстрата по системе трубопровода, его давление снижалось. При достижении необходимого уровня субстрата в рабочей емкости 3 клапан 2 закрывали. Выключателями 4 включали мешалку с электродвигателем 6 и компрессор 7, с помощью которого через патрубок 8 субстрат непрерывно обогащался воздухом. Внесение посевного материала проводилось при открытой крышке 9 только при естественном снижении температуры субстрата до 45оС. Регулятором 10 включали люминесцентные лампы низкого давления 11. После внесения посевного материала начинался процесс ферментации. Дополнительная подача воздуха в рабочую емкость осуществлялась с помощью вентилятора 12, вмонтированного в крышку 9. Контроль температуры субстрата осуществлялся термометром 13 и датчиком 14. При понижении температуры на 2-3оС автоматически при помощи реле 15 открывался клапан 16 патрубка 17, через который сливалась порция субстрата. При этом одновременно открывался клапан 2, через который в установку подавалась свежая порция термальной воды 65оС, равномерно распределяемая по объему субстрата при помощи мешалки 6 путем барботирования. При достижении необходимой температуры 45оС клапаны 2 и 16 автоматически закрывались, и процесс продолжался до очередного понижения температуры. Первый отбор биомассы проводился при образовании практически на всей поверхности субстрата слизистой пленки цианобактерий через 4-5 суток. Затем биомасса регулярно 1 раз в двое суток для поддержания низкой плотности культуры во избежание ее самозатенения и деструкции отбиралась при открытой крышке 9 установки с помощью сачка в течение 1-2 минут.
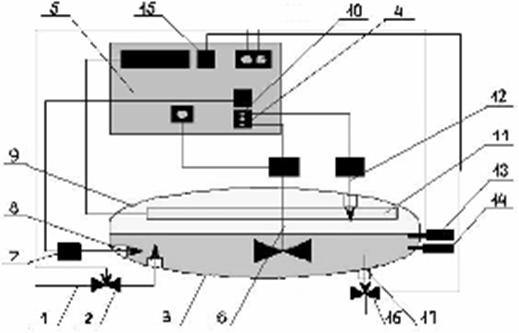
Рис. 1. Схема пилотной установки для культивирования термофильных цианобактерий:
1-патрубок подачи субстрата; 2-клапан, регулирующий подачу субстрата; 3-рабочая емкость; 4-выключатели; 5-щит управления; 6-мешалка; 7-компрессор; 8-патрубок подачи воздуха; 9-крышка; 10-регулятор освещения; 11-лампы; 12-вентилятор; 13-термометр; 14-датчик температуры; 15-реле; 16-клапан слива субстрата; 17-патрубок слива субстрата
Разработанный нами способ культивирования цианобактерий рода Phormidium позволяет упростить технологию получения биомассы, так как исключает закупку, доставку и предварительную подготовку субстрата. Способ предполагает снижение энергетических затрат за счет того, что проточность термальных вод позволяет поддерживать постоянство их, как субстрата, химического состава и температуры; культивирование цианобактерий при высоких температурах (45оС) позволяет исключить процесс стерилизации субстрата; для обеспечения производства используется энергия термальных вод Паратунской геотермальной системы, что исключает потребность в топливе и обеспечивает возможность организации круглогодичного производства. При оптимальных условиях культивирования накопление биомассы достигало 50 мг/м2/ч сухого вещества.
Выводы
Исследованы циано-бактериальные сообщества Паратунских гидротерм и условия их обитания. Определены цианобактерии 17 видов, относящиеся к семи родам. Доминируют цианобактерии рода Phormidium. Предложен способ культивирования термофильных цианобактерий в установке комбинированного типа. Для реализации поставленных задач выбраны Средне-Паратунские гидротермы и доминирующие в них цианобактерии Ph. ramosum. Отработаны оптимальные режимы культивирования Ph. ramosum, при которых накопление биомассы достигает 50 мг сухого вещества в час с 1 м2 поверхности.
СПИСОК ЛИТЕРАТУРЫ:
- 1. Барашков Г.К. Сравнительная биохимия водорослей. М.: Пищ. пром-сть, 1972. 336 с.
- 2. Белова Т.П., Кузякина Т.И., Зернова Л.Д., Ефимова М.В. // Экономические, социальные, правовые и экологические проблемы Охотского моря и пути их решения / Матер. регион. науч.-практич.конф. 17-19 мая 2006 г. Петропавловск-Камчатский: КамчатГТУ, 2006. С. 81.
- 3. Владимирова М.Г., Семененко В.Е. // Жизнь растений. М.: Просвещение, 1977. Т. 3. С. 367.
- 4. Герасименко Л.М., Ушатинская Г.Т. // Бактериальная палеонтология. М.: ПИН РАН, 2002. С. 36.
- 5. Голлербах М.М., Косинская Е.К., Полянский В.И. Синезеленые водоросли // Определитель пресноводных водорослей СССР. М.: Сов. наука, 1953. Вып. 2. 665 с.
- 6. Грачева И.М., Иванова Л.А., Кантере В.М. Технология микробных белковых препаратов, аминокислот и биоэнергия. М.: Колос, 1992. 375 с.
- 7. Ефимова М.В. Синезеленые водоросли (цианобактерии) поверхностных термопроявлений Камчатки и возможности их использования в биотехнологии: Автореф. дис. канд. биол. наук. Петропавловск-Камчатский, 2005. 26 с.
- 8. Ефимова М.В., Кузякина Т.И., Ефимов А.А. Способ культивирования термофильных цианобактерий: Патент РФ на изобретение № 2292389. Дата регистрации в Гос. реестре изобретений РФ 27.01. 2007 г. Бюл. № 3, 2007
- 9. Заварзин Г.А. Лекции по природоведческой микробиологии. М.: Наука, 2003. 348 с.
- 10. Мережко А.И. // «Цветение» воды. Киев: АН УССР, 1968. Вып. 1. С.187.
- 11. Мережко А.И. // «Цветение» воды. Киев: АН УССР, 1969. Вып. 2. С. 63.
- 12. Никитина В.Н. Синезеленые водоросли термальных источников Кавказа и Камчатки: Автореф. дис. канд. биол. наук. Л., 1977. 22 с.
- 13. Никитина В.Н. // Мат. XI съезда Русс. ботан. общ-ва (18-22 августа 2003 г., Новосибирск-Барнаул). Барнаул: АзБука, 2003. Т. 3. С. 129.
- 14. Определитель бактерий Берджи / Ред. Хоулт Дж., Криг Н., Снит П., Стейли Дж., Уильямс С. М.: Мир, 1997. Т.1. 431 с.
- 15. Орлеанский В.К. // Бактериальная палеонтология. М.: ПИН РАН, 2002. С. 47.
- 16. Пахомова М.В. // Бюл. МОИП. 1964. Т. 69. Вып. 3. С. 110.
- 17. Попова Т.Е. Развитие биотехнологии в СССР. М.: Наука, 1988. 200 с.
- 18. Практикум по микробиологии / Ред. Нетрусов А.И. М.: ИЦ «Академия», 2005. 608 с.
- 19. Ржетовский Р. // Непрерывное культивирование микроорганизмов. Теоретические и методологические основы. М.: Пищ. пром-сть, 1968. С. 359.
- 20. Сассон А. Биотехнология: свершения и надежды. М.: Мир, 1987. 416 с.
- 21. Bonch-Osmolovskaya E.A., Miroshnichenko M.L., Slobodkin A.I., Sokolova T.G., Karpov G.A., Kostrikina N.A., Zavarzina D.G., Prokofieva M.I., Rusanov I.I., Pimenov N.V. // Microbiology. 1999. V. 68 (3). Р. 343.
- 22. Castenholz R.W. // Microbial Mats: Stromatolites. N.Y.: Allan R. Lees, 1984. P.101.
- 23. Nold S.C., Ward D.M. // Applied and Enviromental Microbiology. 1996. V. 62 (12). Р. 4598.



