Введение. На сегодняшний день важно акцентировать внимание на актуальных проблемах педиатрии, которые ставят наиболее острые задачи перед современной диагностикой. В данный момент актуальным является выявление нарушений еще до появления клинически выраженных признаков болезни [7]. Показатели младенческой смертности в РФ, в сравнении с экономически развитыми странами, остаются на высоких цифрах [8]. До 70% инвалидности с детства является результатом патологии перинатального периода [4].
Состояния, отражающие процесс адаптации к родам, к новым условиям жизни, называют пограничными, которые при определенных условиях могут принимать патологические черты. Многие клинико-лабораторные показатели становятся неэффективными для ранней диагностики пограничных состояний, которые впоследствии развиваются в синдромы новорожденных [1]. Особенно проблематично прогнозировать развитие дисиндромов, когда у новорожденного к одному из характерных синдромов присоединяются дополнительные.
В патохимии любого синдрома новорожденных ключевую роль играют гипоксические расстройства, которые приводят к развитию окислительного стресса. К сожалению, до сих пор не изучены особенности окислительного стресса при дисиндромах [9].
Материалы и методы исследования. Обследовано 460 новорожденных, родившихся от здоровых матерей доношенными через естественные родовые пути. Среди обследованных – 103 новорожденных, выписанных с диагнозом «здоров», они составили контрольную группу. Остальные новорожденные распределены по группам: синдром срыгивания – 67, синдром гипервозбудимости – 38, болевой синдром – 58, синдром асфиксии – 67. Сочетание двух синдромов (дисиндромы): асфиксия+болевой – 15, асфиксия+гипервозбудимость – 15, срыгивание+асфиксия – 11, болевой синдром+срыгивание – 40, болевой синдром+гипервозбудимость – 12, срыгивание+гипервозбудимость – 34.
Для исследования использовали пуповинную кровь, забор которой выполняли сразу после рождения плода, со стабилизатором – 1,5% раствор ЭДТА в физ. растворе из расчета 0,1 мл стабилизатора на 2 мл крови.
Интенсивность аскорбат-индуцированного ПОЛ определяли по методике Львовской Е.И. [5; 6]. Для изучения интенсивности индуцированного ПОЛ (окисляемости липидов) к изопропанольным экстрактам сыворотки крови добавляли индуцирующую ПОЛ смесь (0,5 мМ аскорбиновой кислоты и 50 мкг сульфата железа). После чего через 10 минут проводили их спектрофотометрическое определение. Окисляемость липидных экстрактов оценивали по соотношению величин оптических плотностей Е232/Е220, Е278/Е220, определяемых до и после внесения инициирующей ПОЛ смеси, и выражали в процентах по отношению к исходному уровню.
Данные обрабатывались общепринятыми методами вариационной статистики и выражались в виде среднеарифметической (М) и ее стандартной ошибки (m). Оценка достоверности различий осуществлялась с помощью параметрических и непараметрических критериев. Для оценки различий в средних тенденциях использовались t-критерий Стьюдента и критерий Манна–Уитни (U). Статистически значимыми считались различия при р ≤ 0,05 [2; 3]. Для обработки результатов использовали пакет прикладных программ Statistica 6.0 for Windows и Excel.
Результаты исследования и их обсуждение. По уровню индуцированного ПОЛ имеется возможность косвенно определить эффективность действия липофильных антиоксидантов. В системе Fe+2/аскорбат-индуцированного ПОЛ переокислению подвергаются те ненасыщенные связи, которые не были подвержены свободно радикальному окислению в отсутствии индуктора во многом благодаря их защите липофильными антиоксидантами. Поэтому по содержанию первичных молекулярных продуктов ПОЛ (диеновых конъюгатов) в ответ на индукцию судят об окисляемости липидов. В свою очередь высокий уровень окисляемости поддерживается напряжением липофильных антиоксидантов. Соответственно имеются основания по уровню Fe+2/аскорбат-индуцированного ПОЛ дать интегральную оценку состояния липофильной антиоксидантной защиты, в которой, помимо альфа-токоферола, задействованы производные витамина А, а также продукты билирубинового обмена, стероидные факторы и т.д. [1; 6].
Большинство исследованных синдромов характеризовались снижением окисляемости липидов, что проявлялось в уменьшении содержания изопропанол-растворимых диеновых конъюгатов в ответ на Fe+2/аскорбат-индукцию (рис. 1).
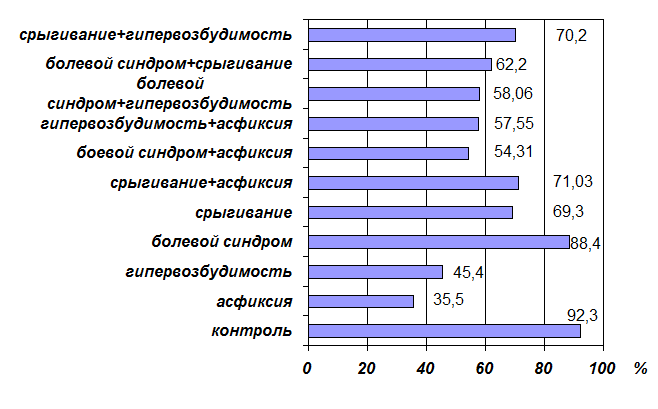
Рис. 1. Уровень Fe+2/аскорбат-индуцированного ПОЛ (% от контроля) при моносиндромах и их сочетаниях у новорожденных.
Причём наиболее заметное снижение уровня Fe+2/аскорбат-индуцированного ПОЛ наблюдалось при асфиксии – в 2,6 раза. В 2 раза снижено содержание Fe+2/аскорбат-индуцированных изопропанол-растворимых диеновых конъюгатов при синдроме гипервозбудимости. И только при болевом синдроме уровень Fe+2/аскорбат-индуцированного ПОЛ не отличался статистически значимо от контрольных значений (рис. 1).
Наслоение на болевой синдром гипервозбудимости ограничило масштабы роста уровня изопропанол-растворимых диеновых конъюгатов после индуцирования. Аналогичная ситуация наблюдалась при сочетании болевого синдрома с асфиксией и срыгиванием (рис. 1). Таким образом, присоединение к болевому синдрому других синдромов, для которых характерен сниженный уровень индуцированного ПОЛ, приводит к снижению эффективности липофильных антиоксидантов.
Противоположная ситуация наблюдается при наслоении других синдромов на синдромы «гипервозбудимость» и «асфиксия». Так, для дисиндрома «срыгивание + гипервозбудимость» по сравнению с синдромом «гипервозбудимость» характерен более высокий уровень Fe+2/аскорбат-индуцированного ПОЛ. Такая же тенденция прослеживается для дисиндрома «срыгивание + асфиксия» по сравнению с синдромом «асфиксия». Тем не менее уровень Fe+2/аскорбат-индуцированного ПОЛ был ниже контрольного уровня (рис. 1), что свидетельствует о снижении эффективности липофильной антиоксидантной защиты при рассматриваемых дисиндромах. Вследствие этого у детей с синдромами «гипервозбудимость», «срыгивание», «болевой синдром», «асфиксия», а также при их сочетании наблюдалось снижение липопероксидации по сравнению с контролем (рис. 1).
Выводы. Таким образом, для новорожденных с синдромами «гипервозбудимость», «срыгивание», «болевой синдром» и «асфиксия», а также при их различных сочетаниях характерно снижение окисляемости ненасыщенных связей в ацильных радикалах, что проявлялось в уменьшении содержания изопропанол-растворимых диеновых конъюгатов в ответ на индукцию в системе Fе +2/аскорбат. Данный факт может быть применен в практической работе в качестве ранней лабораторной диагностики в прогнозировании развития дисиндромов у новорожденных.
Рецензенты:
Шаповалов П.Я., доктор медицинских наук, профессор, зав. кафедрой гигиены с основами экологии. ГБОУ ВПО «Тюменская государственная академия Минздравсоцразвития России», г. Тюмень.
Ральченко И.В., доктор биологических наук, профессор, зав. кафедрой фармацевтической технологии и фармакогнозии с курсом ботаники. ГБОУ ВПО «Тюменская государственная академия Минздравсоцразвития России», г. Тюмень.



