Введение
Потенциально патогенные энтеробактерии в настоящее время приобретают все большее биологическое и медицинское значение. В качестве одной из причин этого явления рассматривают изменение патогенности этих микроорганизмов [1,2]. Несомненно, это относится и к энтерококкам, входящих в состав нормальной микрофлоры пищеварительного тракта человека, играющих важную роль в обеспечении колонизационной резистентности слизистых [2]. В то же время они являются представителями группы условно-патогенных бактерий, способных вызывать аутоинфекцию, а при накоплении в окружающей среде – приводить к экзогенному инфицированию [3,4].
В течение многих лет микроорганизмы этого рода рассматривали как клинически малозначимые. В последние годы роль микроорганизмов, относящихся к роду Enterococcus, возросла не столько из-за их широкого распространения, сколько из-за приобретения ими устойчивости к подавляющему большинству доступных антибактериальных препаратов, к действию физических, химических и биологических факторов [4].
В течение последних лет большое внимание уделяется анализу направленности межмикробных взаимоотношений ассоциативных микросимбионтов, что позволяет прояснить патогенез широкого спектра заболеваний, правильно оценить происхождение тех или иных аномалий в структуре микросимбионтов, приводящих к изменению их типичных или проявлению новых биологических свойств [8,9]. Однако недостаточно изученными остаются симбиозы бактерий и простейших обитающих в кишечном биотопе человека.
В последние годы особую актуальность приобрела широко распространенная протозойная инвазия, обусловленная паразитированием в толстом кишечнике простейших Blastocystis spp. Возбудитель бластоцистной инвазии является микроорганизмом, к усилению агрессии которого, с одной стороны, могут приводить факторы, снижающие защитные силы макроорганизма, а с другой стороны – микроорганизмы, входящие в состав биоценоза [10].
Проводимые исследования по характеристике ассоциативного симбиоза простейших с другими микроорганизмами ограничиваются изучением механизмов выживания и их взаимодействия вне макроорганизма, который также представляет собой среду обитания для огромного количества видов микробов [7,8]. В связи с этим вопрос о роли простейших в изменении выраженности патогенных свойств представителей симбиоценозов макроорганизма остается открытым.
Целью настоящей работы явилось изучение степени выраженности патогенных свойств бактерий E.faecalis, полученных в ходе совместного культивирования с простейшими Blastocystis spp. in vivo.
Материалы и методы
Объектом для изучения послужили культуры Еnterococcus faecalis, выделенные у лиц с заболеваниями ЖКТ, инвазированных бластоцистами. Для выделения чистых культур энтерококков использовали энтерококк агар (НПЦ, г. Оболенск) с последующим накоплением на Columbia agar (Bio-Rad, Франция) с кровью и идентификацией на среде Diskinson Oxoid (Himedia, Индия).
Для получения изолятов бластоцист фекалии собирали в чисто вымытые флаконы, не содержащие следов химических реактивов, дезинфицирующих веществ и антибиотиков. При доступе свободного кислорода бластоцисты погибали в течение нескольких часов, поэтому материал для посева использовали сразу после его поступления. Пробы фекалий заливали равным объемом (1:1) физиологического раствора, суспензировали и фильтровали. Фильтрат в объеме 0,5–1,0 мл вносили в пробирку с питательной средой Suresh, засевали одновременно 5–6 пробирок, и культивирование проводили в течение трех суток, при температуре 37 оС (Сахарова, 1997).
Для постановки кератоконъюнктивальной пробы использовали морских свинок массой 254,7+11,3 г. Заражение проводили суточной культурой свежевыделенных штаммов Е. faecalis, выращенных на среде Калины. В конъюнктивальную полость бактериологической петлей диаметром 2–5 мм вводили бактерии в дозе 101 – 1010. Для каждого штамма использовали не менее двух животных, заражая у них один глаз (второй служил контролем). Для этого фиксированному на столе животному с помощью петли вводили культуру под приподнятое верхнее веко и осторожными движениями петли распределяли культуру по своду конъюнктивы. После этого веки зараженного глаза смыкали на 1 мин. Животных содержали в индивидуальных клетках. Ежедневно в течение недели, начиная со второго дня, оценивали изменения слизистой оболочки глаза. Осмотр состояния конъюнктивы (век, склеры, свода) и роговицы проводили с использованием двух луп (с увеличением в 2–4 раза), фиксируя одной из них свет от настольной лампы на глаза животного, а через вторую поочередно рассматривали контрольный и зараженный глаз при раздвигании век. На каждую пробу заполняли протокол, регистрирующий выраженность признаков конъюнктивита (сужение глазной щели, гиперемия конъюнктивы, отек век, наличие и характер отделяемого конъюнктива) и состояние роговицы (Гинцбург и др., 2004).
Экспериментальное сокультивирование бактерий Е. faecalis с простейшими B.hominis осуществляли in vivo на модифицированной среде Suresh (приоритетная справка №2008115689 от 17.10.2009).
В работе использовали 210 морских свинок, которые разделили на 7 групп по 30 в каждой. Животных 1-й и 2-й групп заражали бактериями, выделенными совместно с авирулентными бластоцистами до и после совместного культивирования; 3-й и 4-й групп – бактериями, выделенными совместно с умеренно вирулентными бластоцистами до и после совместного культивирования; 5-й и 6-й групп – бактериями, выделенными совместно с высоковирулентными бластоцистами до и после совместного культивирования. Животным контрольной группы (40 свинок) вводили энтерококки, выделенные из ассоциаций, где бластоцисты не являлись участниками симбиоценоза.
Вирулентность микроорганизмов определяли путем внутрибрюшинного введения белым мышам массой 16–18 г 0,5 мл взвеси суточной культуры исследуемых микроорганизмов. Взвеси готовили путем серийных разведений различной концентрации от 101 КОЕ/мл до 109 КОЕ/мл. На каждый исследуемый штамм делали шесть таких разведений, которые затем вводили внутрибрюшинно беспородным белым мышам. Через сутки у каждого штамма определяли величину LD50. В соответствии с результатами проведенных экспериментов к высоковирулентным относили штаммы с LD50 от 101 до 103 КОЕ/мл, к умеренно вирулентным – от 103 до 106 КОЕ/мл, а штаммы c LD50 свыше 106 КОЕ/мл считали слабовирулентными (Костюкова и соавт., 1996).
Статистическую обработку данных проводили при помощи программы «Statistica for Windows» [6].
Результаты и их обсуждения
Анализ заражения животных бактериями E.faecalis, полученных при сокультивировании с простейшими Blastocystis spp., различной степенью вирулентности, выделенных из толстой кишки, показал, что через 18 часов после заражения у 19 свинок 6-й группы, 15 – 4-й, 9 – 5-й и 3 – 3-й отмечались проявления заболевания (табл. 1). Через 24 часа после заражения признаки кератоконъюнктивита наблюдались у всех 30 животных 6-й группы, 22 – 4-й, 19 – 5-й и 7 – 3-й группы.
Таблица 1
Сроки появления признаков кератоконъюнктивита у животных
|
№ п/п |
Группы E.faecalis в ассоциации |
18 ч |
24 ч |
2 сут. |
5 сут. |
7 сут. |
|
1. |
с авирулентными бластоцистами до совместного культивирования |
- |
- |
- |
2 |
1* |
|
2. |
после |
- |
- |
- |
2 |
1* |
|
3. |
с умеренно вирулентными бластоцистами до совместного культивирования |
3 |
7 |
13 |
21 |
26 |
|
4. |
после |
15 |
22 |
26 |
28 |
29 |
|
5. |
с высоковирулентными бластоцистами до совместного культивирования |
9 |
19 |
31 |
34 |
30 |
|
6. |
после |
19 |
30 |
30 |
30 |
30 |
|
7. |
контроль |
- |
- |
- |
1 |
- |
Примечание: * – количество экспериментальных животных.
Среди 28 животных 1-й и 2-й групп и 29 животных контрольной группы развития патологического процесса не было отмечено на протяжении 21 дня эксперимента. У заболевших животных отмечались сужение глазной щели, гиперемия конъюнктивы, отек век, отделяемое конъюнктивы, помутнение роговицы. Выраженность проявлений кератита и конъюнктивита также варьировала (табл. 2).
Таблица 2
Проявления экспериментального кератоконъюнктивита у морских свинок
|
Изучаемая группа |
Признаки |
||||
|
Сужение глазной щели |
Гиперемия конъюнктивы |
Отек век |
Отделяемое конъюнктивы |
Помутнение роговицы |
|
|
1. |
+ |
+ |
_ |
_ |
_ |
|
2. |
+ |
+ |
_ |
_ |
_ |
|
3. |
+ |
+ |
+ |
+ |
+ |
|
4. |
++ |
++ |
++ |
+ |
+ |
|
5. |
++ |
++ |
++ |
+ |
+ |
|
6. |
++ |
++ |
++ |
++ |
++ |
|
контроль |
+ |
+ |
_ |
_ |
_ |
Примечание:
± – незначительная выраженность признака;
+ – умеренная выраженность признака;
++ – значительная выраженность признака;
- – отсутствие признака.
В зависимости от длительности вызванного патологического процесса все изучаемые штаммы разделили на 4 группы (табл. 3).
Таблица 3
Вирулентность штаммов E.faecalis в соответствии с выраженностью кератоконъюнктивита
|
Степень вирулентности штаммов E.faecalis |
Выраженность и развитие изменений |
|||
|
конъюнктивит |
кератит |
|||
|
2-3 суток |
5-7 суток |
2-3 суток |
5-7 суток |
|
|
Авирулентные |
- |
+ |
- |
- |
|
Слабо вирулентные |
+ |
+ |
+ |
- |
|
Умеренно вирулентные |
+ |
++ |
+ |
+ |
|
Высоковирулентные |
++ |
++ |
+ |
++ |
Примечание:
± – незначительная выраженность признака;
+ – умеренная выраженность признака;
++ – значительная выраженность признака;
- – отсутствие признака.
В соответствии с данным критерием к авирулентным были отнесены 30, 30, 17, 4, 9, 30 штаммов энтерококков из 1-й, 2-й, 3-й, 4-й, 5-й и контрольной групп соответственно (рис. 1). К умеренно вирулентным причислены 18, 21 культуры бактерий из 3-й и 5-й групп соответственно, вызывавшие более выраженный и прогрессирующий к 5–7 суткам конъюнктивит при незначительном помутнении роговицы. Высоковирулентными оказались 23 и 30 штаммов E.faecalis из 4-й и 6-й групп соответственно. При заражении животных штаммами с данной вирулентностью было отмечено формирование прогрессирующих конъюнктивита и кератита, характеризующихся склеиванием изъязвленных век, обильным гнойным или гнойно-творожистым экссудатом, интенсивным помутнением роговицы. Слабовирулентных культур выделено не было.
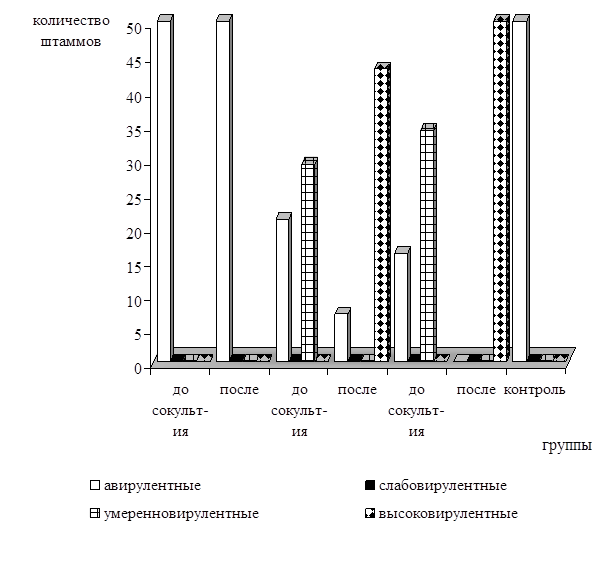
Рис. 1. Распределение различных по вирулентности штаммов E.faecalis среди изучаемых групп
Таким образом, проведенные исследования показали, что заражение животных бактериями E.faecalis, полученных из протозойно-бактериальных ассоциаций толстой кишки, приводило к развитию слабо выраженных кератита и конъюнктивита. Введение этих же штаммов бактерий после совместного культивирования с простейшими Blastocystis spp. сопровождалось формированием прогрессирующих конъюнктивита и кератита, характеризующихся склеиванием изъязвленных век, обильным гнойным или гнойно-творожистым экссудатом, интенсивным помутнением роговицы.
Заключение
Изучение степени выраженности патогенных свойств бактерий E.faecalis, полученных в ходе совместного культивирования с простейшими Blastocystis spp. in vivo, свидетельствует об изменении адаптивных возможностей бактерий под воздействием ассоциативных симбионтов бластоцист, приводящем к селекции и накоплению вирулентных вариантов в гетерогенной бактериальной популяции как механизма приспособления микросимбионтов к условиям существования в протозойно-бактериальных ассоциациях.
Работа выполнена при поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы (№14.B37.21.2010)Рецензенты:
Нестеров А. С., д.м.н., профессор кафедры инфекционных и кожно-венерологических болезней ФГБОУ ВПО «УлГУ», г. Ульяновск.
Ильина Н. А., д.б.н., профессор кафедры зоологии ФГБОУ ВПО «УлГПУ им. И. Н. Ульянова», г. Ульяновск.



