Введение
В системе взаимоотношений «дерево – насекомые» биохимический состав кормового субстрата (хвои и листьев) имеет исключительно важное значение. Это обусловлено тем, что многие вторичные метаболиты в хвое и листьях растений в значительной степени детерминируют параметры энтоморезистентности кормового субстрата [1,3-10]. В свою очередь это определяет (со стороны древостоя) возможность возникновения вспышек массового размножения, наносящих часто значительный эколого-экономический ущерб лесным фитоценозам [2]. Это направление исследований в последние десятилетия развивается особенно интенсивно. Но, несмотря на это, полностью однозначной картины механизмов энтоморезистентности (как конститутивной, так и индуцированной) пока нет [1-10]. Установлено, что протективными свойствами против насекомых обладают аллелохимики из всех классов вторичных метаболитов: терпеноиды, фенолы, алкалоиды [1,3-9]. Для лиственных древесных растений наибольшее значение в энтоморезистентности имеют фенольные соединения [4]. Включение механизмов индуцированной энтоморезистентности (как быстрой, так и замедленной) вызывает у насекомых-фитофагов быстрое снижение выживаемости популяции за счет высокой смертности, снижение плодовитости и скорости онтогенеза [1–10]. Многие исследования показали, что в листьях кормовых растений после дефолиации насекомыми-фитофагами повышается количество фенолов и других веществ с «антибиотическими» свойствами [1, 6–9]. Известно, что постоянная хроническая дефолиация сосны сопровождается снижением содержания сухого вещества в хвое, повышением содержания азота и снижением продукции вторичных метаболитов, а воздействие фактора абиотического стресса (засуха) сопровождается снижением содержания азота в хвое, фенолов и танинов, по сравнению с древостоем, не подвергнутым воздействию стресса. Известно, что в течение вегетационного сезона содержание фенолгликозидов и других соединений снижается.
Фенольные соединения участвуют как в конститутивном, так и в индуцированном иммунитете растений. На следующий год после сильной дефолиации растения фитофагами в тканях растения усиливается синтез и накопление фенольных соединений [3]. Содержание флавоноидов значительно выше в листьях растений через 1 год после [1,6]. Мартемьянов с сотр. [5] установил, что после дефолиации в листьях березы отмечено незначительное снижение содержания хлорогеновой кислоты, но оно было статистически недостоверным. Содержание мирицетин-гликозида, наоборот, возрастало на 39 %, а кверцетин-гликозида снижалось.
Известно, что для активизации фактора индуцированной энтоморезистентности у древостоев существует определенная критическая дефолиация крон. Разными авторами приводятся различные значения критического уровня дефолиации. Так, Бахваловым с сотр. [1] показано, что индуцированная энтоморезистентность у березы повислой в условиях Западной Сибири активируется наиболее заметно лишь при сильной и полной дефолиации. Ранее нами было установлено, что в условиях лесостепной зоны Зауралья, в древостоях, нарушенных антропогенными факторами, критическим уровнем дефолиации крон, в результате которого активно проявляется индуцированная энтоморезистентность является 30–40 % дефолиация [2].
Задачей данного исследования было изучение с помощью ВЭЖХ воздействия фактора ежегодной слабой и средней дефолиации на содержание фенолсодержащих соединений в листьях березы повислой в условиях лесостепи Зауралья в древостоях, ослабленных антропогенными факторами.
Материалы и методы
Для хроматографического анализа проводился сбор листьев березы повислой из очагов массового размножения непарного шелкопряда на пробных площадях с ежегодно регистрируемым процентом дефолиации крон и за границей очагов, где отсутствовала дефолиация. Взятие каждой пробы осуществлялось от нескольких деревьев. Район очагов массового размножения находится в Каменск-Уральском р-не Свердловской обл. Пробная площадь № 1 и 2 располагалась в березняках вблизи пос. «Покровское», № 3 – вблизи пос. «Кисловское».
Экстракцию фенольных соединений из листьев березы проводили в обратном холодильнике на водяной бане 96 % этиловым спиртом в течение 30 мин при кипении раствора. Для этого листья березы высушивали при комнатной температуре, затем размалывали. После этого суспензию центрифугировали при 10000 g в течение 10 мин. Хроматографический анализ проводили на жидкостном хроматографе Scimadzu LC-20 со спектрофотометрическим УФ детектором. Детектирование элюента осуществляли одновременно на двух полосах поглощения: 254 и 360 нм на хроматографической колонке PerfectSil Target ODS-3 5мкм с обращенной фазой, размерами 250 х 4,6 мм. Градиентное элюирование проводилось в диапазоне 10–50 % со скоростью 1 мл в мин при температуре 40 0 С. Элюент А – ацетонитрил – 0,05 М фосфатный буферный раствор (рН=3,0); элюент В – ацетонитрил-вода (9:1). Продолжительность хроматографического анализа – 45 мин. Из них от 0 до 30 мин проводилось градиентное элюирование в диапазоне 10- 50%, затем в течение 15 мин при концентрации 50 %. Для идентификации фенольных соединений использовали вещества-свидетели фирмы: Fluka, Sigma, Aldrich.
Результаты и обсуждение
Хроматографический анализ фенолсодержащих соединений из листьев березы из очагов и за их границами позволил выявить 37 различных соединений (рис. 1). Как показали результаты, в контрольных древостоях (без дефолиации) содержание ряда фенолсодержащих соединений в листьях березы оказалось достоверно ниже, чем в древостоях, которые ранее периодически подвергались средней и сильной дефолиации (табл. 1). Это галловая кислота, гиперозид, рутин, кофейная кислота, в некоторых вариантах феруловая кислота, а также аскорбиновая кислота. Возможно, это связано с тем, что отсутствие периодических вспышек массового размножения непарного шелкопряда на северной границе ареала вспышек обусловлено не постоянно повышенным содержанием в листьях антифидантных соединений, как можно было предполагать, а лишь благодаря менее благоприятным экологическим условиям для развития очагов массового размножения этого фитофага. Кроме того, из-за отсутствия фактора дефолиации в этих древостоях отсутствует и индуцированная энтоморезистентность, которая вызывает активизацию синтеза ряда антифидантных соединений в листьях. Следовательно, генетически эти березовые древостои могут и не иметь высокого уровня энтоморезистентности. Содержание ряда других фенолсодержащих соединений в контрольных древостоях было более высоким, чем в ранее дефолиируемых. Это – кверцетин (по сравнению с пробами №2 и 3), кафтаровая кислота, 3-кофеоилхинная кислота, 4-кофеоилхинная кислота, 5-кофеоилхинная кислота) (табл. 1). Анализ влияния фактора дефолиации на содержание фенолсодержащих соединений в листьях березы в очагах в насаждениях с ПП № 1, где складываются наиболее благоприятные условия для роста численности популяции и возникновения очагов (рис. 1), показал, что, несмотря на отсутствие средней и сильной дефолиации в течение последних 6 лет и наличие лишь ежегодной слабой дефолиации (10–20 %), в этой пробе выявлено повышенное содержание как ряда флавоноидов, так и фенилкарбоновых и оксикоричных кислот (табл. 1). Так, содержание галловой кислоты оказалось выше, чем в контроле на 66,7 %, гиперозида – выше на 23,3 %; рутина – на 96,3 %; кофейной кислоты – на 23,8 %, аскорбиновой кислоты – на 27,6 %. При этом содержание кверцетина достоверно не изменилось (табл. 1). Содержание феруловой кислоты оказалось ниже контроля на 25,0 %, кафтаровой – на 27,9 %, трех изомеров хлорогеновой кислоты (3-КХК, 4-КХК; 5-КХК) ниже, соответственно, на 27,5 %, 16,7 % и 78,8 %. Практически, сходные закономерности были выявлены нами и в пробе № 2. Единственное отличие этого варианта заключалось в том, что при ежегодной слабой дефолиации в 2010 г. отмечена 60 % дефолиация, в отличие от пробной площади, где взята проба №1. Как показали результаты, уровень возрастания некоторых фенолсодержащих соединений был еще выше, чем в предыдущем варианте. Так, содержание гиперозида было выше, чем в контрольных насаждениях на 48,3 %, рутина – на 93,3 % и аскорбиновой кислоты – на 153,5 % (табл. 1). Уровень увеличения содержания в пробе № 2 галловой кислоты, наоборот, был менее значительным, чем в пробе №1 (на 33,4 %) (табл. 1). Содержание тех же соединений, как и в участке № 1, также снижалось, но степень снижения содержания кафтаровой кислоты и 3-КХК была заметно выше и составляла, соответственно, 67,69 % и 71,0 %. Содержание 4КХК не изменялось. В отличие от пробы № 1, в которой содержание кверцетина не изменялось, в пробе № 2 оно снижалось, в среднем, на 19,3 %. Как показали результаты, в пробе № 3 содержание фенолсодержащих соединений заметно отличалось, как от пробы 1, так и от пробы 2.
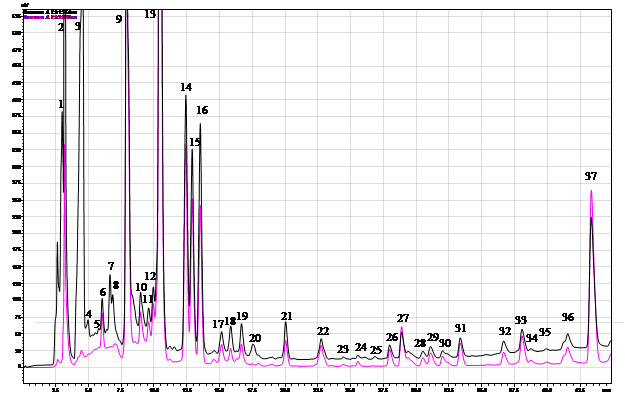
Рис. 1. ВЭЖХ экстракта из листьев березы повислой после ежегодной дефолиации непарным шелкопрядом. 1 – аскорбиновая к-та; 3 – галловая к-та; 4 – неидентифицированное соединение с Tr = Tr гидрохинона; 5 – кофейная к-та; 8 – 5-кофеоилхинная к-та; 10 – феруловая к-та; 11 – рутин; 12 – 4- кофеоилхинная к-та; 13 – гиперозид; 24 – кверцетин
В листьях этой пробы содержание кверцетина было ниже, чем в контроле на 39,14 %; содержание кафтаровой кислоты, в отличие от варианта № 2, снижалось значительно меньше (на 32,8 %), а содержание гиперозида заметно (на 33,3 %) снижалась как по сравнению с контролем, так и с двумя предыдущими пробами (табл. 1). Содержание феруловой кислоты, наоборот, было выше (на 84,9 %), чем в контроле и двух предыдущих пробах. Возможной причиной различного содержания фенолсодержащих соединений могло быть следующее: в насаждениях участка № 3 уже в течение последних 6 лет, в отличие от двух предыдущих участков, отсутствовала средняя и сильная дефолиация, а наблюдалась лишь 0–10 %-ная дефолиация крон. Кроме того, в березняках участка № 3 отсутствовало и резкое колебание заселенности березы кладками непарного шелкопряда, как это было характерно для двух предыдущих участков, а средняя заселенность кладками была значительно ниже (в год взятия проб), чем в двух остальных участках (рис. 2). Размах колебаний численности кладок был значительно ниже.
Таблица 1. Влияние фактора дефолиации березы повислой на содержание в листьях фенолсодержащих соединений
|
Наименование |
Абсорбция (mV) |
|||
|
|
Контроль |
ПП №1 |
ПП №2 |
ПП №3 |
|
Кверцетин |
7,0±0,61 |
7,25±0,47 |
5,65±0,64 |
4,26±0,33 |
|
Кафтаровая к-та |
101,2±8,18 |
73,0±8,15 |
32,7±4,11 |
68,0±8,21 |
|
Гиперозид |
1287,5±142,15 |
1587,67±131,18 |
1909,33±127,81 |
858,67±72,61 |
|
Галловая к-та |
471,5±56.87 |
786,0±16.15 |
629,0±64.12 |
520,0±48.37 |
|
⃰Неидентифицированное соединение |
71,67±9,18 |
43,0±5,31 |
44,05±5,22 |
18,7±2,06 |
|
Рутин |
26,75±3,78 |
52,5±611 |
36,25±4,28 |
36,0±2,85 |
|
Кофейная к-та |
10,5±1,71 |
13,0±1,82 |
10,75±1,27 |
5,95±0,69 |
|
Феруловая к-та |
22,0±3,08 |
16,5±2,55 |
26,25±2,19 |
40,67±5,31 |
|
Аскорбиновая к-та |
137,5±2,18 |
175,5±2,74 |
348,5±4,12 |
157,33±17,32 |
|
3-кофеоилхинная к-та |
20,0±2,67 |
14,5±1,56 |
5,8±0,72 |
8,05±0,97 |
|
4- кофеоилхинная к-та |
24,0±2,92 |
20,0±2,81 |
26,0±3,06 |
32,8±3,77 |
|
5- кофеоилхинная к-та |
26,0±3,01 |
5,5±0,48 |
5,0±0,62 |
7,0±0,84 |
Tr неидентифицированного соединения = Tr гидрохинона
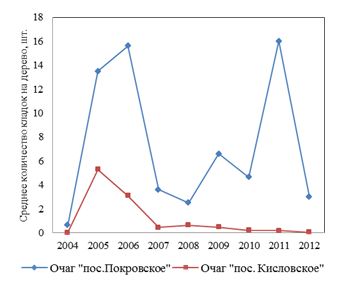
Рис. 2. Динамика заселенности кладками непарного шелкопряда березняков в локальных очагах
В то же время в этих древостоях в предыдущие годы [2] наблюдалась вспышка массового размножения с сильной дефолиацией крон. Характер популяционной динамики был более сходен с таковым в лесах Челябинской обл., но в фазе депрессии заселенность древостоев кладками и размах колебаний этого параметра обычно значительно ниже, чем на участках № 1 и 2 [2]. Поэтому можно предполагать, что именно у деревьев, растущих на ПП 2, наблюдается наиболее выраженный рост индуцированной энтоморезистентности. Это – заметно более значительное возрастание содержания фенолсодержащих соединений в этом варианте, по сравнению с древостоями на пробной площади № 1 и полное отсутствие ее в варианте № 3 (табл. 1). Вместе с тем мы сочли целесообразным и проверку гипотезы о возможности проявления индуцированной энтоморезистентности на фактор ежегодной слабой (до 30 %) дефолиации крон березы. Это наблюдалось у галловой кислоты, гиперозида и аскорбиновой кислоты. Вследствие того, что не все фракции были идентифицированы, осталось неясным влияние фактора дефолиации на неидентифицированные пики. Для оценки вклада этих фракций мы изучали влияние этого фактора на пики № 14–16 и № 21. Как показали результаты, в варианте с наиболее высоким уровнем дефолиации (№ 2) высота пика № 14 возрастала на 96,7 %, пика № 16 – на 90,5 %, пика № 21 – на 224,3 %, тогда как содержание вещества в пике № 15 снижалось на 24,3 %. Таким образом, спектр соединений, содержание которых заметно возрастает после дефолиации, значительно шире.
В целом нами показано, что содержание некоторых фенолсодержащих соединений в листьях березы повислой в древостоях, где ежегодно наблюдается повышенная заселенность кладками непарного шелкопряда и частичная дефолиация крон, заметно отличается от насаждений, которые расположены за границами очагов массового размножения этого фитофага. Наиболее значительные различия наблюдались в образцах с 60 %-ной дефолиацией, менее значительные – в образцах с ежегодной слабой дефолиацией. Заметно возрастают содержания ряда фенолсодержащий соединений в листьях: как флавоноидов (гиперозида – на 48,3 %), (рутина – на 93,3 %), так и фенолокислот (галловой кислоты на 33,4 %), аскорбиновой к-ты – на 153,5 %. Содержание других соединений, наоборот, заметно снижается (кафтаровая кислота (на 67,79 %), 3КХК – на 71,0 %; 5КХК – в 5,1 раза). В экотопах с минимальной заселенностью кладками хроматографический спектр фенолсодержащих соединений был наиболее близок к контролю. На основании полученных результатов можно предполагать, что в экотопах с постоянно повышенным уровнем заселенности кладками непарного шелкопряда ежегодная слабая (до 30 %) дефолиация крон березы, вероятно, способна активировать синтез ряда антифидантных фенолсодержащих соединений в листьях, что сопровождается возрастанием уровня индуцированной энтоморезистентности у древостоев. Более высокий уровень дефолиации крон березы сопровождается и наиболее значительными изменениями в содержании фенолсодержащих соединений.
Рецензенты:
Усольцев Владимир Андреевич, доктор сельскохозяйственных наук, профессор, профессор Уральского государственного лесотехнического университета, г. Екатеринбург.
Менщиков Сергей Леонидович, доктор сельскохозяйственных наук, заведующий отделом лесоведения ФГБУН Российской Ботанический сад Академии наук, г. Екатеринбург.



