Введение
В условиях сокращения добычи океанической рыбы и морепродуктов, а также снижения биологических ресурсов внутренних водоемов надежным источником увеличения объемов пищевой продукции является аквакультура [1]. Несмотря на накопленный опыт и достижения в области аквакультуры, современный уровень развития общества требует разработки наукоёмких технологий, направленных на получение жизнеспособной молоди, обладающей высокими темпами роста, устойчивой к воздействию неблагоприятных факторов окружающей среды.
Высокая чувствительность рыб в период эмбрионально-личиночного развития к действию различных абиотических факторов, прежде всего, кислородной недостаточности, являющейся неотъемлемой частью технологических процессов при искусственном разведении рыб, явились основанием для проведения исследований, связанных с изучением механизмов адаптации эмбрионов рыб к гипоксии. Данные механизмы направлены на поддержание адекватного метаболизма и снижение уровня свободнорадикального перекисного окисления липидов (СПОЛ). Считается, что их регуляция обеспечивается за счет накопленных в яйце самок антиоксидантных соединений в процессе оогенеза. Таким образом, икру рыб можно рассматривать как замкнутую систему с отсутствием возможности поступления в неё из окружающей среды высокомолекулярных соединений, обладающих противопероксидными и антиоксидантными свойствами. В этой связи изучение изменения каротиноидов в динамике развития эмбрионов рыб под влиянием резкого изменения кислородного режима и температур, а также возможность управления этими процессами определяют актуальность настоящего исследования.
Считается, что пигменты представляют наименее изученную группу соединений, участвующих в регуляции процессов дыхания, а также защите организма эмбрионов от негативного действия активных кислородных метаболитов (АКМ) [6]. Их повышенная экспрессия, по данным отечественных и зарубежных авторов, является неспецифической реакцией организма при резком изменении различных параметров окружающей среды [5, 9]. Работ, посвященных участию каротиноидов в реакциях защиты организма рыб от АКМ в период эмбрионально-личиночного развития, по данным анализа литературных источников, недостаточно. Это явилось основанием для изучения роли каротиноидов в обеспечении программы индивидуального развития эмбрионов и личинок карпа при изменении температурного режима и кратковременной гипоксии, а также поиска методов управления окислительными процессами в организме с использованием антиоксиданта «Тиофан».
Цель исследования - изучить влияние антиоксиданта «Тиофан» на изменение содержания каротиноидов в динамике эмбрионально-личиночного развития и адаптации к технологическим нагрузкам.
Материал и методы исследования
Эксперимент проводился в инкубационном цехе специализированного рыбоводного предприятия ООО «Маяк» Алтайского края. Оплодотворение икры породы рыб Алтайский зеркальный карп (Cyprinus carpio) производили «сухим русским» способом. Половые продукты самок контрольной группы обесклеивали традиционно, с использованием молока (из расчета пол-литра на 8 литров воды). В опытной группе вместо традиционного способа обесклеивания икры использовали 1%-ный раствор антиоксиданта «Тиофан» в том же соотношении. Дальнейшую инкубацию икры проводили в проточной воде при температуре 20-23 о С. Все исследования были проведены в десяти повторах.
Особенности развития эмбрионов карпа обеих групп оценивали в проходящем свете на живой икре с использованием комплекса оптико-структурного анализа «OlimpusBBS». Темпы роста и развития у предличинок и личинок оценивали по доступным для прижизненного наблюдения морфологическим параметрам: длина тела и головы, ширина головы, диаметр глазного бокала и желточного мешка [8]. Количественное содержание каротиноидов в ацетоновых вытяжках икры определяли спектрофотометрически при соответствующей длине волны [6]. Интенсивность дыхания оценивали согласно методике Винклера [2]. Статистическую обработку данных проводили с использованием t-критерия Стьюдента.
Результаты исследований и их обсуждение
В рамках настоящего исследования были сформулированы положения научной гипотезы, требующие доказательства или опровержения. Вода является внешней средой для организма рыб, и ее параметры во многом оказывают влияние на прохождение всех критических этапов раннего онтогенеза. При использовании для инкубации икры воды из естественных открытых водоемов, в связи с отсутствием фотосинтеза у низших водных растительных организмов в ночные периоды, происходит колебание содержания кислорода в воде. Это может приводить к кратковременной гипоксии, активации СПОЛ и включению механизмов антирадикальной защиты за счет запасов природных антиоксидантных соединений, прежде всего, каротиноидов [3, 6]. В этой связи особый интерес представляет изучение роли каротиноидов в обеспечении антирадикальной защиты клеток эмбрионов.
Каротиноиды входят в состав большой группы истинных пигментов, представленных в икре в виде свободных каротиноидов и белково-каротиноидных комплексов. Используемая в исследовании методика количественного определения данных соединений позволяет определить содержание свободной от связи с белками фракции. Установлено, что именно свободный от связи с белками пул каротиноидов обладает антиоксидантной активностью. Их высвобождение от связи с белками происходит на разных этапах эмбриогенеза постепенно и связано с возрастающей потребностью в обеспечении антирадикальной защиты [6].
При анализе результатов исследования, приведенных на рисунке 1, обнаруживается, что в течение всего периода в икре рыб контрольной группы, начиная от оплодотворения и до 30 часов развития, происходит возрастание свободной от связи с белком фракции каротиноидов. С нашей точки зрения, это объясняется необходимостью их участия в механизмах антирадикальной защиты. В образцах икры опытной группы, которым в период обесклеивания вводили антиоксидант «Тиофан», содержание каротиноидов в указанный временной интервал оставалось стабильным, что позволяет сделать вывод о том, что введение антиоксиданта «Тиофан» обеспечивает выполнение им своих специфических функций и не требует расхода собственных антиоксидантных соединений, а именно каротиноидов. Можно предположить, что повышение в исследуемых образцах икры контрольной группы уровня свободной от белков фракции каротиноидов является адаптивной реакцией яйца на СПОЛ. Оценить эффективность антирадикальной защиты возможно лишь при визуальном анализе доступных морфологических структур.
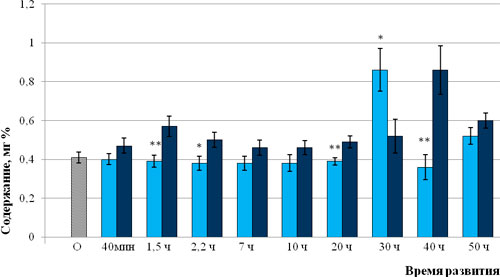
Рис. 1. Содержание пигментов в икре зеркального карпа контрольной и опытной групп: - оплодотворенная икра; - опытная группа; - контрольная группа
Примечание: достоверное различие опытной группы относительно контрольной группы (*р ≤ 0,05; **р ≤ 0,01).
По данным литературного анализа, используемая методика позволяет идентифицировать не только каротиноиды, но и меланин. Доказано, что его синтез осуществляется в меланофорах, которые впервые удается идентифицировать на сроке 30 часов развития. Именно этим можно объяснить резкое увеличение исследуемого показателя в данной точке отбора проб. Можно предположить, что изменение уровня свободной фракции каротиноидов в течение критических периодов развития у эмбрионов рыб контрольной группы на стадиях дробления, гаструляции и органогенеза связаны с их адаптивным участием в инактивации АКМ. Вместе с тем использование данного метода не позволяет оценить уровень антирадикальной защиты и требует проведения морфологического анализа. Наиболее убедительно данное утверждение доказывается при морфологическом анализе свободных эмбрионов в 1-е, 2-е и 3-и сутки после выклева. Результаты исследования показали, что эмбрионы контрольной группы отставали от опытной по всем исследуемым параметрам (табл. 1).
Морфометрические показатели предличинки карпа контрольной и опытной групп в первые дни после выклева (мм)
Таблица 1
|
Показатель |
1-е сутки после выклева |
2-е сутки после выклева |
3-и сутки после выклева |
|||
|
контроль |
опыт |
контроль |
опыт |
контроль |
опыт |
|
|
длина тела |
5,845±0,11 |
5,966±0,1 |
6,586±0,09* |
6,965±0,12 |
9,498±0,13* |
9,975±0,17 |
|
длина головы |
1,527±0,05 |
1,576±0,04 |
1,565±0,09 |
1,560±0,05 |
2,107±0,09 |
2,143±0,14 |
|
высота головы |
1,018±0,02* |
1,123±0,04 |
1,083±0,03* |
1,247±0,07 |
1,413±0,08 |
1,606±0,06 |
|
диаметр глаза |
0,395±0,02* |
0,487±0,03 |
0,483±0,02 |
0,494±0,03 |
0,624±0,05 |
0,637±0,15 |
|
диаметр желточного мешка |
1,134±0,06* |
1,279±0,04 |
1,117±0,05 |
1,068±0,03 |
1,045±0,03* |
0,892±0,06 |
Примечание: различие опытной группы относительно контрольной (*р≤0,05)
Диаметр желточного мешка является одним из наиболее важных морфометрических показателей, указывающих на интенсивность расходования органических субстратов. Считается, что изменение его содержания связано с расходованием пластического материала на обеспечение роста и развития эмбриона и, как правило, сопряжено с увеличением линейных размеров. При исследовании данного показателя у животных контрольной группы обнаруживается несоответствие между длиной тела и диаметром желточного мешка. При меньшей площади желточного мешка длина тела у эмбрионов контрольной группы на 2,03 % меньше по сравнению с эмбрионами опытной группы. С нашей точки зрения, данное противоречие можно объяснить повышенным расходованием пластических материалов желтка не на рост и развитие, а на окисление органических компонентов яйца в результате усиления СПОЛ. Наличие в составе желтка икры полиненасыщенных жирных кислот в условиях гипоксии приводит к их свободнорадикальному окислению, что, по сути, исключает их из общего метаболизма и приводит к его «холостому» расходованию.
Полученные результаты позволяют считать, что за счет своих специфических свойств антиоксидант «Тиофан» препятствует развитию СПОЛ и обеспечивает рациональное использование эмбрионом трофического материала желтка. Это убедительно демонстрируется результатами биохимического анализа состояния свободной или связанной фракции каротиноидов, а также превышением диаметра желтка у эмбрионов опытной группы в первые сутки после выклева. С нашей точки зрения, данные показатели имеют особое значение при переходе предличинки на смешанное питание в промежутке между 2-ми и 3-ми сутками после выклева. Принимая во внимание, что СПОЛ является системной реакцией и развивается в клетках всех тканей эмбрионов, повреждение клеток кишечной трубки продуктами СПОЛ определяет нарушение процессов пищеварения уже на ранних этапах постэмбрионального развития [6, 4]. Следствием этого является снижение темпов роста, что убедительно демонстрируется результатами исследования морфометрических характеристик личинок, приведенных в таблице 1.
Коэффициент потребления кислорода у рыб породы Алтайский зеркальный карп в эмбриональный период развития (Мг О2/л)
Таблица 2
|
Возраст Группа |
Эмбрионы |
Предличинки |
Личинки |
|
Тиофан |
1,7±0,11* |
1,7±0,16* |
1,1±0,18* |
|
Молоко |
2,3±0,13 |
2,3±0,1 |
2,3±0,26 |
Примечание: различие опытной группы относительно контрольной (*р ≤ 0,05).
Однократное использование антиоксиданта «Тиофан» в процессе обесклеивания оплодотворенной икры позволяет получить преимущества личинкам опытной группы не только в темпах роста. Функциональное состояние сердечно-сосудистой системы является интегральным показателем благополучия особи, а также отражает состояние транспорта трофических веществ и кислорода к клеткам тканей и органов. Исследование в проходящем свете образцов икры опытной группы в первые сутки после выклева показывает, что частота сердечных сокращений у личинок опытной группы превышает данный показатель контрольных особей на 11,85 %.
В соответствии с классическими представлениями эмбриологии рыб, увеличение дыхания связывается с повышением общего метаболизма за счет расходования трофического материала желтка и направлено на обеспечение темпов роста и развития. При анализе данных относительно количества потребляемого кислорода эмбрионами, предличинками и личинками, приведенных в таблице 2, можно считать, что в условиях гипоксии уменьшение ресурсов желточного мешка в образцах рыб контрольной группы сопряжено не столько с интенсивностью дыхания, сколько с расходованием кислорода вследствие увеличения свободнорадикального перекисного окисления липидов и других органических субстратов желтка [4]. В соответствующих образцах опытной группы рациональное расходование органических веществ сочеталось с более высокими темпами роста и развития и снижением интенсивности дыхания по сравнению с контролем. Полученные данные позволяют позиционировать «Тифан» не только как антиоксидантное соединение, но и как антигипоксант.
Таким образом, результаты проведенного исследования показали, что в условиях гипоксии увеличение свободнорадикальных продуктов требует повышенного расходования каротиноидов и трофических ресурсов желтка. При переходе на смешанное питание недостаточность данных ресурсов ограничивает рост и формирование органов различных физиологических систем. Использование антиоксиданта «Тиофан» способствует снижению уровня окислительных процессов и рациональному расходованию органических компонентов желтка, оказывает протективный эффект на клетки формирующихся органов.
Рецензенты:
Вартапетов Лев Гургенович, доктор биологических наук, профессор, заместитель директора по науке Института систематики и экологии животных СО РАН, г. Новосибирск.
Айзман Роман Иделевич, доктор биологических наук, профессор, заведующий кафедрой анатомии, физиологии и безопасности жизнедеятельности ФГБОУ ВПО «Новосибирский государственный педагогический университет», г. Новосибирск.



