В последние годы актуальность проблемы микозов и микотоксикозов постоянно возрастает. Отмечено, что проблема микотоксинов является составной частью глобальной проблемы загрязнения биосферы. Большую опасность для здоровья человека и животных представляют плесневые микроскопические грибы, продуцирующие токсичные метаболиты, - микотоксины. Ведущая роль среди микроскопических грибов, продуцирующих микотоксины, принадлежит микромицетам рода Aspergillus, в частности A. flavus [4].
Установлено, что метаболиты гриба Aspergillus flavus обладают выраженным канцерогенным и гепатотропным действием [1]. Впервые гепатокарцинома в хроническом опыте была получена у крыс, которых вскармливали арахисовой мукой, зараженной A. flavus, позже было доказано, что канцерогенное действие арахисовой муки обусловил афлатоксин В1. Помимо гепатоканцерогенного эффекта микотоксины способны вызывать аденомы и аденокарциномы в легких, желудке, почках, а также саркомы на месте подкожного введения [3].
Одним из наиболее опасных свойств микотоксинов является их тропность к эмбриональным тканям. Так, обнаружен повышенный уровень афлатоксинов в 48 % проб пуповинной крови и в материнской крови у обследованных родильниц, что доказывает способность афлатоксинов концентрироваться в организме плода [5]. Микотоксины обладают выраженным цитотоксическим действием. В очень низких концентрациях они способны оказывать токсическое влияние на культуры клеток и тканей организма и вызывать их деструкцию. Установлена высокая чувствительность к микотоксинам культур эмбриональных клеток печени человека и животных, эмбриональных клеток почек, легкого животных, фибробластов кожи человека, HеLа, а также лейкоцитов. Токсическое действие на культуры клеток проявляется в виде деструктивных изменений, подавлении их роста, ингибировании синтеза белка и ДНК, снижении митотической активности, нарастании числа хромосомных аберраций [6].
Отмечено влияние микотоксинов на биосинтез нуклеиновых кислот и белка, выраженное повреждающее их действие, на мембраны лизосом и отдельные субклеточные мембранные структуры. Алиментарный микотоксикоз в эксперименте снижает содержание фибриногена V, VIII, IX факторов свертывания крови, уровень гемоглобина и количества эритроцитов, уменьшает размеры тромбоцитов. Есть пример постоперационной артериальной эмболии, когда из тромба выделили культуру A. flavus. Описано развитие геморрагического синдрома при инвазивных микозах у детей, что, по мнению авторов, объясняется способностью плесневых грибов инвазировать кровеносные сосуды с развитием некротизирующего ангиита, нередко заканчивающегося летально [7].
Следовательно, микотоксины обладают широким спектром воздействия на макроорганизм. Одним из наиболее опасных токсинов микроскопических грибов является афлатоксин В1. Однако исследование микотоксинов проводится, как правило, у микромицетов, контаминирующих пищевые продукты. Наличие же их у грибов, выделенных у пациентов, как с выраженными клиническими проявлениями заболевания, так и при персистирующих инфекциях, остается мало изученным.
Цель работы
Выявить токсичность и продуцирование афлатоксина В1 у клинических изолятов микромицетов Aspergillus flavus, выделенных у пациентов с заболеваниями, вызванными условно патогенными микроорганизмами.
Материалы и методы
Изучены 64 штамма микромицетов А. flavus, выделенных у пациентов с заболеваниями, вызванными условно патогенными микроорганизмами (УПМ). Клинические изоляты микромицетов получали путем посева биоматериала на среду Сабуро. Их токсичность определяли внутрибрюшинным тестом на белых мышах (Dl50), энтеротоксическую активность - методом изолированных сегментов тонкой кишки кроликов с определением индекса дилатации (ИД).
Афлатоксин В1 выявляли методом высокоэффективной жидкостной хроматографии (ВЭЖХ), которую выполняли при следующих условиях: подвижная фаза - эфир-метанол-бидистиллированная вода (95:4:1, скорость потока подвижной фазы 1 мл/мин). Из культуральной жидкости получали очищенные фильтраты, в которых производили количественное определение указанного токсина [2]. Работу проводили в следующей последовательности: очистка фильтрата, приготовление стандартных растворов, обнаружение и количественное определение афлатоксина В1.
Для этого из культуральной среды получали фильтрат, производили его очистку и при помощи стандартных растворов афлатоксина В1 в полученном фильтрате проводили количественное определение указанного токсина. С целью проведения первичной очистки фильтрата к нему добавляли 125 мл водно-ацетоновой смеси (100 мл ацетона и 25 мл 10 %-го раствора хлорида натрия), затем вносили ацетат свинца с последующим обезжириванием гексаном и экстрагированием в хлороформе и хлороформ-ацетоне. К полученному хлороформному экстракту добавляли безводный сульфат натрия и получали фильтрат, который далее упаривали на ротационном испарителе до объема 1,0 мл. Окончательную очистку фильтрата производили при помощи жидкостной колоночной хроматографии.
Для выявления афлатоксина В1 в флуоресцентный детектор («Kratos» FS-970) устанавливали эмиссионный фильтр с полосой пропускания 418 нм при входном напряжении 10 мВ. В инжектор хроматографа вводили 20 мкл исследуемой жидкости и при наличии пика, совпадающего по времени удерживания с афлатоксином В1, определяли его высоту (h). Расчет производили по формуле:
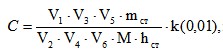 где:
где:
C - концентрация афлатоксина В1 в фильтрате в мкг/л;
V1 - объем водно-ацетоновой смеси;
V2 - объем водно-ацетонового фильтрата, взятого для анализа;
V3 - объем водно-ацетонового фильтрата и раствора ацетата свинца;
V4 - объем фильтрата после очистки ацетатом свинца;
V5 - объем очищенного раствора экстракта в хлороформе перед ВЭЖХ;
V6 - объем раствора экстракта, вводимого в инжектор хроматографа;
mст - количество афлатоксина во введенном объеме стандарта;
hст - высота пика стандарта афлатоксина;
h - высота пика афлатоксина в введенном объеме экстракта;
М - объем исследуемого фильтрата.
В качестве контроля использовали штамм A. flavus F-1118, полученный из лаборатории живых культур грибов Российского центра по глубоким микозам (г. Санкт-Петербург).
Результаты
На среде Сабуро клинические изоляты А. flavus давали рост в виде колоний зеленого цвета с воздушным субстратным мицелием, поверхность колонии пушистая, обратная ее сторона складчатая, желтовато-коричневая. При микроскопии конидиеносец бесцветный, шероховатый, шириной 8-10 мкм. Головки конидиеносцев круглые, зеленоватые, диаметром 28-36 мкм. Стеригмы однорядные, зеленоватые, радиально расположенные, размер 8х3-5 мкм. Конидии гладкие, зеленого цвета, диаметром 5-6 мкм, толстостенные.
Из культуральной жидкости готовили фильтраты, у которых определяли токсичность. Среди клинических изолятов грибов рода Aspergillus, токсичными оказались 96,9 % штаммов, Dl50 изученных микромицетов составила 2,2±0,16/lg КОЕ/мл.
Определение энтеротоксической активности A. flavus показало, что из 64 штаммов A. flavus, изолированных при заболеваниях, вызванных условно патогенными микроорганизмами, 23 (35,9 %) вызывали резко выраженную реакцию (ИД>2,0), 34 (53,2 %) - выраженную реакцию (ИД>1,0), 7 (10,9 %) - отрицательную реакцию (ИД<1,0). При положительной реакции макроскопически определялись гиперемия и дилатация зараженных сегментов. Находящийся в просвете изолированных участков кишки экссудат представлял собой желтую серозную жидкость, при сильно выраженной реакции - с примесью слизи и крови, которая равномерно окрашивала жидкость или находилась в ней в виде сгустков.
При выявления афлатоксина В1 контролем служил стандартный раствор, который готовили путем добавления к навеске 1,0 мг смеси бензол-ацето-нитрила (10 нг/мл). Затем 2,5 мл этого стандартного раствора разбавляли таким образом, чтобы в полученном рабочем растворе концентрация афлатоксина B1 составляла 0,5 нг/мкл. Для калибровки прибора флуоресцентный детектор устанавливали на длину волны возбуждающего излучения 360 нм, на линии эмиссии - эмиссионный фильтр с полосой пропускания от 418 нм. В десять стеклянных камер с притертыми крышками вращающегося барабана вводили по 1,0 мкл рабочего раствора и определяли высоту пика для раствора, находящегося в каждой из этих камер.
Средняя высота пиков рабочего раствора составила 58,3 мм. Ширину основания пика (мм) определяли временем удерживания афлатоксина В1. По высоте пика рассчитывали концентрацию афлатоксина В1 при коэффициенте концентрации 0,01. Совпадение времени удерживания на пиках, полученных в опыте и контроле, свидетельствовало о присутствии данного токсина.
Средняя высота пиков, полученных при исследовании фильтратов клинических изолятов A. flavus, составила 24,8±4,7 мм при времени удерживания 9,0±0,6 мин. Остальные показатели составили: V1 - 125 мл (объем водно-ацетоновой смеси); V2 - 50 мл (объем водно-ацетонового фильтрата, взятого для анализа); V3 - 100 мл (объем водно-ацетонового фильтрата и раствора ацетата свинца); V4 - 80 мл (объем фильтрата после очистки ацетатом свинца); V5 - 400 мкл (объем очищенного раствора экстракта в хлороформе перед ВЭЖХ); V6 - 20 мкл (объем раствора экстракта, вводимого в инжектор хроматографа); mст - 0,5 нг (количество афлатоксина во введенном объеме стандарта); hст - 58,3 мм (высота пика стандарта афлатоксина); h - 24,8 (высота пика афлатоксина в введенном объеме экстракта); М - 25 мл (объем исследуемого фильтрата).
Расчет концентрации афлатоксина В1 при коэффициенте концентрации 0,01 показал, что клинические изоляты микромицетов A. flavus содержали 0,0053±0,0009 мкг/л афлатоксина В1 (ПДК=0,005 мкг/л).
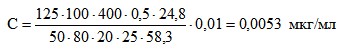
Таким образом, установлено, что из всех изученных клинических изолятов грибов рода Aspergillus, выделенных у пациентов с заболеваниями, вызванными условно патогенными микроорганизмами, 97 % обладали токсичностью, Dl50 изученных штаммов составила 2,2±0,16/lg КОЕ/мл. В группе сравнения данные показатели были значительно ниже: 38,5 % и 0,9±0,17/lg КОЕ/мл соответственно.
Кроме того, у изученных штаммов A. flavus выявлено наличие афлатоксина В1 в количестве, превышающем значения ПДК. Проведенные исследования показали, что клинические изоляты грибов рода Aspergillus обладают значительным спектром токсического воздействия на макроорганизм и, следовательно, могут являться кофактором развития заболеваний, вызванных условно патогенными микроорганизмами.
Выводы
- Установлено, что все штаммы A. flavus, выделенные у пациентов с заболеваниями, вызванными условно патогенными микроорганизмами, являлись продуцентами афлатоксина В1 (0,0053±0,0009 мкг/л).
- Клинические изоляты A. flavus в 96,9 % случаев обладали токсичностью, Dl50 изученных микромицетов составила 2,2±0,16/lg КОЕ/мл. Из 64 изученных штаммов A. flavus 89,1 % продуцировали энтеротоксин.
- Микромицеты A. flavus, обладая токсическим воздействием на макроорганизм, могут являться кофактором развития заболеваний, вызванных условно-патогенными микроорганизмами.
Работа выполнена при поддержке Минобрнауки РФ в рамках ГК 16.512.11.2226 от 12.07.2011 г.
Рецензенты:
Кан Нина Ивановна, доктор медицинских наук, профессор, заведующая кафедрой последипломного образования и семейной медицины, факультета последипломного медицинского и фармацевтического образования ГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.
Слесарев Сергей Михайлович, доктор биологических наук, профессор кафедры общей биологии и биоэкологии ГБОУ ВПО «Ульяновский государственный университет», г. Ульяновск.



