В ряду гидролитических ферментов, используемых как катализаторы органо-химических превращений, β-фруктофуранозидаза (2,1-β-D-фруктофуранозид-фруктогидролаза, К.Ф. 3.2.1.26) занимает особое место ввиду возможности ее использования в реакциях гидролиза сахарозы с целью получения инвертного сиропа, широко используемого в пищевой промышленности [3]. Инвертный сироп по своему составу и биологической ценности превосходит сахарозу, обладает хорошим влагоудерживанием, а также антикристаллизационными свойствами [4; 6]. Однако ферментативный процесс получения инвертных сиропов сопровождается рядом недостатков: нестабильность фермента, высокая стоимость, а также однократность использования. Эти недостатки можно устранить с помощью иммобилизации β-фруктофуранозидазы.
На сегодняшний день интенсивно изучаются различные методы иммобилизации β-фруктофуранозидазы, такие как физическая сорбция на гидрофобных адсорбентах, включение в гидрофобные гели и др., но свойства иммобилизованного препарата и поведение его в реакции гидролиза сахарозы не достаточно изучены.
Поэтому целью работы является проведение сравнительного анализа некоторых физико-химических свойств (термостабильности, рН-зависимости, субстратной специфичности) свободной и иммобилизованной на волокнистом ионообменнике марки ФИБАН А-6 β-фруктофуранозидазы Kluyveromyces marxianus Y-303 в реакции гидролиза сахарозы.
Материалы и методы исследований
В работе использовали ферментный прерпарат β-фруктофуранозидазы (2,1-β-D-фруктофуранозид-фруктогидролаза, К.Ф. 3.2.1.26), выделенный из культуры дрожжей Kluyveromyces marxianus Y-303, полученной из Всероссийской коллекции промышленных микроорганизмов (ВКПМ, Москва). Оживление культуры проводили по методу Коха [7] на сусло-агаре при температуре 28-30 °С в течение 5-6 дней. Культивирование дрожжей Kl. marxianus осуществляли глубинным способом в колбах емкостью 500 см3 в термостате, содержащих по 50 см3 питательной среды, в течение 48 часов при температуре 30 °С. В качестве питательной среды использовали дрожжевую питательную среду следующего состава, %: пептон - 1,0; дрожжевой экстракт - 0,5; глюкоза - 2; рН среды от 5,5 до 8,0.
Извлечение фермента из дрожжевой клетки осуществляли при помощи автолиза. Для выделения ферментного препарата использовали осаждение этанолом, фракционирование сульфатом аммония, ионообменную хроматографию на DEAE-целлюлозе, гель-хроматографию на сефадексе G-25 и G-150. Гомогенность полученных фракций определяли модифицированным методом электрофореза в полиакриламидном геле [9].
Определение активности свободной β-фруктофуранозидазы осуществляли методом Бертрана [5] и методом Сомоджи-Нельсона [10], иммобилизованной β-фруктофуранозидазы - спектрофотометрически резорциновым методом. За единицу активности принимали такое количество фермента, которое катализирует 1 мМ редуцирующих веществ за 1 мин в стандартных условиях.
Для иммобилизации фермента β-фруктофуранозидазы Kluyveromyces marxianus Y-303 использовали волокнистый ионообменник ФИБАН А-6. Подготовку ионита к иммобилизации осуществляли путем кондиционирования ионообменника и перевода его в нужную ионообменную форму. Для этого сорбент подвергали набуханию в пятикратном количестве 20%-ного раствора NaCl. Затем волокна промывали дистиллированной водой и обрабатывали 1,0%-ным раствором НCl для удаления ионов железа. Затем снова промывали дистиллированной водой и осуществляли попеременную четырехкратную обработку 0,5%-ными растворами NaOH и HCl [1]. Термоинактивацию растворимой β-фруктофуранозидазы изучали в диапазоне температур 30-80 °С. Влияние рН на активность β-фруктофуранозидазы изучали в интервале 3,0-7,0. Аналогичные исследования проводили с иммобилизованным ферментом.
Для проведения сорбционной иммобилизации β-фруктофуранозидазы 1 г носителя оставляли на ночь при комнатной температуре в 50 мл ацетатного буфера (рН 4,0), затем сливали избыточную жидкость и добавляли растворы ферментов различных концентраций (от 0,1 до 1,0 мг/см3, рН 4,0) и перемешивали в колбе с помощью электрической мешалки в течение 1,5 часов при температуре 25 °С. Количество несвязавшегося с носителем фермента определяли спектрофотометрически на СФ-46 через разные промежутки времени.
Результаты и их обсуждение
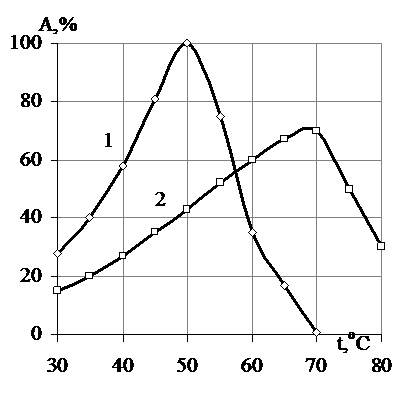
В ходе работы была проведена серия экспериментов по определению влияния температуры на активность свободной и иммобилизованной β-фруктофуранозидазы. Было установлено, что активность свободного фермента равномерно возрастает в диапазоне температур 30-50 °С, достигая максимума, равного 2700 ед/мг белка, при 50 °С (рис. 1), тогда как максимальная активность иммобилизованной β-фруктофуранозидазы, равная 1890 ед/мг белка, наблюдается при 70 °С. Резкое снижение каталитической активности свободного препарата, которое достигает нулевого значения при 80 °С, в связи с термической инактивацией фермента, наблюдается при дальнейшем повышении температуры.
|
Рис. 1. Влияние температуры на каталитическую активность 1 - свободной и 2 - иммобилизованной β-фруктофуранозидазы (% от максимальной) при рН 4,0; А - активность иммобилизованной β-фруктофуранозидазы, %. |
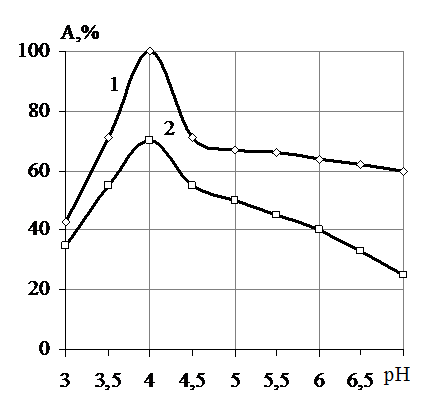
Рис. 2. Зависимость активности 1 - свободной и 2 - иммобилизованной β-фруктофу-ранозидазы (% от максимальной) от величины рН при температуре 50 °С; А - активность иммобилизованной β-фруктофуранозидазы, %. |
Сравнительный анализ зависимости активности свободной и иммобилизованной β-фруктофуранозидазы от температуры выявил сдвиг максимума активности иммобилизованного фермента (на 20 °С) в более высокотемпературную область в сравнении со свободным ферментом. Кроме того, активность иммобилизованного фермента при удалении от температурного оптимума уменьшается медленнее, чем активность свободного, что говорит об уменьшении чувствительности адсорбированной β-фруктофуранозидазы к температурным воздействиям.
Для определения рН-оптимума действия свободного и иммобилизованного фермента гидролиз сахарозы осуществляли в интервале рН 3,0-7,0. Заданное значение рН субстрата поддерживали с помощью 0,1 М ацетатного буфера. Максимальные активности свободный и иммобилизованный ферменты проявляли при рН 4,0 (рис. 2). В интервале рН 3,0-4,0 наблюдается устойчивый рост каталитических способностей свободного и иммобилизованного ферментов с максимальными значением активности при рН 4,0. В интервале рН 4,0-4,5 каталитические активности препаратов резко снижаются. Далее наблюдается постепенное снижение активности. Таким образом, оптимум рН иммобилизованной на волокнистом ионообменнике β-фруктофуранозидазы не отличается от рН-оптимума свободного фермента и также составляет 4,0.
Исследована зависимость скоростей ферментативной реакции гидролиза сахарозы от концентрации субстрата β-фруктофуранозидазой Kl. marxianus, иммобилизованной адсорбционно на носителе ФИБАН А-6 и свободного фермента (рис. 3).
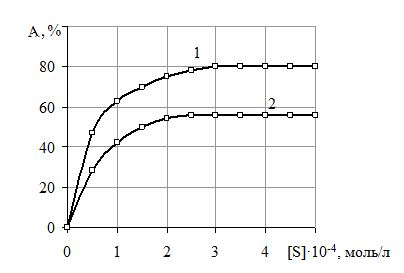
Рис. 3. Зависимость каталитической активности 1 - свободной и 2 - иммобилизованной β-фруктофуранозидазы от концентрации субстрата.
Анализируя рис. 3, можно предположить, что при адсорбции белка на носителе происходит увеличение жесткости третичной структуры, ответственной за превращение молекул субстрата, а также имеются затруднения, связанные с переходом иммобилизованного фермента из неравновесного состояния в равновесное по сравнению со свободной β-фруктофуранозидазой и удлинение лимитирующей стадии ферментативного катализа. С помощью преобразования кривых зависимости V от S в координатах Лайнуивера-Берка были определены Km и Vmax реакции гидролиза сахарозы β-фруктофуранозидазой, иммобилизованной на ФИБАН А-6 (табл. 1).
Таблица 1
|
β-фруктофуранозидаза |
Km, моль/л |
Vmax, мкмоль·мг/мин |
|
Свободная |
2,24·10-4 |
102±0,9 |
|
Иммобилизованная |
3,3·10-4 |
35±0,9 |
Сравнительный анализ кривых А(S) и значений основных кинетических параметров реакций гидролиза сахарозы позволяют сделать вывод, что иммобилизованная β-фруктофуранозидаза проявляет сродство к субстрату, и происходит увеличение значений Km и Vmax. Очевидно ионообменное волокно ФИБАН А-6 достаточно прочно связывается с β-фруктофуранозидазой, обеспечивая более высокую термо- и рН-стабильность белка, при этом незначительно меняется конформация субъединиц белка, т. к. иммобилизованный фермент проявляет достаточно высокую каталитическую способность после взаимодействия с матрицей волокна.
Кроме того, изучали совместное действие рН и температуры на активность свободной β-фруктофуранозидазы. Было установлено, что при температуре 40 °С и рН 4,0 в течение 72 мин. сохранялось 100% активности фермента, тогда как при величине рН 3,0; 5,0 и 6,0 к этому времени активность свободного фермента составила 50, 34 и 15% соответственно. При температуре 50 °С и рН 3,0; 4,0; 5,0 и 6,0 после 2 ч инкубации остаточная активность составила 73, 87, 63 и 37% соответственно. Повышение температуры до 60 °С приводило к более резкой инактивации фермента. Данные по влиянию температуры и рН на константу скорости инактивации свободного фермента представлены в таблице 2.
Таблица 2
|
Температура, °С |
К (ч-1) при рН |
|||
|
3,0 |
4,0 |
5,0 |
6,0 |
|
|
30 |
0,006 |
0,002 |
0,007 |
0,009 |
|
40 |
0,013 |
0,004 |
0,017 |
0,026 |
|
50 |
0,100 |
0,068 |
0,160 |
0,240 |
|
60 |
1,100 |
0,875 |
1,800 |
2,310 |
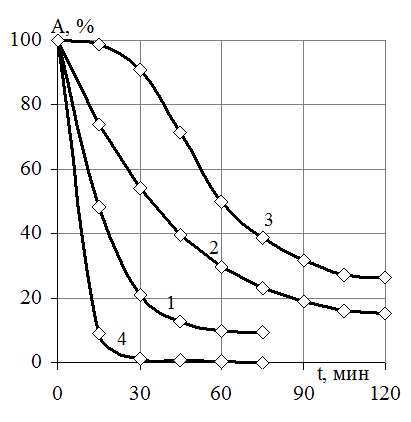
Для исследования термической инактивации иммобилизованной β-фруктофуранозидазы проводили определение остаточной активности фермента при температурах 50-80 °С (рис. 4). Обнаружено, что остаточная активность иммобилизованного фермента при 70 °С после 60 мин. инкубации составила 53% от начальной. Нагревание фермента при 80 °С в течение 60 мин. приводит к неполной инактивации иммобилизованного фермента: он сохраняет 2% каталитической активности. Наблюдаемое увеличение термостабильности объясняется тем, что при взаимодействии тепловой энергии на иммобилизованную β-фруктофуранозидазу при температурах от 60 до 70 °С разрушение гидрофобных взаимодействий и других слабых связей не имеет места, что свидетельствует о более высокой термоустойчивости иммобилизованного фермента по сравнению со свободным: константы скорости инактивации для иммобилизованного препарата β-фруктофуранозидазы при любой температуре будут ниже, чем для свободного фермента. Значения констант скорости термической инактивации иммобилизованной на ФИБАН А-6 β-фруктофуранозидазы представлены в таблице 3.
Таблица 3
|
Температура, °С |
Константа скорости инактивации, ч-1 |
|
50 |
1,01 |
|
60 |
1,06 |
|
70 |
0,45 |
|
80 |
2,51 |
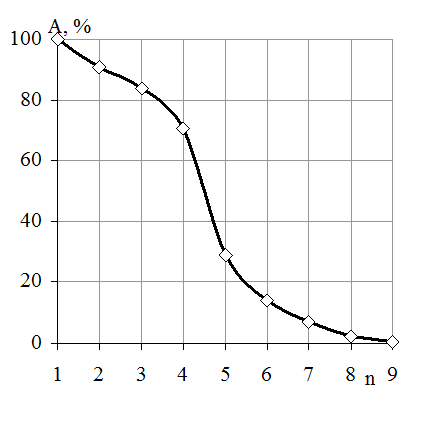
Также была исследована кратность использования фермента, иммобилизованного на ФИБАН А-6. Установили, что иммобилизованная β-фруктофуранозидаза сохраняет высокую активность при многократном использовании (4-5 раз) (рис. 5).
|
Рис. 4. Зависимость каталитической активности иммобилизованной β-фруктофуранозидазы от времени термической инактивации: А - активность (% от максимальной); t - время инкубирования, мин.; 1 - при 50 °С; 2 - при 60 °С; 3 - при 70 °С; 4 - при 80 °С. |
Рис. 5. Кратность использования иммо-билизованной β-фруктофуранозидазы: А - активность, ед/мг белка (% от максимальной); n - число реакций гидролиза сахарозы.
|
Выводы
Сравнительный анализ свойств свободной и иммобилизованной на волокнистом ионообменнике марки ФИБАН А-6 β-фруктофуранозидазы показал, что в результате иммобилизации температурный оптимум сдвигается в сторону увеличения температур, что обусловлено конформационными изменениями молекулы фермента, рН-оптимум для свободной и иммобилизованной β-фруктофуранозидазы составляет 4,0. Результаты исследования термоинактивации β-фруктофуранозидазы свидетельствуют о более высокой термоустойчивости иммобилизованного фермента по сравнению со свободным. Исследована кинетика действия и субстратная специфичность иммобилизованной β-фруктофуранозидазы Kluyveromyces marxianus Y-303: наблюдается увеличение значений Кm и уменьшение Vmax по сравнению со свободным ферментом. Кроме того, увеличивается стабильность фермента во времени и кратность его использования в процессе проведения гидролиза сахарозы с целью получения инвертных сиропов.
Рецензенты
- Грабович М.Ю., д.б.н., доцент, профессор кафедры биохимии и физиологии клетки. ФГБОУ ВПО «Воронежский государственный университет» Министерства образования и науки РФ, г. Воронеж.
- Глотова И.А., д.т.н., профессор, зав. кафедрой технологии переработки животноводческой продукции ФГОУ ВПО «Воронежский государственный аграрный университет имени императора Петра I» Министерства образования и науки РФ, г. Воронеж.