В основе патогенеза перинатальной гипоксии лежат нарушения в цикле аэробно-окислительного фосфориллирования с развитием оксидантного стресса, которому наиболее подвержены клетки миокарда и головного мозга (вследствие высокой интенсивности окислительного метаболизма и незначительного содержания естественных антиоксидантов). Гипоксия нарушает процессы энергообеспечения, синтеза медиаторов и нейротрансмиттеров, целостность клеточных мембран, приводя к развитию функциональных расстройств центральной нервной (ЦНС) и сердечно-сосудистой систем (ССС) [2].
Целью работы было изучение эффективности препаратов антигипоксантного и антиоксидантного типа действия Мексидола (Фармасофт, Россия) и Актовегина (Nycomed, Австрия) в коррекции ишемически-опосредованных дизадаптационных расстройств ЦНС и ССС. Выбор мексидола обусловлен хорошо известными церебропротекторными и вазоактивными свойствами препарата, неоднократно доказанными у пациентов с ишемическим инсультом, вегето-сосудистой дистонией, черепно-мозговыми травмами, а также кардиоцитопротекторной активностью [1,8]. Актовегин выбран с учетом его известных антигипоксических свойств и положительного опыта использования в акушерстве и неонатологии [4,6].
Материал и методы. Исследование проведено на базе отделения функциональной и ультразвуковой диагностики ГУЗ ДРКБ № 1 (г. Саранск). В исследование включены 100 новорожденных (52 мальчика и 48 девочек), рожденных путем операции КС и имевших в анамнезе указания на перенесенную перинатальную гипоксию. Дети были разделены на 3 группы, сопоставимые по степени недоношенности, половому составу, среднему весу при рождении и возрасту при поступлении в стационар. Различия касались степени перенесенной церебральной ишемии (ЦИ): в первой группе преобладали дети с легкой степенью ЦИ (количество детей с ЦИ I, II, и III степени составило 50 %, 34,4 % и 15,6 % соответственно); во второй - преобладали пациенты со среднетяжелой ЦИ (28 %, 53,5 % и 18,5 % детей соответственно), а в третьей группе большинство составляли дети в тяжелом состоянии (24 %, 36 % и 40 % соответственно). Пациенты 1 группы получали общепринятую медикаментозную и немедикаментозную терапию, дифференцированную с учетом степени тяжести ЦИ (охранительный режим, массаж, ноотропы, сосудистые по показаниям). Тяжесть состояния пациентов 2 и 3 групп послужила основанием для дополнения стандартной схемы лечения препаратами: актовегин (0,2 мл-кг-сут. в/в капельно в течение 10 дней с переходом на прием внутрь до месяца) и мексидол (7,5 мг-кг-сут. по аналогичной схеме). Из исследования исключались дети с органическими заболеваниями ЦНС и ССС, а также с клинически значимой сопутствующей патологией.
Эффективность лечения оценивали методами электрокардиографии в 12 стандартных отведениях и холтеровского мониторирования ЭКГ с использованием алгоритмов анализа, предложенных Л.М. Макаровым (2008 г.). Эхокардиографию проводили методом спектральной допплерографии и цветового картирования, оценивая размеры полостей сердца по весо-ростовым показателям. Инструментальное обследование ЦНС включало нейросонографию (НСГ), допплерографию церебральных сосудов по общепринятым методикам. Для оценки функционального состояния ЦНС проводилась электроэнцефалография (ЭЭГ) в состоянии естественного безмедикаментозного сна с модифицированной международной схемой с уменьшенным количеством электродов. Для визуальной оценки ЭЭГ-паттерна недоношенных детей в возрасте 24-40 недель от зачатия применялся алгоритм Эллингсона; для доношенных - использовался алгоритм анализа Строгановой Т.А. и соавторов (2005 г.).
Статистическую обработку полученных результатов проводили методами «χ-квадрат», t-критерия и парного t-критерия Стьюдента при 5 % уровне значимости с помощью пакета прикладных программ «Statistica». Корреляционный анализ проводился с использованием критерия линейной корреляции Пирсона в случае, если обе выборки имели нормальное распределение и линейную зависимость. В противном случае использовался коэффициент ранговой корреляции Спирмена.
Результаты исследования и их обсуждение. У 69 % детей, рожденных оперативным путем, констатировано наличие в перинатальном анамнезе указаний на перенесенную хроническую внутриутробную гипоксию и / или острую асфиксию в родах, что позволило рассматривать этих новорожденных как угрожаемых по формированию перинатальной патологии. Комплексное обследование позволило диагностировать у них ЦИ I, II, III степени в 31 %, 44 % и 25 % соответственно, а также постгипоксические изменения ССС различной выраженности. Ранний неонатальный период у детей, рожденных путем КС, по сравнению с перенесшими перинатальную гипоксию, но рожденными естественным путем, характеризовался большей выраженностью дизадаптационных постгипоксических расстройств: более частым выявлением признаков электрической нестабильности миокарда, нарушения циркадной организации ритма и дисфункции синусового узла, систолической и диастолической функций сердца, персистирования фетальных коммуникаций и транзиторной легочной гипертензии, а также структурных и функциональных изменений головного мозга (сочетательных ишемически-геморрагических нарушений и их последствий, признаков незрелости и церебральной дисциркуляции). Эти нарушения имели сильную положительную связь со степенью тяжести ЦИ.
Таким образом, на предварительном этапе нами было установлено, что оперативное родоразрешение не предупреждает негативных последствий перинатальной гипоксии и не защищает от формирования структурно-функциональных нарушений постнатальной адаптации [3,5,10]. Поскольку каскад ишемически-опосредованных патологических процессов происходит в органах и тканях не только в момент гипоксии, но и в период восстановления оксигенации [7,9], несомненна теоретическая обоснованность использования антигипоксантов и антиоксидантов в коррекции дизадаптационных расстройств ЦНС и ССС у детей, рожденных оперативным путем.
На фоне естественных процессов созревания ЦНС регресс неврологической симптоматики более эффективно происходил при дополнительном использовании мексидола. Полная редукция синдрома угнетения и восстановление двигательной активности во всех трех группах были достигнуты к 3 месяцам, но наиболее динамично (с 80 % до 0 %, р=0,05) этот процесс происходил у детей 3 группы. Купирование судорожного синдрома и вегетативно-висцеральных дисфункций также быстрее (к 3 месяцам против 6 в контрольной группе) происходила у детей, получавших мексидол.
Параллельно улучшению неврологического статуса происходила нормализация функции ССС. При исходно более тяжелом состоянии частота регистрации приглушенности сердечных тонов и тахипноэ уменьшилась у детей 2 и 3 групп на 45,5-60,5 % (р=0,023 и 0,041) уже к концу периода новорожденности. Выявляемость цианоза носогубного треугольника / акроцианоза статистически значимо уменьшилась с 76-80 % до 18,5-20 % к 1 месяцу при дополнительном лечении актовегином и к 3 месяцам - при лечении мексидолом. В тоже время у детей, получавших стандартную терапию, динамика этого признака к месяцу была менее значима и составила 12,4 % против 37,5 % исходно (р=0,059). К 6 месяцам полный регресс всех симптомов (за исключением систолического шума, обусловленного персистированием фетальных коммуникаций) был достигнут только у пациентов, получавших дополнительно актовегин и мексидол.
Восстановление электрофизиологических параметров миокарда также более динамично происходило у детей 3 группы. В первую очередь это касалось регресса ST-T нарушений, которые при максимально высокой исходной выявляемости в 3 группе полностью нивелировались к полугоду (с 84 % до 0 %, p=0,0001), в то время, как в отсутствие медикаментозной терапии и при дополнительном лечении актовегином, эти ЭКГ-нарушения сохранялась и в 6 месяцев (р=0,005 и р=0,001). Амплитуда суммарного отклонения зубца Т (ПСО-Т) и сегмента ST (ПСО-SТ) от изолинии в грудных отведениях также более эффективно уменьшалась на фоне дополнительного лечения мексидолом (таблица 1). В этой группе существенные отличия ПСО-Т от исходного уровня были достигнуты уже к 1 месяцу и значительно отличались от двух других групп. Выраженная динамика ПСО-ST отмечена к 3 месяцам у детей, получавших дополнительно актовегин и мексидол, в то время, как на фоне стандартной терапии и естественного течения процессов адаптации, даже к полугоду значимых отличий от исходного уровня не получено.
Таблица 1. Динамика амплитуды суммарного отклонения зубца Т (ПСО-Т) и сегмента ST (ПСО-ST) у детей, рожденных оперативным путем, при различных вариантах фармакотерапии
|
Показатель |
до лечения |
1 мес. |
3 мес. |
6 мес. |
|
ПСО-Т, мм: стандартная схема +актовегин +мексидол ПСО-ST, мм: стандартная схема +актовегин +мексидол |
2,64±0,25 2,82±0,43 3,7±0,69#
0,09±0,02 0,11±0,13 0,4±0,13 |
2,34±0,17 2,3±0,06 2,38±0,07*
0,06±0,03 0,08±0,4 0,2±0,3 |
2,09±0,3* 1,8±0,03* 1,76±0,08*#
0,04±0,01 0,05±0,07* 0,06±0,07* |
1,48±0,25* 1,1±0,17* 0,88±0,28*#
0,04±0,01 0,05±0,07* 0,06±0,07* |
Примечание: *- отличия от исходного уровня достоверны при р≤0,05; # - отличия от стандартной схемы достоверны при р≤0,05.
Положительный эффект мексидола проявлялся также более быстрым восстановлением функции синусового узла с редукцией брадикардии (р=0,008) и исчезновением экстрасистолии (р=0,0093). В тоже время, в двух других группах динамика аритмий была замедлена и даже к полугоду существенных различий с исходом не имела (рисунок 1). Восстановление средней продолжительности интервала QTc к 1 месяцу произошло у всех детей, но наибольший эффект отмечен в 3 группе, где исходный уровень выявляемости замедления интервала QTc составил 36 %, тогда как в других группах таких пациентов было лишь 9,4-21 %. Данный эффект может быть обусловлен прямым вегетотропным действием мексидола и его антигипоксантными свойствами [8].
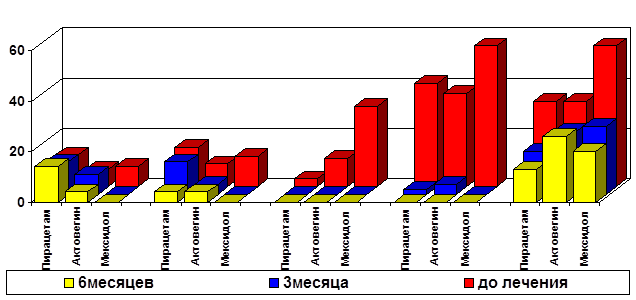
* * * *** *
1 2 3 4 5
Примечания: *- достоверность отличий от исходного уровня при р≤0,05; 1 - брадикардия; 2 - экстрасистолия; 3 - QTc > 440 мс; 4 - отклонение ЭОС >120°; 5 - нарушение внутри-желудочкового проведения.
Рис. 1. Динамика электрокардиографических показателей у детей, рожденных оперативным путем, при различных вариантах фармакотерапии
К полугоду во всех группах происходило восстановление положения электрической оси сердца, но у детей, получавших дополнительно мексидол, этот процесс происходил быстрее, и выраженное отклонение электрической оси вправо не регистрировалось уже к 3 месяцам. Улучшения внутрижелудочкового проведения имело более медленную динамику, и достоверные различия с исходным уровнем были достигнуты к 6 месяцам только у пациентов, получавших мексидол.
Динамика показателей суточного мониторирования ЭКГ позволила выявить нормализацию базового уровня функционирования синусового узла (восстановление уровня ЧСС во время сна, сокращение пауз ритма и эпизодов СА-блокады) и реактивности ритма (восстановление ЧСС в периоде бодрствования) у детей 3 группы, что указывает на более быстрые темпы восстановления вегетативной регуляции ритма и цереброкардиальных взаимодействий при использовании мексидола (таблица 2).
Таблица 2. Сравнительная динамика пауз ритма по данным ХМ у детей, рожденных путем кесарева сечения, при разных вариантах фармакотерапии
|
Показатель |
до лечения |
1 мес. |
3 мес. |
6 мес. |
|
Паузы ритма, мс стандартная терапия + актовегин + мексидол |
863,9±43,1 836,1±85,9 916,4±63,7 |
848,1±46,2 817,5±33,4 798,1±51,1* |
1001,6±51,9* 975,4±48,2* 841,3±42,6# |
898,2±40,1 788,8±27,9* 779,1±62,9*# |
Примечание: *- достоверность отличий от исходного уровня при р≤0,05; # - достоверность отличий от стандартной схемы при дополнительном лечении мексидолом при р≤0,05.
Важно отметить, что у детей, получавших дополнительное лечение мексидолом, в отличие от пациентов двух других групп, к 3 месяцам (в период активного включения парасимпатического отдела) не происходило увеличения продолжительности пауз ритма и представленности СА блокады, а к 6 месяцам эпизоды СА блокады не регистрировались совсем и средняя продолжительность пауз ритма была минимальной. Лишь при использовании антигипоксантов к 3 месяцам происходила некоторая стабилизация циркадной организации ритма сердца (ЦИ составил 1,16±0,01 и 1,17±0,01 против 1,13±0,02 и 1,11±0,02 соответственно, р=0,046 и 0,032), однако полная нормализация этого показателя была достигнута к полугоду только у детей, получавших мексидол.
Восстановление эхокардиографических показателей также происходило быстрее у детей, получавших дополнительную терапию актовегином и мексидолом (рисунок 2). Это касалось, прежде всего, регресса транзиторной легочной гипертензии. Средний градиент давления в легочной артерии у детей, получавших дополнительно актовегин, снизился за 6 месяцев на 2,9±0,43мм рт. ст., а у пациентов, лечившихся дополнительно мексидолом - на 6,0±0,25ммртст. В тоже время у детей, получавших стандартную терапию, при исходном градиенте давления 9,9±1,11мм рт. ст. его снижение до уровня аналогичного 2-3 группам (8,1-8,4 мм рт. ст.) было отмечено лишь к 6 месяцам. Качественно подобное происходило и c явлениями систолической дисфункции ЛЖ: к полугоду ее выявляемость во 2 и 3 группах редуцировалась на 75 % и 60 % соответственно (р=0,045, р=0,05), в то время как у детей, получавших стандартную терапию, к 6 месяцам достоверной разницы с исходным уровнем получено не было.
Стабилизация размеров полостей сердца более динамично происходила при дополнительном использовании мексидола. Выявляемость данного признака уменьшилась с 68 % исходно до 20 % к 3 месяцам (р=0,035), а в двух других группах статистически значимые различия с исходом получены только к 6 месяцам. Интересно, что восстановление диастолической функции желудочков и закрытие фетальных коммуникаций у всех детей происходило без существенных различий.
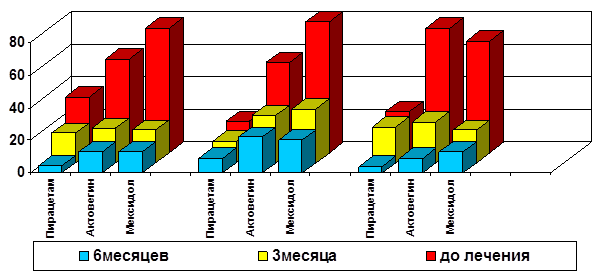
* * * * *
* * * * * * * *
Примечание: * - достоверность отличий от исходного уровня при р≤0,05; 1 - транзиторная легочная гипертензия; 2 - систолическая дисфункция; 3 - дилатация полостей сердца.
Рис. 2. Динамика эхокардиографических показателей у детей, рожденных путем кесарева сечения, при различных вариантах фармакологической коррекции
Проводимая терапия способствовала стабилизации состояния ЦНС. По данным НСГ, наиболее динамично происходило созревание структур головного мозга, и к 3 месяцам признаки незрелости не регистрировалась ни в одной группе. На фоне использования мексидола выявляемость ишемических нарушений достоверно уменьшилась уже к 3 месяцам, а резидуальные проявления (в виде единичных или множественных кист, расширения межполушарной щели) к 6 месяцам редуцировались наполовину, сохраняясь у 1/3 детей. В тоже время в двух других группах к полугоду наметилась только тенденция к регрессу резидуальных ишемических нарушений (которые сохранялись в 43 % и 52 %). Ни одна из предложенных схем лечения не оказала значимого эффекта на формирование осложнений сочетанных ишемически-геморрагических поражений головного мозга (вентрикуломегалии), хотя их исходная представленность была выше в 3 группе (28 % против 13 % во 2-ой группе и 3 % - в 1-ой группе, р=0,05).
У детей, рожденных оперативным путем, в восстановительном периоде перенесенной перинатальной гипоксии происходили закономерные фазовые изменения мозгового кровотока. Основные гемодинамические эффекты антигипоксантов достигнуты в «фазе восстановительных явлений» к полугоду. На фоне дополнительного лечения актовегином и, особенно, мексидолом происходило приближение основного показателя эффективности мозгового кровотока - индекса резистентности артериальных сосудов - RI (составившего 0,65±0,01 и 0,67±0,02 соответственно) к показателям здоровых детей (0,66±0,02), тогда как у детей контрольной группы RI был значимо ниже (0,63±0,01). Это позволяет констатировать стойкое резидуальное изменение церебрального кровотока у пациентов, не получавших дополнительно антигипоксантной и антиоксидантной терапии.
Напротив, скорость оттока по вене Галена с возрастом во всех исследуемых группах прогрессивно нарастала, что свидетельствовало о формировании венозной дисциркуляции, обусловленной выраженными структурными нарушениями головного мозга в виде прогрессирования вентрикуломегалии, вследствие перенесенных в перинатальном периоде ишемически-геморрагических нарушений. Данный факт диктует необходимость продолжения исследований в этом направлении и делает актуальным изучение возможности более раннего назначения антиоксидантов (в том числе в период внутриутробного развития) для предупреждения формирования серьезных осложнений.
По данным ЭЭГ в восстановительном периоде после перенесенной перинатальной гипоксии у детей, рожденных путем КС, выявлялось нарушение реализации онтогенетической программы формирования биоэлектрической активности головного мозга в цикле сна, вероятно, вследствие пролонгированного влияния гипоксии на функциональное состояние головного мозга. В отличие от других вариантов фармакотерапии, дополнительное использование мексидола способствовало более эффективному созреванию биоэлектрической активности мозга, и признаки задержки последней к 6 месяцам сохранялись лишь у 13 % детей (против 40 % исходно, р=0,044). Проводимая терапия способствовала купированию судорожного синдрома к 3 месяцам во всех исследуемых группах, но только у детей, получавших дополнительно мексидол, эта динамика была статистически значима по сравнению с исходными данными (28 % р=0,04).
Таким образом, дополнительное использование у пациентов с ЦИ II-III ст., рожденных путем кесарева сечения, антиоксидантов актовегина и мексидола способствовало более быстрой и полной коррекции клинико-инструментальных проявле-ний ишемически-опосредованных дисфункций организма. Применение антиоксидантов, особенно мексидола, оптимизировало функционирование ССС и ЦНС у детей, рожденных оперативным путем, в более ранние сроки по сравнению со стандартной терапией.
Выводы.
1. В раннем неонатальном периоде у детей, рожденных путем КС, выявляются гипоксически-опосредованные дизадаптационные нарушения в виде: аритмий, признаков электрической нестабильности миокарда, нарушения циркадной организации ритма, систолической и диастолической функций сердца, персистирования фетальных коммуникаций и транзиторной легочной гипертензии, структурных и функциональных изменений головного мозга (признаков незрелости, нарушения биоэлектрической активности мозга в цикле сна, срыва ауторегуляции церебральной гемодинамики).2. Антигипоксанты, мексидол и актовегин, в дополнение к стандартной схеме лечения способствуют более значимому улучшению клинического состояния детей, рожденных КС, быстрому и эффективному регрессу постгипоксических кардиальных нарушений в виде восстановления вегетативной регуляции сердечного ритма и его циркадной организации, регресса признаков электрической нестабильности миокарда, стабилизации размеров полостей сердца, оптимизации его систолической и диастолической функций.
3. Мексидол и актовегин улучшали морфо-функциональное состояние ЦНС у детей, рожденных КС, снижая выявляемость последствий гипоксически-ишемических поражений головного мозга, признаков задержки созревания его функциональной активности, стабилизируя уровень церебрального кровотока по сосудам артериального русла и способствуя полному купированию судорожного синдрома.
4. Мексидол более эффективно, по сравнению с актовегином, нивелировал транзиторную легочную гипертензию и нарушение систолической и диастолической функции миокарда, уменьшал выраженность дисфункции синусового узла и ишемических расстройств, нормализовал биоэлектрическую активность мозга и показатели церебрального кровотока и улучшал клиническое состояние детей, рожденных путем кесарева сечения.
Рецензенты:
- Пешев Л.П., д.м.н., профессор, зав. кафедрой акушерства и гинекологии Медицинского института ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск.
- Инчина В.И., д.м.н., профессор, зав. кафедрой фармакологии с курсом клинической фармакологии Медицинского института ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск.
Работа получена 21.11.2011.



