Нарушение функциональной активности Т- и В-лимфоцитов отражается в развитии разнообразных форм иммунонедостаточности.
Системная красная волчанка (СКВ) и ревматоидный артрит (РА) - это хронические аутоиммунные заболевания (АИЗ) с неясной этиологией и обширной картиной иммунопатогенеза, снижают качество и продолжительность жизни населения, поэтому входят в число важных биомедицинских и социальных проблем современности [4; 3].
Для больных СКВ характерно повышение уровня IgG-АТ к нДНК, которые обладают ДНК-гидролизующей активностью [4; 5] и, вероятно, являются участниками патологического процесса. Но на сегодняшний день среди исследователей нет единого мнения о вкладе АТ к нДНК в развитие и течение АИЗ.
При РА также наблюдается повышение уровня ДНК-гидролизующих АТ, но клинические признаки отличаются от СКВ [3; 7]. Следовательно, течение патологического процесса может определяться не только уровнем АТ к ДНК, но и их свойствами, различающимися при разнообразных АИЗ.
Исследования последних лет показали, что некоторые АТ к ДНК проникают внутрь клеток и влияют на внутриклеточные процессы [9].
Можно высказать предположение, что IgG-АТ к нДНК, взаимодействуя с ДНК клеток и изменяя структуру хроматина, приводят к нарушению апоптоза иммунокомпетентных клеток, следствием чего является увеличение апоптотического материала и времени его циркуляции в кровотоке, что наблюдается при СКВ и усугубляет течение аутоиммунного процесса.
Целью работы явилось исследование генотоксичности антител класса IgG к нативной ДНК в первичной культуре лимфоцитов здоровых лиц.
Материалы и методы исследования
Выделение IgG-АТ к нДНК из сыворотки крови человека
Все этапы очистки выделения и очистки IgG-АТ к нДНК из сывороток доноров и больных СКВ и РА проводили по ранее разработанной методике [4]. В работе использовали АТ к ДНК сывороток крови лиц женского пола - 20 сывороток здоровых доноров, 7 сывороток больных СКВ и 20 сывороток больных РА в период обострения заболевания, полученные в медицинских учреждениях г. Казани. Диагноз СКВ и РА был поставлен квалифицированными ревматологами ГОУ ДПО «Казанская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию».
Выделение лимфоцитов из цельной крови здоровых лиц проводили по стандартной методике на фиколл-верографине - плотность 1.077 мг/мл [10].
Культивирование лимфоцитов в присутствии IgG-АТ к нДНК
К клеткам (2•104 клеток/лунку), разведенным полной средой RPMI-1640 рН 7.4 (Gibco, Scotland), содержащей 10% инактивированной эмбриональной бычьей сыворотки, 2 мМ глутамина («Serva», Germany), 100 ед/мл пенициллина (Россия), 100 мкг/мл стрептомицина (Россия), добавляли очищенные субфракции IgG-АТ к нДНК до конечной концентрации 1 мкг/мл. Каждый опыт повторяли трижды. Клетки инкубировали при 37 ºС, 0.5% СО2 в течение 72 часов.
Общее количество и количество жизнеспособных лимфоцитов после выделения из цельной крови и инкубации с субфракциями IgG-АТ к нДНК определяли методом исключения трипанового синего.
Определение уровня повреждения ядерной ДНК клеток после культивирования с субфракциями IgG-АТ к нДНК проводили методом флуоресцентной спектрофотометрии по изменению интенсивности флуоресценции комплекса ЭБ-ДНК хроматина лимфоцитов [2].
Определение уровня повреждения ядерной ДНК методом гель-электрофореза лизированных единичных клеток - «ДНК-комет»
Использовали 1%-ный раствор легкоплавкой агарозы («Fermentas», Canada) в ФСБ. На предметное стекло, покрытое полилизином («ApexLab», Россия), наносили 60 мкл агарозного геля с клетками (2•104 - 5•104), равномерно распределяли и оставляли на 30 минут при +20 °С. Лизис клеток (10 мM Tris-HCl pH 10, 2.5 M NaCl, 100 мM EDTA-Na2, 1% Triton X-100, 5% DMSO, +4 °С) проводили в течение 1 часа. Затем стекла переносили в электрофорезный буфер (300 мM NaOH, 1 мM EDTA-Na2, pH>13, +4 °С) и оставляли на 20 минут. Электрофорез проводили 20 минут при 1 В/см и 300 мА. По окончании препараты переносили в раствор для фиксации (70%-ный этиловый спирт) на 15 минут, после чего высушивали при +20 °С (1-2 часа). В качестве положительного контроля для визуализации деградации ДНК использовали клетки, инкубированные в течение 5 минут при -20 °С в присутствии 100 мкМ Н2О2. Препараты окрашивали акридиновым оранжевым (20 мкг/мл) в течение 30 минут и анализировали на флуоресцентном микроскопе (AxioScope A1, «Сarl Zeiss», Germany) с соответствующими фильтрами (возбуждающий фильтр 490 нм, дихроичное зеркало 510, отсекающий фильтр 530 нм), увеличение 40х.
Статистическая обработка данных
Из полученных данных изменения жизнеспособности и интенсивности флуоресценции ЭБ-ДНК клеток вычисляли медиану, 97,5 и 2,5 перцентили, используя стандартный пакет программ Excel Office 2003, дополнительно использовали критерий Даннета [1].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Повышение уровня ДНК-гидролизующих АТ наблюдается при СКВ и РА, но клиническая картина заболеваний отличается [4; 7]. Предположительно, IgG-АТ к нДНК являются индукторами и участниками воспалительного процесса при АИЗ, но что определяет их патогенетический потенциал и каким образом он реализуется в организме, до конца не выяснено.
Поэтому для более глубокого понимания роли АТ к нДНК в индукции и течении аутоиммунного синдрома была оценена зависимость генотоксичности IgG-АТ к нДНК от их физико-химических и иммуно-химических свойств.
Из каждой сыворотки было получено по 4 субфракции свободных от иммунных комплексов IgG-АТ к нДНК, различающихся зарядом (фракции I, характеризующиеся общим положительным зарядом, и фракции II с общим отрицательным зарядом) и аффинностью к нДНК - субфракции а, элюированные с нДНК-целлюлозы буфером, содержащим 1М NaCl, и субфракции б, элюированные с сорбента буфером Gly-HCl с рН 2.3, что позволяет сделать предположение об их большей аффинности к антигену.
Показано, что в присутствии положительно заряженных IgG-АТ к нДНК доноров снижается общее количество и количество жизнеспособных лимфоцитов по сравнению с контролем (ФСБ) (рис 1). IgG-АТ к нДНК больных СКВ на стадии обострения заболевания оказывают сходное с АТ доноров влияние на лимфоциты здоровых лиц, но их воздействие более выражено, что, вероятно, связано с их высокой ДНК-гидролизующей активностью.
Отсутствие у доноров клинических признаков заболевания при аналогичном воздействии на клетки IgG-АТ к нДНК доноров и больных СКВ на стадии обострения заболевания объясняется тем, что уровень IgG-АТ к нДНК в крови здоровых людей значительно ниже, чем у больных СКВ. Кроме того, большая часть IgG-АТ к нДНК в крови здоровых лиц находится в составе иммунных комплексов с антиидиотипическими АТ [4] или отрицательно заряженными биополимерами сходной с ДНК конформации.
В процессе выделения IgG-АТ к нДНК из сывороток происходит разрушение иммунных комплексов АТ-ДНК с образованием свободных АТ к нДНК, а в опытах на лимфоцитах мы использовали равные концентрации всех исследуемых АТ, получив таким образом возможность наблюдать потенциальный негативный эффект на клетки in vitro АТ доноров.
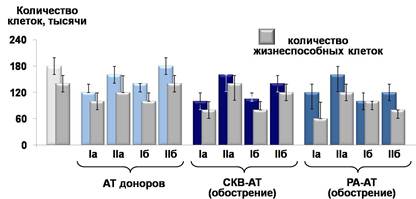
Рис. 1. Изменение общего количества и количества жизнеспособных лимфоцитов здоровых лиц после 72 часов инкубации при 37 °С в присутствии субфракций IgG-АТ к нДНК:
Iа - положительно заряженные низкоаффинные IgG-АТ к нДНК;
IIа - отрицательно заряженные низкоаффинные IgG-АТ к нДНК;
Iб - положительно заряженные высокоаффинные IgG-АТ к нДНК;
IIб - отрицательно заряженные высокоаффинные IgG-АТ к нДНК.
Вероятно, патологические СКВ-АТ к нДНК могут происходить от естественных АТ, выполняющих в организме защитные функции, но вопрос о причинах подобного аномального переключения остается открытым.
Впервые показано, что спектр цитотоксичных субфракций IgG-АТ к нДНК в сыворотках крови больных РА отличается от нормы и СКВ. Наряду с положительно заряженными низкоаффинными АТ к ДНК, характерными для доноров и больных СКВ, высокоаффинные положительно и отрицательно заряженные субфракции IgG-АТ к нДНК больных РА приводят к заметному снижению пролиферации и количества жизнеспособных лимфоцитов здоровых лиц in vitro.
Изменение конденсации хроматина лимфоцитов после воздействия субфракций IgG-АТ к нДНК было исследовано методом флуоресцентной спектрофотометрии. Образование разрывов в ДНК приводит к декомпактизации хроматина, увеличению мест связывания ЭБ с нуклеиновой кислотой и усилению флуоресценции комплекса ЭБ-ДНК [2].
Дополнительно генотоксичность IgG-АТ к нДНК была оценена методом «ДНК-комет». При наличии разрывов в ДНК нарушается структурная организация хроматина и утрачивается сверхспирализация, что приводит к релаксации молекул. В электрическом поле релаксированные петли и фрагменты ДНК вытягиваются по направлению к аноду, что и придает наблюдаемым объектам вид «комет». По длине и структуре «хвоста комет» можно судить о степени деградации ДНК клеток.
Повышение интенсивности флуоресценции комплекса ЭБ-ДНК в образцах, инкубированных с положительно заряженными IgG-АТ к нДНК (Iа, Iб) доноров, свидетельствует об изменении структуры ДНК хроматина клеток - снятии суперспирализации и возможном образовании разрывов (таблица 1). На типичных микрофотографиях объектов после инкубации клеток с положительно заряженными IgG-АТ к нДНК обнаружено образование «хвостов комет» (рис 2В), что не наблюдается в отрицательном контроле ФСБ (рис. 2А) и является отражением генотоксичности АТ к ДНК. Вероятно, некоторые ДНК-связывающие АТ доноров, проникая в клетки, могут достигать ядра, связываться с ДНК и изменять ее конформацию. Например, показано, что АТ в сайте связывания с ДНК значительно усиливают её разрушение гидроксил-радикалами [8]. Вероятно, АТ к нДНК способствуют окислительному разрушению нДНК, изменяя её структуру, делая доступным для гидроксил-радикалов сайты рестрикции.
Таблица 1 - Изменение уровня флуоресценции ЭБ-ДНК хроматина лимфоцитов после 72 часов инкубации при 37 °С с субфракциями IgG-АТ к нДНК
|
Субфракции IgG-АТ к нДНК |
Интенсивность флуоресценции комплекса ЭБ-ДНК, единиц/клетку |
|||
|
Доноры |
СКВ |
РА |
Контроль (ФСБ) |
|
|
Положительно заряженные низкоаффинные |
7.85 (6.75; 8.32) |
9.52 (9.27; 11.06) |
8.51 (8.40; 8.91) |
6.67 (5.75; 6.85) |
|
Отрицательно заряженные низкоаффинные |
5.56 (5.04; 6.80) |
6.95 (6.49; 7.12) |
5.98 (5.53; 6.19) |
|
|
Положительно заряженные высокоаффинные |
9.10 (8.94; 9.15) |
9.82 (9.25; 9.94) |
9.52 (9.24; 9.64) |
|
|
Отрицательно заряженные высокоаффинные |
6.40 (5.64; 7.07) |
6.64 (6.46; 7.67) |
7.60 (6.96; 9.33) |
|
Негативное воздействие на структуру ДНК хроматина лимфоцитов положительно заряженных субфракциями IgG-АТ к нДНК (Iа, Iб) больных СКВ на стадии обострения заболевания более выражено по сравнению с АТ доноров, что отражается в резком повышении флуоресценции комплекса ЭБ-ДНК. На типичной микрофотографии «ДНК-комет» отмечено образование широкого диффузного «хвоста кометы» (рис. 2Г), что является свидетельством высокой степени деградации ДНК лимфоцитов под воздействием АТ к ДНК больных СКВ. Генотоксичность IgG-АТ к нДНК больных СКВ в период обострения заболевания сравнима с действием перекиси водорода, использованной в данном эксперименте в качестве положительного контроля (рис. 2Б). Предположительно, наряду с ДНК-связывающими, ДНК-гидролизующие СКВ-АТ [5] в клетках, достигая ядра, сами могут выступать в качестве биокатализаторов гидролиза фосфодиэфирных связей ДНК и таким образом проявлять генотоксичность.

Рис. 2. Микрофотографии «ДНК-комет» после 72 часов инкубации при 37 °С лимфоцитов здоровых лиц с субфрациями IgG-АТ к нДНК:
А - отрицательный контроль (ФСБ); Б - положительный контроль (Н2О2);
В - типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа и Iб IgG-АТ к нДНК доноров;
Г - типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа и Iб IgG-АТ к нДНК больных СКВ;
Д- типичные ДНК-кометы, наблюдаемые после воздействия на лимфоциты субфракций Iа, Iб и IIб IgG-АТ к нДНК больных РА.
На основании полученных результатов можно заключить, что для АТ доноров и СКВ-АТ при воздействии на клетки in vitro большее значение имеет заряд молекул IgG-АТ к нДНК, нежели аффинность их к антигену.
Обнаружено, что при РА спектр генотоксичных субфракций шире, чем в норме и при СКВ - повышение флуоресценции комплекса ЭБ-ДНК хроматина клеток наблюдается после инкубации лимфоцитов с положительно заряженными низкоаффинными субфракциями (Iа), а также высокоаффинными субфракциями IgG-АТ к нДНК больных РА в период обострения заболевания, как положительно, так и отрицательно заряженными (Iб, IIб). При воздействии данных субфракций IgG-АТ к нДНК на клетки после электрофореза наблюдается формирование широких диффузных «хвостов комет» (рис. 2Д), свидетельствующее об образовании разрывов в ДНК лимфоцитов, что является следствием высокой генотоксичности АТ к ДНК при РА. На основании полученных результатов можно заключить, что при РА патогенетический потенциал IgG-АТ к нДНК определяется не зарядом молекулы, а аффинностью АТ к антигену - нативной ДНК. Это позволяет выдвинуть предположение об исходно иной природе формирования патологических IgG-АТ к нДНК при РА.
Вероятно, аномальное повышение уровня в крови естественных АТ к ДНК в определенных условиях способно привести к повреждению клеток иммунной системы, изменению их функциональной активности и экспрессии генов, что может отразиться нарушением иммунного статуса и индукцией аутоиммунного синдрома за счет интенсификации апоптоза здоровых клеток и накопления модифицированных В-лимфоцитов, продуцирующих патологические IgG-АТ к нДНК. Таким образом, IgG-АТ к нДНК являются одним из ключевых звеньев иммунной системы, отражают изменение иммунного статуса и принимают участие в сохранении гомеостаза в многоклеточном организме.
Рецензенты:
- Чиков В.И., д.б.н., профессор, Учреждение Российской академии наук Казанский институт биохимии и биофизики Казанского научного центра РАН, г. Казань.
- Габдрахманова Л.А., д.б.н., с.н.с., начальник Учебного управления ФГБОУ ВПО «Казанский государственный энергетический университет», г. Казань.
Работа получена 03.10.2011
/p


