Биофильтры являются одними из относительно недорогих и универсальных средств очистки сточных вод. Но обычные биофильтры пригодны только для обработки стоков с высокой концентрацией органических веществ. В то же время есть достаточно обширный класс промышленных сточных вод (например, шахтные и карьерные воды), в которых органические вещества практически отсутствуют. Для таких вод могут быть разработаны так называемые автотрофные биофильтры, в которых основу фильтрующей биомассы составляют нитчатые микроводоросли, выращиваемые непосредственно в очищаемой воде [1]. Одной из сложных технических задач, возникающих при создании таких биофильтров, является проблема обеспечения водорослей светом. Суть этой проблемы состоит в том, что свет в мутной сточной воде не проникает на толщину слоя более 10-20 см [2].
В промышленных установках для культивирования водорослей эта проблема решается либо использованием неглубоких (не более 0,3 м) резервуаров, расположенных в теплицах [3, 4], либо применяют аппараты, представляющие собой стеклянные трубы или плоские вертикальные прозрачные ёмкости, освещаемые люминесцентными лампами [5]. Первый из этих вариантов позволяет обеспечить малое потребление электроэнергии, но при больших объёмах сточных вод требует наличия больших площадей и характеризуется очень низкой удельной нагрузкой на единицу занимаемой площади. Недостатком второго варианта являются большие затраты электроэнергии на освещение. Оба варианта в конструктивном отношении мало пригодны для использования в качестве аппаратов для очистки сточных вод, а также не позволяют обеспечить достаточно равномерное освещение каждого элементарного объёма обрабатываемой воды.
Преодолеть указанные недостатки можно путём создания специальной системы освещения, состоящей из большого количества малогабаритных источников света, равномерно распределённых в объёме очищаемой воды. Современная светотехника располагает различными вариантами светящихся элементов, обладающих необходимыми свойствами. Одними из наиболее подходящих источников света подобного рода являются светодиоды. Небольшие габариты светодиодов позволяют компоновать из них любые осветительные системы, защищённые прозрачными водостойкими материалами, позволяющими работать в водной среде практически неограниченно долго. Кроме того, светодиоды обладают более высоким (до 80 %) коэффициентом полезного использования электроэнергии по сравнению даже с люминесцентными лампами, КПД которых не превышает 50 %. Применение светодиодов не исключит использование электроэнергии, но снимет ограничения в габаритах водоочистных аппаратов и позволит увеличить коэффициент использования световой энергии практически до 100 %.
В связи с этим целью данного исследования является установление принципиальной возможности применения светодиодов в технологическом процессе формирования микроводорослевых сообществ, обладающих свойствами биофильтров. Поставленная цель достигалась путём решения следующих задач.
1. Разработать конструкцию лабораторного аппарата и методику проведения соответствующих исследований.
2. С применением серии таких аппаратов осуществить процесс выращивания микроводорослевого сообщества на имитате загрязнённой воды.
3. Определить биофильтрующую эффективность полученных микроводорослевых сообществ.
4. Определить возможные различия в эффективности действия светодиодов с разными спектрами излучения.
Эксперименты по выращиванию водорослей и осветлению воды проводили в полиэтиленовых сосудах вместимостью 700 см3 (рис. 1). В каждом сосуде размещали коробчатый носитель для биообрастания из листового полиэтилена. Высота носителя 9 см, общая поверхность 250 см2. Расстояние от дна сосуда до нижней кромки носителя 3 см, от верхней кромки до поверхности воды 4 см.

Рис. 1. Экспериментальный сосуд
Рядом с носителем размещали аэратор, через который во время эксперимента с помощью микрокомпрессора непрерывно подавали воздух с расходом 50 ± 10 см3/мин. Аэратор конструктивно представлял собой аэролифт и обеспечивал постоянную циркуляцию воды в сосуде.
С противоположной стороны носителя был расположен источник света в виде пробирки, внутри которой находился светодиод. Луч от светодиода направлялся в сторону носителя, то есть к центру сосуда.
В качестве имитата загрязнённой воды и среды для выращивания водорослей готовили тонкодисперсную суспензию глины в водопроводной воде с концентрацией 100 мг/дм3. Суспензию заменяли в каждом сосуде еженедельно. При этом старую суспензию сливали с помощью сифона и наливали свежую. В первую порцию залитой суспензии, общий объём которой составлял 7 дм3, было внесено в качестве посевного материала около 1 см3 диспергированного зелёного микроводорослевого налёта, отобранного с поверхности влажной почвы. В течение 1 часа после каждой замены суспензии через каждые 15 мин из каждого сосуда отбирали пробы суспензии в объёме 5 см3 и измеряли концентрацию взвешенных веществ фотоэлектроколориметром КФК-2 с использованием предварительно построенной градуировочной кривой. По полученным результатам строили графики снижения концентрации взвеси во времени и определяли эффективность осветления суспензии в процессе её часовой циркуляции в экспериментальном сосуде.
В исследованиях использовали два экспериментальных варианта светодиодного освещения. В первом варианте использовали светодиоды белого свечения марки GRL-3014UWC с рабочим напряжением 3,3 В и мощностью 0,082 Вт. Во втором варианте применяли светодиоды жёлтого свечения марки HD3b-444FY с напряжением 2,5 В и мощностью 0,074 Вт. Повторность в экспериментальных вариантах трёхкратная.
В качестве контрольных вариантов использовали два сосуда. Сосуд №7 (рис. 2) был оборудован точно также, как и экспериментальные сосуды, но не имел источника света, не имел биообрастания, и суспензию в него заливали только на 1 час при проведении опыта по определению кинетики осветления суспензии в режиме циркуляции. Контрольный сосуд №8 (рис. 2) представлял собой ничем не оборудованный стеклянный цилиндр вместимостью 250 см3. В нём осуществлялся процесс осветления суспензии методом обычного безреагентного отстаивания.

Рис. 2. Сосуды во время опыта по осветлению суспензии:
1-3 - вариант со светодиодами белого свечения, 4-5 - вариант со светодиодами жёлтого свечения, 7-8 - сосуды контрольных вариантов, 9 - микрокомпрессор
Обработку результатов осуществляли с применением стандартных методов математической статистики.
Светодиоды горели непрерывно в течение 6.5 месяцев эксперимента. Каждый сосуд был закрыт светонепроницаемым чехлом, который снимали только во время замены суспензии и проведения опытов по определению кинетики осветления суспензии. Таким образом, продолжительность поступления дополнительного постороннего света не превышала 2 часов в неделю.
Система аэрации в экспериментальных сосудах работала непрерывно.
Температура воздуха и воды во время экспериментов находилась в пределах 20-25 °С.
1 раз в месяц после очередного опыта по изучению кинетики осветления суспензии проводили исследование характера биообрастания. Для этого из каждого сосуда осторожно вынимали пробирку со светодиодом и фотографировали участок максимального обрастания. Затем делали небольшой соскоб, пробирку со светодиодом возвращали на место, а соскоб подвергали микроскопированию и фотографировали участок микропрепарата с наиболее характерным набором микрообъектов.
На рис. 3 видно, как росла эффективность осветления суспензий при увеличении возраста биообрастания.
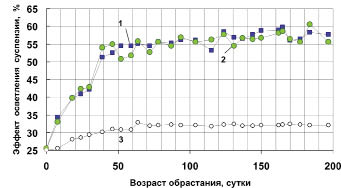
Рис. 3. Изменение эффекта осветления глинистой суспензии
в зависимости от возраста биообрастания:
1 -светодиоды белого свечения; 2 - светодиоды жёлтого свечения;
3 - контрольные опыты без биообрастания
Сразу можно отметить, что принципиальных отличий вариантов с разными спектральными характеристиками светодиодов нет. Как с белыми, так и с жёлтыми светодиодами абсолютные величины эффектов и характер их изменения были практически одинаковыми. Первые 40 дней происходил относительно быстрый, почти линейный рост эффективности, которая увеличилась с 25 до 51-54 %. Затем рост эффективности резко замедлился и медленно увеличивался также почти по линейному закону, приблизившись к концу эксперимента (197 суток) к 60 %.
Полученная эффективность явно ниже той, которая необходима на практике и должна быть не ниже 90 %. Из этого следует, что концентрация светодиодов в промышленных аппаратах должна быть в несколько раз больше. Для определения оптимальной частоты размещения источников света необходимо проведение специальных экспериментов.
Требует объяснения увеличение эффективности осветления суспензии в контрольных опытах при отсутствии биообрастания. Это обусловлено тем, что конструкция экспериментальных сосудов не позволяла с помощью сифона полностью удалять из них суспензию при её замене. В результате каждый раз на дне оставался небольшой объём с высокой концентрацией осевших частиц глины, которые увеличивали фактическую исходную концентрацию взвеси, не смотря на то, что заливалась всегда одна и та же концентрация 100 мг/дм3. Исходная концентрация в экспериментальных сосудах увеличивалась примерно в течение 80 дней. Затем наступило некоторое динамическое равновесие, при котором концентрация начала колебаться вокруг средней величины около 320 ± 30 мг/дм3. В связи с этим пришлось проводить опыты в контрольных сосудах при различных исходных концентрациях взвешенных частиц. На основании этих опытов была установлена зависимость эффекта осветления от исходной концентрации. Эта зависимость состояла в том, что эффект возрастает с ростом концентрации. Кривая 3 на рис. 3 и является отражением этой зависимости.
Эффекты в 7 и 8 контрольных сосудах при 15-кратной повторности с постоянной исходной концентрацией 100 мг/дм3 практически не отличались друг от друга и составили соответственно 25,9 ± 1,7 и 25,0 ± 0,9 % (указаны доверительные интервалы для 10 % уровня значимости).
Микроскопический анализ соскобов с поверхности осветителей показал, что видовой состав биообрастания может значительно отличаться даже в сосудах одного варианта и меняться в одном и том же сосуде в ходе эксперимента, что не отражается существенно на эффективности адсорбции взвешенных веществ. Наиболее часто обнаруживались нитчатые сине-зелёные и диатомовые водоросли (рис. 4). Из гетеротрофной компоненты биоценоза нередко встречались коловратки и нематоды.
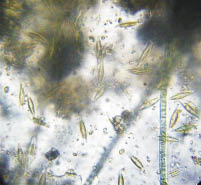
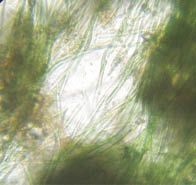
Сосуд №4 Сосуд №5
Рис. 4. Микрофотографии биологического обрастания
(возраст обрастания 197 суток, увеличение микроскопа 16×40)
Выводы
1. Светодиоды белого и жёлтого свечения можно использовать в качестве источников света при разработке автотрофных биофильтров.
2. В водопроводной воде продолжительность формирования биослоя с достаточно высокой эффективностью адсорбции при температуре 20-25 °С не превышает 40 суток.
3. В слое биообрастания встречаются самые различные виды водорослей. Доминируют нитчатые сине-зелёные и диатомовые водоросли.
4. Эффект одночасового осветления глинистой суспензии при использовании одного светодиода мощностью 0,07-0,08 Вт в сосуде вместимостью 0,7 дм3 находится в пределах 55-60 % при эффекте контрольного варианта 25-32 %.
Список литературы
- Золотухин И.А. Растения как средство очистки олиготрофных сточных и природных вод: монография. - Пермь: Перм. гос. пед. ун-т, 2001. - 235 с.
- Золотухин И.А. Светопроводящие свойства суспензии как среды для выращивания фотоавтотрофных организмов // Биотехнология. - 1992. - № 1. - С. 78-79.
- Технология промышленного культивирования дуналиеллы (Dunaliella salina) / Р.П. Тренкеншу, Р.Г. Геворгиз, А.Б. Боровиков. Институт биологии южных морейим. А.О. Ковалевского. - Севастополь, 2005. - 14 с.
- Технология промышленного культивирования спирулины (Spirulina platensis) / Р.П. Тренкеншу, Р.Г. Геворгиз. Институт биологии южных морей им. А.О. Ковалевского. - Севастополь, 2004. - 16 с.
- http://www.catfish.lv/test/algae.htm. (дата обращения: 14.11.2008).



