Экологические катастрофы природного и техногенного происхождения, необходимость обслуживания источников ионизирующего облучения, использование лучевой энергии в медицине требуют адекватного применения надежных медицинских мероприятий, направленных на реабилитацию здоровья больших контингентов населения, подвергшихся воздействию радиации в различных дозах [1-6, 9, 12, 19, 20, 21, 23].
Существующие препараты, применяемые для профилактики и лечения радиационных поражений, недостаточно эффективны и их количество чрезвычайно мало. Поэтому целесообразно проводить исследования по изысканию новых средств, обладающих радиопротекторной активностью [13, 22, 24, 25]. Учитывая важную роль свободнорадикальных процессов в возникновении острой лучевой болезни, перспективными в этом плане являются препараты с антиоксидантным типом действия, а именно производные 3-оксипиридина, которые имеют широкий спектр фармакологического действия [10, 13, 14, 16], проявляют защитные свойства при различных патологических состояниях [8, 15, 17]. При этом один из препаратов группы мексидол выгодно отличается прогнозируемостью, стабильностью и возможностью контроля за фармакологическим эффектом [7], что также известно из наших исследований. Повышается интерес специалистов к молекулярно-клеточным механизмам неопластических болезней, возможности нормализации вторичных неспецифических метаболических расстройств, формирующихся в процессе развития заболевания, с включением в комплексную терапию заболевания патогенетически обоснованной медикаментозной коррекции: антиоксидантов, антигипоксантов, мембранопротекторов [11, 18].
Необходимость разработки новых методов фармакологической коррекции оксидантного и метаболического статуса, защиты организма от токсических побочных эффектов лучевой терапии, определение критериев диагностики и прогнозирования нарушений определила выбор наших научных исследований. Однако в анализируемой литературе мы не встретили данных о возможности применения мексидола, соединения этилметилгидроксипиридина гемисукцината и нооклерина для коррекции послелучевых повреждений что и послужило мотивацией для проведения настоящего исследования.
В цели работы входила разработка патогенетически обоснованной медикаментозной коррекции оксидантного и метаболического статуса препаратами сопровождения с антиоксидантным типом действия при развитии цитостатической болезни, вызванной облучением.
В работе использованы производные 3-оксипиридина: препарат мексидол в виде 5 % официнального раствора в ампулах по 2 мл, соединение этилметилгидроксипиридина гемисукцинат, синтезированное профессором Смирновым Л.Д. (институт биохимической физики им. Н.М. Эммануэля Российской академии наук) и нооклерин, которые вводились животным в краевую вену уха по схемам.
Эксперименты были проведены на 40 кроликах-самцах породы «шиншилла» массой 2,5-3,0 кг. Все экспериментальные животные содержались в стандартных условиях вивария Пензенского государственного университета при естественном световом режиме на стандартной диете, свободном доступе к воде и пище. Все манипуляции с животными проводились в соответствие с правилами, принятыми Европейской конвенцией по защите позвоночных животных и используемыми для экспериментальных и иных научных целей (Страстбург, 1986).
Выполнено три серии опытов, в которых изучались оксидантный и метаболический статус на ионизирующую радиацию без какой-либо коррекции, а также на фоне фармакологической коррекции мексидолом, этилметилгидроксипиридина гемисукцинатом и нооклерином. Схема эксперимента представлена в таблице 1.
Таблица 1
Структура эксперимента
|
№ |
n |
Серии |
Режим эксперимента |
|
1 |
10 |
Контрольная |
Облучение: Co60, РИП - 90, maximum ионизации 5,31Гр, процентная глубинная доза 93 %, d=5Гр. |
|
2 |
10 |
Опытная |
Облучение: Co60, РИП - 90, maximum ионизации 5,31Гр, процентная глубинная доза 93 %, d=5Гр. Мексидол 5 мг/кг в/в через день в течение 29 суток |
|
3 |
10 |
Опытная |
Облучение: Co60, РИП - 90, maximum ионизации 5,31Гр, процентная глубинная доза 93 %, d=5Гр. Этилметилгидроксипиридина гемисукцинат 5 мг/кг в/в через день в течение 29 суток |
|
4 |
10 |
Опытная |
Облучение: Co60, РИП - 90, maximum ионизации 5,31Гр, процентная глубинная доза 93 %, d=5Гр. Нооклерин 120 мг/кг в/в через день в течение 29 суток |
Во всех сериях венозную кровь забирали до радиационного воздействия, на 8-е, 15-е, 22-е и 29-е сутки опыта из краевой вены уха кроликов. В качестве критериев оценки прогностически неблагоприятных сдвигов метаболического статуса использовали показатели содержания в крови продуктов липопероксидации - малонового диальдегида (МДА) и Fe-индуцированного МДА в исследуемой среде (Конюхова С.Г. с соавт., 1989), а также состояние антиоксидантной системы по показателям активности СОД (Frid R., 1975), каталазы (Королюк М.А. с соавт., 1998), глутатион пероксидазы (Paglia, Valentine, 1967), определяемых при помощи общепринятых спектрофотометрических и фотометрических методов исследования. О степени выраженности синдрома цитолиза судили по активности АСТ, АЛТ, определяемых колориметрическим динитрофенилгидразиновым методом, активности ЛДГ, определяемой кинетическим методом, и активности ЩФ, определяемой по «конечной точке». Изучали содержание общего белка в сыворотке крови, концентрацию глюкозы в плазме крови, мочевой кислоты, общего и прямого билирубина, общего холестерина, триглицеридов, мочевины (Камышников В.С., 2002).
Для биохимических исследований использовали фотоэлектрокалориметр «КФК-2МП» и спектрофотометр «СФ-46».
Белковые фракции сыворотки крови разделяли с использованием системы для электрофореза «Кормэй - DS-2» и наборов реагентов (с агаровыми пластинами) фирмы «Кормэй» (Польша).
Статистическую обработку полученных результатов проводили с помощью пакета статистических программ: русифицированная версия программы STATISTICA (StatSoft - Russia, 1999), BIOSTAT (S.A. Glantz, McGraw Hill, перевод на русский язык - «Практика, 1998). Результаты представлены в виде средней арифметической и её ошибки (M±m). Проверка нормальности распределения проводилась по критерию Шапиро-Уилка. Для оценки достоверности различий независимых переменных между группами использовали t-критерий Стьюдента. В случае распределения, отличного от нормального, для оценки достоверности различий между независимыми переменными использовался непараметрический критерий Манна-Уитни. Различия считались статистически значимыми с вероятностью не менее 95 % (p<0,05).
Результаты исследования
При лучевом воздействии в плазме крови экспериментальных животных отмечался рост уровня МДА на 8-е сутки с 7,35±0,21 мкмоль/л до 13,62±0,05 мкмоль/л (p<0,001), на 15-е сутки и дальше - в среднем в 1,5 раза (рис. 1).
В опытных группах было отмечено снижение величины МДА с восьмых суток до уровня интактного контроля мексидолом. ЭМГП и нооклерин снижали МДА ниже интактного контроля. Облучение способствовало снижению активности каталазы и СОД с 8-ых суток и до конца опыта в среднем на 25,4 % и 21,4 %, глутатионпероксидаза снижалась только в первой половине эксперимента. Во всех опытных группах отмечалось увеличение СОД, в большей степени при инъекциях мексидола. Активность каталазы и глутатионпероксидазы соединениями изменялась значительно меньше.
Лучевое воздействие оказывало гепатотоксическое действие, о чем свидетельствует повышение активности индикаторных цитолитических ферментов. Максимальное повышение ферментов АЛТ, АСТ и ЩФ в среднем в 2 раза регистрировалось на 15-е сутки. Активность ЛДГ на 29-е сутки повышалась на 81,9 %. Мексидол и ЭМГП снижали активность АЛТ и АСТ у всех животных относительно показателей у облученных животных. Мексидол снижал активность ЛДГ на 29-е сутки на 32,3 %. ЭМГП и нооклерин снижали активность ЩФ в среднем на 57 % относительно соответствующего показателя облученных животных и в среднем в 1,8 раз относительно интактного контроля.
Уровень мочевины повышался в течение трех недель после однократного облучения и на 29-е сутки снижался в 2,15 раза относительно интактного контроля. Мексидол, ЭМГП, нооклерин повышали уровень мочевины на 29-е сутки почти в 2 раза относительно облученных животных, что говорит об активном восстановлении мочевинообразовательной функции печени.
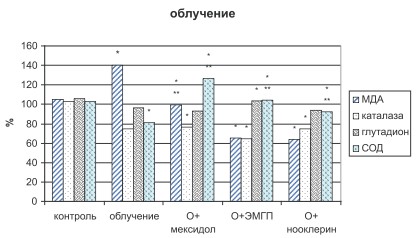
Рис. 1. Содержание МДА, каталазы, глутатионпероксидазы, СОД на 29-е сутки при лучевом воздействии на фоне введения мексидола, ЭМГП и нооклерина.
* p<0,05-достоверность отличия с данными интактной группы.
** p<0,05-достоверность отличия с данными контрольной группы.
Креатинин, мочевая кислота при введении соединений с антиоксидантной активностью определялись ниже показателей при облучении и приближались к уровню интактного контроля. На 29-е сутки, где имело место резкого падения уровня мочевой кислоты, мексидол, ЭМГП, нооклерин повышали его в 2,2, 5,6 и 7,5 раза соответственно относительно показателей без коррекции. Концентрация общего и прямого билирубина при коррекции мексидолом, ЭМГП, нооклерином достоверно снижались во все исследуемые сроки относительно облученных животных, но только уровень прямого билирубина восстанавливался в отдаленном периоде до интактного контроля. В конце исследования уровень триглицеридов и холестерина снижались во всех опытных группах.
Лучевое воздействие ингибировало белоксинтезирующую функцию печени. Содержание общего белка сыворотки крови у животных снижалось на 22,7 % к 15 суткам. Отрицательная динамика наблюдалась при определении содержания альбуминов. Изменения белкового спектра сыворотки крови при облучении характеризовались снижением всех фракций особенно к 15 суткам, что проявлялось в снижении фракции α1 в 1,3 раза, α2 в 3,6 раза, β в 2 раза, γ в 2,8 раз. Мексидол, ЭМГП, нооклерин восстанавливали белоксинтезирующую функцию. Содержание общего белка сыворотки крови у животных и концентрация альбуминов увеличивались. Изменения белкового спектра сыворотки крови при введении препаратов сопровождения с антиоксидантным действием характеризовались повышением всех фракций к 15 суткам. Таким образом, лучевое повреждение оказывало гепатотоксическое действие, которое проявлялось в развитии цитолитического синдрома, угнетении белково-, мочевиносинтезирующей функции печени и полностью восстанавливалось изучаемыми антиоксидантами.
Список литературы:
- Бердов, Б.А. Интраоперационная лучевая терапия в комбинированном лечении рака желудка. Методологические и технические аспекты / Б.А. Бердов, Ю.С. Мардынский, В.Ю. Скоропад [и др.] // Вопросы онкологии. - 2001. - Т. 47. - С. 631-635.
- Бердов Б.А. Отдаленные результаты клинического исследования эффективности пред- и интраоперационной лучевой терапии в комбинированном лечении рака желудка / Б.А. Бердов, Ю. С. Мардынский, В. Ю. Скоропад [и др.] // Вопросы онкологии. - 2006. - Т. 52. - № 5. - С. 515-520.
- Бриллиант М.Д. Изменение некоторых показателей периферической крови при тотальном облучении человека / М.Д. Бриллиант, А.И. Воробьев // Проблемы гематологии и переливания крови. - 1972. - №1. -С. 7-11.
- Важенин А.В. Нейтронно-фотонная лучевая терапия опухолей головного мозга / А.В. Важенин, А.С. Доможирова, М.В. Васильченко, З.З. Мунасипов, Г.В. Мокичев, Э.П. Магда // Вопросы онкологии. - 2003. - т. 49. - №43. - С.328-331.
- Владимиров В.Г. Модификация радиационных эффектов / В.Г. Владимиров, И.И. Красильников // Радиац. биология. Радиоэкология. - 1994. - Т. 34. - Вып. 1. - С. 121-138.
- Воробьев А.И. Радиационно-индуцированные лейкозы / А.И. Воробьев, У.И. Домрачева // Проблемы гематологии и переливания крови. - 2000. - №4. - С. 5-15.
- Воронина Т.А. Перспективы поиска новых анксиолитиков / Т.А. Воронина, С.Б. Середенин // Экспериментальная и клиническая фармакология №5. - 2002. - №5. - С. 4-17.
- Голиков П.П., Матвеев С.Б., Логинов Л.П. и соавт. Применение антиоксиданта мексидола в коррекции процессов ПОЛ у больных с ингаляционной травмой // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека». - Смоленск, 2001. - с. 209-210.
- Гусаров И.И. Радонотерапия и радиационный гормезис / И.И. Гусаров, А.В. Дубовской // Медицинская радиология и радиационная безопасность. - 1999. - №2. - С. 18-25.
- Донскова Ю.С. Состояние антиоксидантной и иммунной систем у онкологических больных на этапах хирургического лечения с интраоперационной радиотерапией / Ю.С. Донскова, Н.А. Осипова, Р.И. Якубовская, Е.Р. Немцова, Т.В. Сергеева, Н.В. Эделева // Анестезиология и реаниматология. - 2004. - №3. - С. 67-70.
- Зенков Н. К. Окислительный стресс: биохимический и патофизиологический аспекты / Н.К. Зенков, В.З. Ланкин, Е.Б. Меньшикова. - М.: Наука: Интерпериодика, 2001. - 340 с.
- Зырянов Б.Н. Осложнения при сочетании интраоперационного облучения и адъювантной химиолучевой терапии у больных раком легкого / А.А Завьялов, С.В. Миллер, Б.С. Ходкевич, С.А. Коломиец, В.А. Евтушенко, О.В. Черемисина, Ю.В. Рудых, С.В. Тропин // Вопросы онкологии. - 2003. - т. 49. - №3. - С. 370-372.
- Матюшин И.А., Балабаньян В.Ю., Кудрин В.С. и соавт. Антирадикальная и антиоксидантная активность ряда нейротропных и антигипоксических средств // Труды нац. научно-практ. конф. с междун. участием «Свободные радикалы, антиоксиданты и болезни человека». - Смоленск, 2001. - с. 46-48.
- Петрович Ю.А. Свободнорадикальное окисление и его роль в патогенезе воспаления, ишемии и стресса / Ю.А. Петрович, Д.В. Гуткин // Патологическая физиология и экспериментальная медицина. - 1986. - №5. - С. 85-92.
- Поварова О.В. Антиоксиданты как нейропротекторы при ишемическом инсульте / О.В. Поварова, Е.И. Каленикова, Е.И. Городецкая, О.С. Медведев // Экспериментальная и клиническая фармакология. - 2003. - т.66. - №3. - С. 69-73.
- Саприн А.Н. Окислительный стресс и его роль в механизмах апоптоза и развития патологических процессов / А.Н. Саприн, Е.В. Калинина // Успехи биологической химии. - 1999. - т. 39. - С. 289-326.
- Суслина З.А., Смирнова И.Н., Федорова Т.Н. и соавт. Оценка фармакологических эффектов антиоксиданта мексидола у больных с сосудистыми заболеваниями головного мозга // Сбор. тезисов 2-го Съезда Рос. науч. общ. фармакологов. - М., 2003. - с. 209.
- Чеснокова Н.П. О роли активации свободнорадикального окисления в структурной и функциональной дезорганизации биосистем в условиях патологии / В.В. Моррисон, Е.В. Понукалина и др.// Успехи современного естествознания. - 2008. - №1.
- Ярилин А.А. Действие ионизирующей радиации на лимфоциты (повреждающий и активирующий эффекты) / А.А. Ярилин // Иммунология. - 2000. - №5. - С. 5-11.
- Ярмоненко С.П. Радиобиология человека и животных. - М.: Высш.шк., 1988. - 375 с.
- Akiyama M. Late effects of radiation on the human immune system: an overview of immune response among the atomic-bomb survivors // Int J Radiat Biol 1995 Nov;68(5):497-508.
- Goldstein, B. Further studies of radiation induced interphase death of cultured mammalian cells / В. Goldstein, S. Okada // Radiations Res. - 1972. - Vol. 51. - № 3. - Р. 685-695.
- Lloyd D.C. Doses in Radiation Accidens Investsigated by Chromosome Aberrations Analysis (National Radioprotection Board Report) / D.C. Lloyd, А.А. Edvards, I.S. Posser. - Chilton. - 1986. - Р. 99-101.
- Weichselbaum, R. Radiotherapy failure is associated with inherent cellular radioresistance / Weichselbaum R., Beckett M. // Int. J. Radiat. Oncol. Biol. Phys. - 1987. - Vol. 13. - Suppl. 1. - P. 192.
- Wratten, C. Fatigue during breast radiotherapy and its relationship to biological factors / C. Wratten, J. Kilmurray, S. Nash, M. Seldon, C. Hamilton, P.C. Obrien, E.W. Denham // International journal of radiation oncology, biology, physics. - 2004. - Vol. 59. - P. 160-167.



