Введение
Параселлярные менингиомы представляют собой группу доброкачественных опухолей, растущих вокруг турецкого седла, и составляют 5–15 % от числа всех интракраниальных менингиом [1]. Матрикс данных новообразований может вовлекать бугорок и диафрагму турецкого седла, площадку основной кости, передние наклоненные отростки, кавернозный синус, медиальные отделы крыльев основной кости, канал зрительного нерва. В непосредственной близости от указанных анатомических областей располагаются зрительные нервы и хиазма, что объясняет ведущее значение офтальмологической симптоматики в клинической манифестации заболевания. Так, по разным данным, зрительные нарушения, включающие некорригируемое снижение остроты зрения, нарушение цветовосприятия и появление дефектов поля зрения, встречаются в 81–100 % наблюдений [2]. Их возникновение обусловлено постепенно прогрессирующим сдавлением хиазмы и/или зрительного нерва в канале или в полости черепа, приводящим к развитию компрессионной оптической нейропатии [3]. Рост опухоли в канал зрительного нерва неизбежно ведет к слепоте вследствие анатомических особенностей (бедная сеть артериальных пиальных анастомозов в интраканальном сегменте нерва, ущемление нерва серповидной связкой по выходу в полость черепа) и требует хирургического вмешательства по декомпрессии нерва [4]. Первое описание рассечения серповидной связки при удалении менингиомы в области выходного отверстия канала зрительного нерва принадлежит W.E. Dandy в 1922 г. [5], однако лишь в 1980-х гг., с развитием микронейрохирургии, декомпрессия зрительного нерва стала использоваться как рутинная, но дополнительная опция при удалении параселлярных менингиом. Частая инвазия канала зрительного нерва при росте параселлярных менингиом (до 96 % при менингиомах бугорка турецкого седла [6]), тенденция на сохранение и улучшение качества жизни пациентов в хирургии основания черепа привели к появлению большого количества серий наблюдений за результатами хирургического лечения данных опухолей. Большинству авторов не удалось доказать положительное влияние декомпрессии зрительного нерва на восстановление зрения после операции. Так, в 2019 г. секция хирургии основания черепа Европейской ассоциации нейрохирургов (EANS) опубликовала рекомендации по хирургическому лечению и периоперационному ведению пациентов с менингиомами бугорка турецкого седла, где декомпрессия зрительных нервов не рекомендовалась как рутинная процедура у пациентов с данными опухолями [7]. Однако борьба за восстановление зрения и, как следствие, улучшение качества жизни у данной группы пациентов диктует необходимость тщательного анализа динамики зрительных нарушений после хирургического удаления параселлярных менингиом. Ввиду всего вышеперечисленного актуальность затрагиваемой проблемы подтолкнула авторов к проведению данного исследования.
Цель исследования – проанализировав результаты хирургического лечения пациентов с параселлярными менингиомами, оценить эффективность выполнения декомпрессии зрительного нерва в отношении улучшения зрительных функций.
Материалы и методы исследования
Общая характеристика материала
В рамках исследования были ретроспективно проанализированы результаты лечения пациентов, оперированных в НХО № 5 НМИЦ им. В.А. Алмазова в период с февраля 2015 г. по май 2025 г. Критериями включения были: гистологический диагноз «менингиома», расположение матрикса опухоли на бугорке, диафрагме турецкого седла, площадке основной кости, переднем наклоненном отростке, кавернозном синусе, медиальных отделах крыла основной кости, канале зрительного нерва; наличие зрительных нарушений (некорригируемое снижение остроты зрения, дефекты поля зрения, нарушение цветовосприятия) и проведенное за период госпитализации хирургическое лечение. Исключались пациенты без зрительных нарушений и не давшие согласия на участие в исследовании. В него были включены 106 пациентов: 18 (17 %) мужчин и 88 (83 %) женщин, средний возраст составил 54 года (минимум – 19, максимум – 78). Распределение пациентов в зависимости от локализации матрикса менингиом отражено на рис. 1.
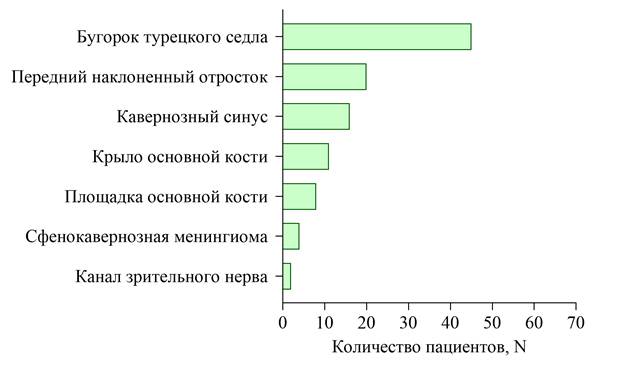 Рис. 1. Распределение пациентов по локализации менингиом.
Рис. 1. Распределение пациентов по локализации менингиом.
Источник: составлено авторами на основе полученных в ходе исследования данных
Офтальмологическое обследование
Всем пациентам до и после операции проводилось комплексное офтальмологическое обследование, включавшее в себя определение максимальной корригированной остроты зрения, периметрию по Ферстеру на красную и белую метки, осмотр глазного дна. По степени снижения остроты зрения пациенты разделялись по степеням: 0 степень (острота зрения с коррекцией 0,9–1,0), 1 степень (острота зрения с коррекцией 0,4–0,8), 2 степень (острота зрения с коррекцией 0,2–0,3), 3 степень (острота зрения с коррекцией 0,05–0,1), 4 степень (острота зрения с коррекцией 0,04 и менее). Изменения центрального и периферического поля зрения на красный и белый цвет классифицировались по разработанной на отделении оригинальной шкале (табл. 1). Выраженность зрительной дисфункции у пациентов с параселлярными менингиомами, влияющей на их социальную адаптацию, оценивалась по Шкале немецкого офтальмологического общества (German Ophthalmological Society), в литературе обозначаемой как VIS (visual impairment score). Данная шкала впервые была использована Fahlbush в 2002 г. [8] и впоследствии рекомендована для стандартизации оценки результатов лечения пациентов с менингиомами параселлярной локализации [7]. Динамика зрительных нарушений в послеоперационном периоде оценивалась следующим образом: если по результатам контрольного офтальмологического осмотра уменьшалась степень снижения остроты зрения и/или степень нарушения поля зрения, то динамика зрительной функции оценивалась как «улучшение», если увеличивалась – как «ухудшение», если оба описываемых параметра не изменялись – «без динамики». Динамика баллов по VIS трактовалась как «улучшение» при уменьшении суммы баллов на 5 и более, «ухудшение» – при увеличении суммы баллов на 5 и более, «без динамики» – при меньших изменениях суммы баллов. Данный подход использовался в других исследованиях для интерпретации динамики баллов по VIS [9]. Итоговый результат лечения оценивался на основании изменения состояния зрительной функции как «улучшение» и «без улучшения».
Зрительные нарушения с двух сторон имели 27 пациентов, 2 пациента были оперированы повторно. При удалении опухоли без вскрытия канала зрительного нерва динамика остроты и поля зрения оценивалась на глазах, имевших нарушения по данным предоперационного обследования. В случае выполнения декомпрессии зрительного нерва динамика оценивалась только на стороне декомпрессии. Таким образом динамика зрительных нарушений была оценена для 133 глаз.
Таблица 1
Степени изменения поля зрения по данным периметрии по Ферстеру
|
Степень |
Описание |
|
0 |
Норма (нет сужений на красную и белую метки) |
|
1 |
Сужение границ поля зрения на красную метку менее 30º по височному меридиану или менее 20º по остальным при нормальных границах на белую метку |
|
2 |
Сужение поля зрения на белую метку по одному или нескольким меридианам до 40º от точки фиксации при нарушенных границах поля зрения на красную метку |
|
3 |
Сужение границ поля зрения на белую метку менее 40º, но не более 20º и/или появление относительных центральных скотом при нарушенных границах поля зрения на красную метку |
|
4 |
Сужение границ поля зрения на белую метку менее 20º, но не более 10º и/или появление абсолютных центральных скотом размерами не более 10º при нарушенных границах поля зрения на красную метку |
|
5 |
Сужение периферических границ поля зрения вплоть до точки фиксации в виде квадрант- или гемианопсий и/или абсолютных центральных скотом размерами более 10º при нарушенных границах поля зрения на красную метку |
|
6 |
Выраженные центральные и/или периферические дефекты поля зрения (вплоть до остаточного поля зрения) при отсутствии восприятия красного цвета |
|
7 |
Полное отсутствие восприятия белого цвета с сохраненным или отсутствующим светоощущением |
Источник: составлено авторами на основе полученных в ходе исследования данных.
Нейровизуализационное обследование
Всем пациентам на дооперационном этапе выполнялась магнитно-резонансная томография с контрастным усилением и толщиной среза не более 1 мм. При подозрении на инвазию опухоли в канал зрительного нерва дополнительно использовались режимы CISS/ FIESTA и VIBE. По отношению опухоли к каналу зрительного нерва выделяли следующие группы: нет инвазии опухоли в канал нерва; вторичная инвазия – пролабирование мягкотканного фрагмента в канал без признаков дуральной инвазии; инвазия одной стенки канала – распространение «дурального хвоста» в канал по одной стенке; инвазия двух стенок; инвазия трех или всех стенок. Данная система оценивания основывалась на подходе Nimmanitya и соавт. [6, 10]. На рис. 2 изображено распределение глаз по степени инвазии канала зрительного нерва (рис. 2). В послеоперационном периоде всем пациентам выполнялась компьютерная томография головного мозга на 1-е сутки после операции и магнитно-резонансная томография головного мозга с контрастным усилением через 3 месяца послеоперации. 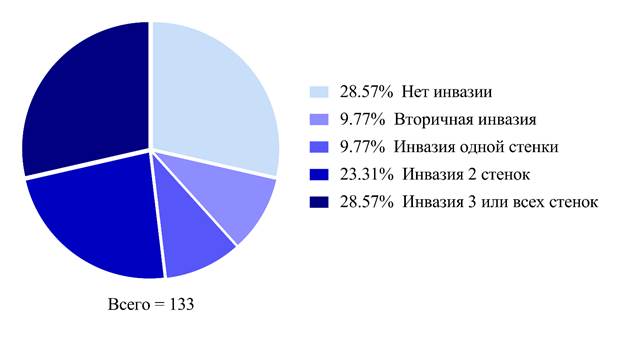
Рис. 2. Распределение в зависимости от степени инвазии канала зрительного нерва. Источник: составлено авторами на основе полученных в ходе исследования данных
Хирургическое лечение
Всем пациентам было проведено транскраниальное удаление опухоли, в том числе (в 49,6 % случаев) с декомпрессией зрительного нерва путем вскрытия канала нерва, рассечения серповидной связи и ТМО по ходу нерва (рис. 3). При наличии инвазии опухоли в канал и отсутствии инвазии арахноидальной и мягкой оболочек нерва выполнялось удаление интраканального фрагмента опухоли. Основным доступом, применяемым авторами в хирургии параселлярных менингиом, был птериональный. В начале данной хирургической серии в двух случаях авторы использовали бифронтальную краниотомию, однако быстро от нее отказались в связи с высоким риском явлений венозной дисгемии, особенно у пожилых пациентов, послеоперационной аносмии и узким хирургическим коридором, не позволяющем контролировать мелкие перфоранты от ВСА и ПМА-ПСА к зрительным нервам и хиазме. Супраорбитальная краниотомия использовалась авторами только в двух случаях при удалении менингиом площадки основной кости без распространения на бугорок и диафрагму седла. Использование миниптерионального доступа было в двух случаях удаления небольших менингиом бугорка.
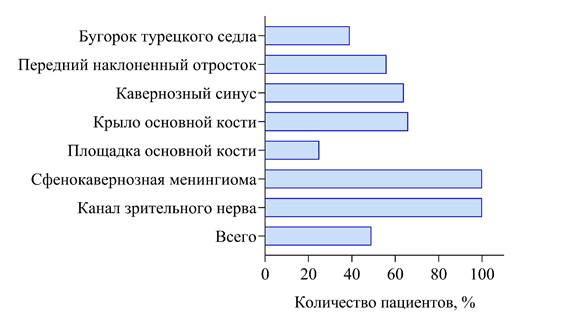
Рис. 3. Частота выполнения декомпрессии зрительного нерва при различной локализации матрикса параселлярных менингиом у пациентов со зрительными нарушениями.
Источник: составлено авторами на основе полученных в ходе исследования данных
Статистическая обработка материала
Статистический анализ выполнен в программе Statistica 12. Соответствие распределения количественных переменных нормальному закону оценивалось с использованием W-критерия Шапиро – Уилка. Количественные переменные представлены в виде среднего арифметического и стандартного отклонения (Mean±SD), а также медианы (Median) и межквартильного интервала (IQR – Interquartile Range). Различия между двумя независимыми группами оценивались с использованием U-критерия Манна – Уитни. Оценка динамики количественных показателей выполнена с использованием W-критерия Уилкоксона. Категориальные переменные представлены в виде абсолютных частот и относительных долей. Динамика категориальных переменных оценивалась с использованием Q-критерия Кохрена. Различия в таблицах сопряженности оценивались с помощью критерия Хи-квадрат Пирсона и точного критерия Фишера при минимальных ожидаемых частотах менее 10. Степень различий представлена в виде отношения шансов (OR – Odds Ratio) с 95 % доверительным интервалом. Для оценки совместной изменчивости количественных переменных использовался коэффициент ранговой корреляции Спирмена. Пороговый уровень статистической значимости принят для p < 0,05.
Результаты исследования и их обсуждение
Средний возраст женщин составил 52,6±11,2 года (медиана 53,4; межквартильный интервал 44,9–59,9), тогда как у мужчин этот показатель был выше и составил в среднем 58,1±10,2 года (медиана 60,6; межквартильный интервал 53,1–65,5). Различия между группами оказались статистически значимыми (p = 0,021), что указывает на наличие половых различий в распределении возрастных категорий среди пациентов, перенесших хирургическое лечение параселлярных менингиом.
Анализ динамики зрительных функций и статуса социальной адаптации пациентов до и после хирургического лечения менингиом представлен в табл. 2 и на рис. 4, 5. Острота зрения улучшилась в среднем с 0,44±0,39 до операции до 0,55±0,41 после операции (p < 0,001), что свидетельствует о положительной динамике. Степень снижения остроты зрения уменьшалась – с 1,9±1,55 до 1,57±1,63 (p < 0,001). Было отмечено значимое уменьшение степени изменения поля зрения с 3,94±2,09 до 3,15±2,53 баллов (p < 0,001), а также уменьшение балла по VIS – со среднего значения 32,7±28,7 до 26,3±30,8 (p < 0,001). Полученные данные демонстрируют статистически значимое улучшение зрительных функций и статуса социальной адаптации после операции.
Таблица 2
Динамика показателей остроты зрения и балла по VIS до и после операции
|
Показатель |
До операции |
После операции |
P-value |
|
Острота зрения |
0,44±0,39 |
0,55±0,41 |
< 0,001 |
|
Степень снижения остроты зрения |
1,9±1,55 |
1,57±1,63 |
< 0,001 |
|
Степень изменения поля зрения |
3,94±2,09 |
3,15±2,53 |
< 0,001 |
|
Балл по VIS |
32,7±28,7 |
26,3±30,8 |
< 0,001 |
Источник: составлено авторами на основе полученных в ходе исследования данных.
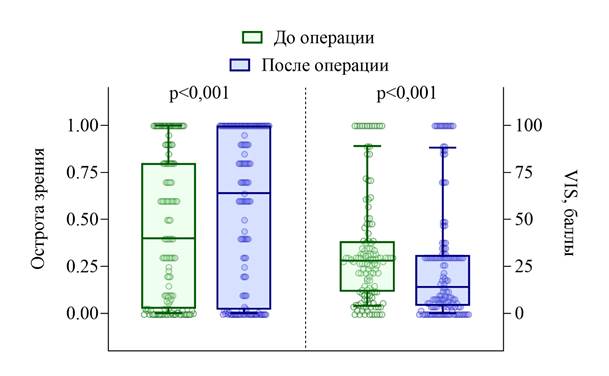
Рис. 4. Динамика остроты зрения и балла по VIS до и после операции.
Источник: составлено авторами на основе полученных в ходе исследования данных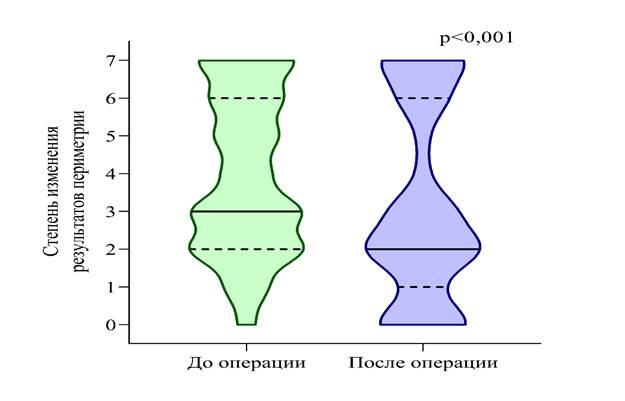
Рис. 5. Динамика поля зрения до и после операции.
Источник: составлено авторами на основе полученных в ходе исследования данных
Динамика результатов периметрии до и после хирургического лечения отражена в табл. 3 и на рис. 6. После операции наблюдалось значительное увеличение доли пациентов с нормальным полем зрения, что свидетельствует о положительной динамике зрительных функций. В то же время уменьшалась частота грубых нарушений полей зрения: так, категория со сужением границ на белую метку до точки фиксации встречалась после операции в 5,51 раза реже, а случаи сужения полей зрения до 10º – в 3,91 раза реже. Наиболее выраженный регресс визуальных нарушений был отмечен в группах с тяжелыми дефектами поля зрения до операции, что указывает на эффективность хирургического лечения в восстановлении зрительных функций. Однако в отношении пациентов с полным выпадением поля зрения на красную метку, а также в случае амавроза вероятность улучшения зрительных функций после операции была крайне мала, что свидетельствует о необратимости повреждения зрительного анализатора у данной группы пациентов.
Таблица 3
Динамика результатов периметрии до и после операции
|
Категория |
До операции |
После операции |
P-value |
OR [CI] |
|
Результаты периметрии в пределах нормы |
4 (3 %) |
27 (20 %) |
< 0,001 |
0,12 |
|
Сужение границ только на красную метку |
10 (8 %) |
8 (6 %) |
0,593 |
1,27 |
|
Сужение границ на белую метку до 40º |
27 (20 %) |
34 (26 %) |
0,194 |
0,74 |
|
Сужение границ на белую метку от 20 до 40º, появление относительных центральных скотом |
26 (20 %) |
19 (14 %) |
0,194 |
1,46 |
|
Сужение границ на белую метку от 20 до 10º, абсолютные центральные скотомы до 10º |
11 (8 %) |
3 (2 %) |
0,021 |
3,91 |
|
Сужение границ на белую метку до точки фиксации в виде квадрант- или гемианопсий, абсолютные центральные скотомы более 10º |
15 (11 %) |
3 (2 %) |
0,002 |
5,51 |
|
Грубые центральные и/или периферические дефекты (вплоть до остаточного поля зрения), полное выпадение на красную метку |
17 (13 %) |
14 (11 %) |
0,405 |
1,25 |
|
Полное выпадение на белую метку |
23 (17 %) |
25 (19 %) |
0,480 |
0,9 |
Источник: составлено авторами на основе полученных в ходе исследования данных.
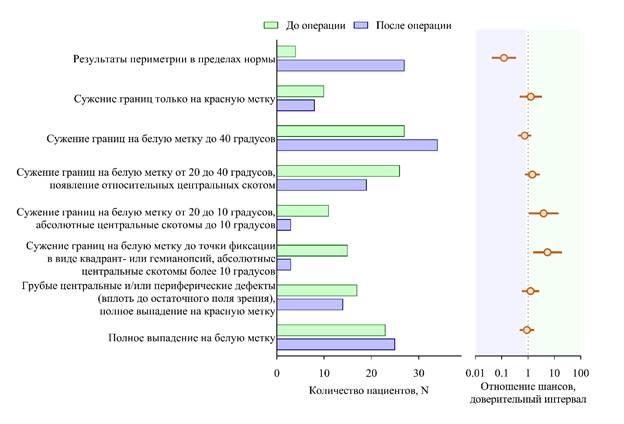
Рис. 6. Динамика результатов периметрии до и после операции.
Источник: составлено авторами на основе полученных в ходе исследования данных
В табл. 4 и на рис. 7, 8 представлен анализ результатов хирургического лечения в зависимости от выполнения декомпрессии зрительного нерва. Так, в группе пациентов с декомпрессией зрительного нерва шансы на улучшение остроты зрения были выше в 2,29 раз по сравнению с пациентами, которым выполнялось лишь удаление опухоли. При этом в данной группе также были выше шансы на ухудшение остроты зрения, однако эти различия не были статистически значимы (p = 0,304), вероятно, из-за малого числа событий (3 против 1). Улучшение поля зрения у пациентов с декомпрессией зрительного нерва отмечалось в 2,94 раза чаще, чем в группе без декомпрессии (p = 0,002). Та же тенденция отмечается в отношении суммарной зрительной функции (острота + поле зрения) и итогового результата лечения: шансы на улучшение в 2,59 раз выше в группе пациентов с декомпрессией зрительного нерва (p = 0,007). Лишь на динамику баллов по VIS статистически значимого влияния декомпрессии зрительного нерва не было выявлено.
Таблица 4
Оценка результата лечения в зависимости от проведения декомпрессии зрительного нерва
|
Результат лечения |
Проведение декомпрессии |
Отсутствие декомпрессии |
P-value |
Отношение шансов [ДИ] |
|
Динамика остроты зрения |
||||
|
Ухудшение |
3 (5 %) |
1 (1 %) |
0,304 |
3,14 |
|
Без динамики |
41 (62 %) |
54 (81 %) |
0,018 |
0,39 |
|
Улучшение |
22 (33 %) |
12 (18 %) |
0,042 |
2,29 |
|
Динамика поля зрения |
||||
|
Ухудшение |
3 (5 %) |
5 (7 %) |
0,718 |
0,59 |
|
Без динамики |
23 (35 %) |
39 (58 %) |
0,007 |
0,38 |
|
Улучшение |
40 (61 %) |
23 (34 %) |
0,002 |
2,94 |
|
Динамика зрительной функции |
||||
|
Ухудшение |
3 (5 %) |
6 (9 %) |
0,493 |
0,48 |
|
Без динамики |
22 (33 %) |
35 (52 %) |
0,028 |
0,46 |
|
Улучшение |
41 (62 %) |
26 (39 %) |
0,007 |
2,59 |
|
Динамика балла по VIS |
||||
|
Ухудшение |
4 (6 %) |
4 (6 %) |
1,000 |
1,02 |
|
Без динамики |
35 (53 %) |
39 (58 %) |
0,548 |
0,81 |
|
Улучшение |
27 (41 %) |
24 (36 %) |
0,546 |
1,24 |
|
Результат лечения |
||||
|
Без улучшения |
25 (38 %) |
41 (61 %) |
0,007 |
0,39 |
|
Улучшение |
41 (62 %) |
26 (39 %) |
2,59 |
|
Источник: составлено авторами на основе полученных в ходе исследования данных.
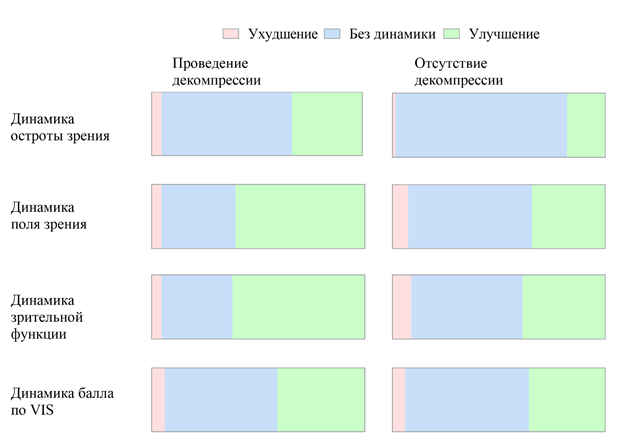
Рис. 7. Динамика остроты и поля зрения, балла по VIS и зрительной функции в зависимости от выполнения декомпрессии зрительного нерва.
Источник: составлено авторами на основе полученных в ходе исследования данных
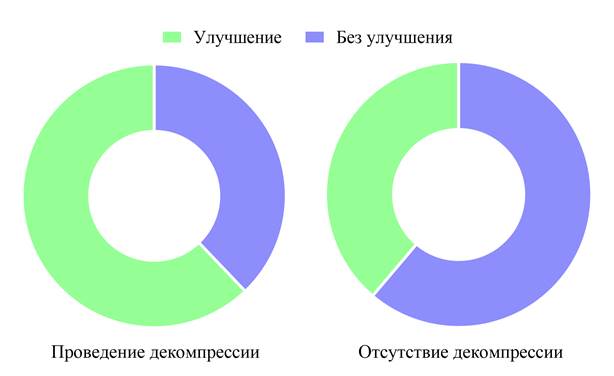
Рис. 8. Оценка итогового результата лечения в зависимости от проведения декомпрессии зрительного нерва.
Источник: составлено авторами на основе полученных в ходе исследования данных
Результаты корреляционного анализа представлены на рис. 9, 10 в виде тепловых карт. В общей выборке были выявлены слабая положительная связь между исходной остротой зрения и динамикой изменений поля зрения (r = 0,2, p = 0,019), динамикой зрительной функции (r = 0,22, p = 0,011) и умеренная положительная связь с результатом лечения (r = 0,25, p = 0,004), что свидетельствует о лучших исходах у пациентов с более высокой остротой зрения до операции. Остальные корреляции в общей выборке либо не значимы (p > 0,05), либо находятся на грани значимости (например, r = 0,16, p = 0,069 для степени снижения остроты зрения и динамики остроты зрения). В группе пациентов, прошедших декомпрессию, наблюдаются более сильные и многочисленные значимые корреляции: исходной остроты зрения с динамикой поля зрения (r = 0,53, p < 0,001 – умеренная положительная связь), с динамикой зрительной функции (r = 0,55, p < 0,001 – умеренная положительная связь), с результатом лечения (r = 0,6, p < 0,001 – сильная положительная связь); степени изменения поля зрения с динамикой поля зрения (r = -0,57, p < 0,001 – сильная отрицательная связь), с динамикой зрительной функции (r = -0,57, p < 0,001 – сильная отрицательная связь), с результатом лечения (r = -0,61, p < 0,001 – сильная отрицательная связь); балла по VIS с динамикой поля зрения (r = -0,48, p < 0,001 – умеренная отрицательная связь), с динамикой зрительной функции (r = -0,51, p < 0,001 – умеренная отрицательная связь), с результатом лечения (r = -0,52, p < 0,001 – умеренная отрицательная связь). Таким образом, в группе пациентов с выполнением декомпрессии отмечаются более сильные связи между исходным уровнем зрительных нарушений и результатами лечения. Большинство корреляций в группе пациентов без декомпрессии зрительного нерва не достигли статистической значимости (p > 0,05), что указывает на меньшую предсказуемость результатов лечения без осуществления декомпрессии. 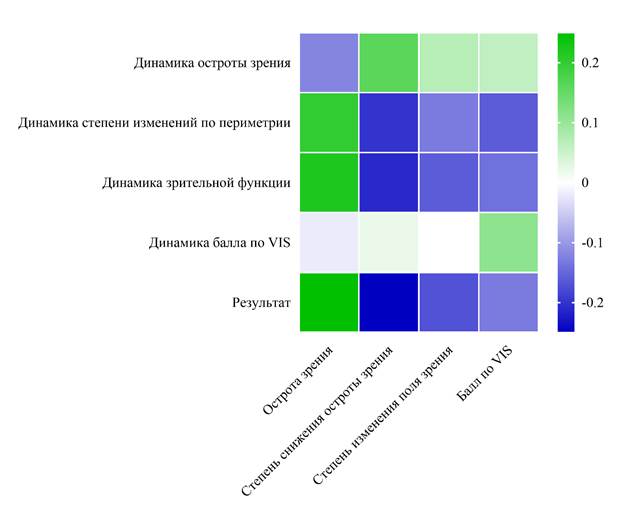
Рис. 9. Тепловая карта корреляций для всей выборки.
Источник: составлено авторами на основе полученных в ходе исследования данных
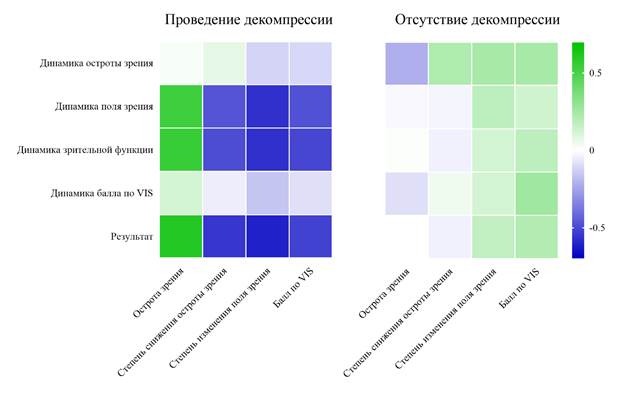
Рис. 10. Тепловые карты корреляций в зависимости от выполнения декомпрессии зрительного нерва.
Источник: составлено авторами на основе полученных в ходе исследования данных
В мировой литературе существует множество серий хирургического лечения больных с параселлярными менингиомами. В некоторых из них авторами делается акцент на выбор хирургического доступа (трансназальный или транскраниальный) [11, 12], в других – на факторы, влияющие на динамику зрительных нарушений [13]. Результаты хирургического лечения достаточно сильно различаются между исследованиями. Так, P. Mortini и соавт. в 2012 г. сообщали о 98 % положительных исходов [14], а G. Duangprasert в 2025 г. – лишь о 71,1 % улучшения зрения [10]. На взгляд авторов, причина этого кроется в различных системах оценки зрительных нарушений, так как в настоящее время не существует единой стандартизированной системы оценки нейроофтальмологической симптоматики. Так, в отечественной практике принято определять остроту зрения десятичной дробью (метод Головина – Сивцева), тогда как за рубежом, в частности в США, используется методика Снеллена, когда в числителе дроби всегда стоит число 20. Однако значение, получаемое при любой из этих методик, не равнозначно процентной эффективности зрения, так как является лишь отношением расстояния, с которого пациент видит символ на таблице для проверки зрения, к расстоянию, на котором этот символ видит человек со здоровым зрением. К примеру, острота зрения 20/40 или 0,5 практически не влияет на трудоспособность и соответствует приблизительно 84 % эффективности [15]. В связи с этим подход, используемый в ряде исследований, когда улучшение остроты зрения определяется при увеличении значения остроты зрения после операции на две и более строчек [11], видится авторам в корне неверным. Целесообразнее, по мнению авторов, использовать градации степени снижения остроты зрения, подобные используемым в классификации амблиопии, так как они различаются между собой на приблизительно одинаковый процент эффективности (около 20 %). Для суммарной оценки зрительных нарушений, включая остроту и поле зрения, разработаны несколько шкал. В 1982 г. немецкие офтальмологи Jaeger и Thomann предложили систему для определения профпригодности водителей [16]. По данной шкале в баллах от 0 до 100 оценивается суммарная зрительная функция, на основании остроты и поля зрения обоих глаз, причем 0 баллов соответствует идеальное зрение, 100 – слепота. Fahlbush в 2002 г. впервые использовал этот подход для оценки нарушения зрительных функций, в литературе закрепив его под названием visual impairment score (VIS) [8]. В 2019 г. секция хирургии основания черепа Европейской ассоциации нейрохирургов (EANS) рекомендовала использовать VIS для оценки зрительных нарушений у пациентов с менингиомами бугорка турецкого седла [7]. В клинической работе авторы использовали VIS с 2018 г. и при анализе динамики зрительных нарушений после удаления параселлярных менингиом выявили ряд недостатков этой шкалы. Например, пациент с менингиомой переднего наклоненного отростка, слепой на один глаз, и пациент с менингиомой бугорка турецкого седла, имеющий начальное снижение остроты зрения на обоих глазах и битемпоральную гемианопсию, имеют одинаковый балл по VIS, однако после операции первый пациент, скорее всего, останется слепым, а у второго возможно полное восстановление остроты и поля зрения. Кроме того, на вопрос, как интерпретировать динамику баллов VIS, в литературе однозначного ответа нет. Так, в 2023 г. Bove и соавт. определяли улучшение зрения у пациентов с менингиомами бугорка турецкого седла, если балл по VIS уменьшался на 5 и более, ухудшение – при увеличении балла на 5 и более [9], ссылаясь при этом на другое исследование, авторы которого эмпирически определили разницу в 5 баллов как клинически значимую [17]. Таким образом, на наш взгляд, VIS – это способ оценки уровня социальной дезадаптации пациента, обусловленной зрительными нарушениями, а не самих нарушений. Существуют также шкала оценки выраженности зрительных нарушений у пациентов с краниофарингиомами и другими образованиями хиазмально-селлярной области Кутина и Серовой (2016) и унифицированная шкала зрительной функции Makarenko (2018) [18, 19], однако принципиально они не отличаются от шкалы VIS. В связи с этим авторами была разработана и предложена система градации дефектов поля зрения, выявляемых при периметрии по Ферстеру. Данный подход базируется на динамике клинического течения зрительных нарушений у пациентов с параселлярными менингиомами. В дебюте заболевания, когда возникает сдавление зрительного нерва опухолью, первоначально пациент не отмечает ни ограничения поля зрения, ни снижения его остроты, однако начинает страдать контрастная чувствительность. При оценке поля зрения на красную метку будет обнаружено сужение его границ при нормальных границах на белый цвет. В дальнейшем присоединяется постепенное сужение периферических границ поля зрения на белую метку, появление центральных скотом, что чаще всего свидетельствует о развитии атрофии зрительного нерва и поражения папилломакулярного пучка. В данной серии выпадения поля зрения до точки фиксации, центральные скотомы размерами более 20º, концентрическое сужение границ вплоть до остаточного поля зрения при выпадении восприятия красного цвета, снижали вероятность улучшения зрения, тогда как менее выраженные изменения были ассоциированы с хорошими послеоперационными результатами.
При выборе методов нейровизуализации параселлярных менингиом преимущество отдается специальным режимам магнитно-резонансной томографии (CISS/ FIESTA, VIBE), которые позволяют оценить взаимоотношение опухоли с внутренними сонными, передними и средними мозговыми артериями, зрительными нервами и хиазмой, а также диагностировать инвазию опухоли в канал зрительного нерва [20, 21]. В настоящее время существуют две основные классификации инвазии канала зрительного нерва. В 2016 г. Nimmannitya и соавт. опубликовали результаты серии хирургического лечения 31 пациента с менингиомами бугорка турецкого седла [6]. Авторы анализировали инвазию канала зрительного нерва на основании предоперационной МРТ 1,5 и 3,0 Тл и интраоперационно. Были предложены следующие типы инвазии канала зрительного нерва при росте менингиом бугорка турецкого седла: отсутствие инвазии, вторичная инвазия – протрузия опухоли в канал без вовлечения его стенок; инвазия двух стенок – верхнемедиальная и нижнемедиальная; инвазия трех стенок (верхней, нижней и медиальной). Авторы отмечали, что у 96,8 % пациентов была выявлена инвазия хотя бы на одной стороне, причем самым частым типом была нижнемедиальная инвазия. При этом предоперационная МРТ позволила диагностировать инвазию лишь у 61 % пациентов. В 2018 г. Magill и соавт. сообщили о своем опыте удаления менингиом бугорка турецкого седла, предложив использовать для выбора хирургического доступа балльную шкалу, учитывающую инвазию канала зрительного нерва, вовлечение крупных сосудов и размеры опухоли [12]: 0 баллов присуждалось за инвазию одного канала протяженностью менее 3 мм, 1 балл за инвазию одного канала более 3 мм, 2 балла за двустороннюю инвазию. В своей работе авторы придерживались подхода Nimmannitya, несколько его модифицировав и использовав для всех параселлярных менингиом, так как, по мнению авторов, при выборе хирургической тактики важно понимать, как опухоль изменяет нормальную анатомию канала и нерва. По опыту авторов, при наличии вторичной инвазии, то есть в тех случаях, когда нет распространения матрикса опухоли в канал, интраканальный фрагмент опухоли можно удалить, не резецируя стенки канала. Напротив, инвазия стенок канала является прямым показанием к декомпрессии нерва, так как в таком случае безопасное удаление опухоли без риска ухудшения зрения после операции маловероятно. К аналогичным выводам пришли в своей работе М.А. Кутин и соавт. в 2020 г. [2].
Анализируя результаты, полученные в ходе исследования, авторы выявили ряд следующих закономерностей. Положительная динамика зрительных функций после хирургического лечения, включая улучшение остроты и поля зрения, а также балла по VIS, свидетельствует об эффективности хирургии в лечении пациентов с параселлярными менингиомами. В данном исследовании было доказано положительное влияние декомпрессии зрительного нерва на улучшение зрения после операции. Кроме того, эффективность выполнения декомпрессии напрямую зависела от выраженности зрительных нарушений, что говорит о высокой степени прогнозируемости ее результата.
Заключение
1. Хирургическое лечение эффективно в отношении улучшения зрения у пациентов с параселлярными менингиомами.
2. Декомпрессия зрительного нерва может и должна выполняться у пациентов с инвазией стенок канала зрительного нерва, так как это достоверно увеличивает вероятность улучшения зрения после операции.
3. Выраженность зрительных нарушений до операции непосредственно влияет на результат хирургического лечения.



