Введение
Хирургическая коррекция передней брюшной стенки имеет не только лечебное, но и важное эстетическое значение [1, 2]. К ежегодному увеличению количества выполняемой абдоминопластики приводят последствия беременностей и родов, массивная потеря веса, прием ряда медикаментов, старческий возраст, адинамия, предыдущие хирургические операции [3, 4].
Усилия врачей в последние годы направлены на получение оптимальных эстетических результатов при минимальной доле осложнений. Местные осложнения, как правило, связаны с широкой мобилизацией кожно-жирового лоскута, что обусловливает высокую вероятность его некроза и нагноения в послеоперационном периоде [5].
Наряду с ишемической природой данных осложнений по причине избыточной кожной мобилизации, высокой степени натяжения тканей, важную роль играет также наличие метаболических расстройств, вследствие нарушения углеводного и липидного обменов [6]. Частота осложнений хирургической коррекции передней брюшной стенки достигает 30,8 % и имеет прямую зависимость от степени ожирения [7].
Однако в настоящее время отсутствуют объективные критерии, позволяющие определить объем мобилизации кожно-жирового лоскута. Ключевую роль в решении данной задачи является оценка степени жизнеспособности кожи и подкожной клетчатки, которая может быть осуществлена с помощью люминесцентной спектроскопии [8].
Представленный метод диагностики основан на принципах аутолюминесценции – свечения, возникающего в результате биохимических реакций, сопровождающих процессы клеточной деструкции [9]. Суть метода заключается в детекции и анализе излучения, испускаемого специальными веществами – люминофорами, которые образуются в процессе клеточного повреждения [10].
В данном исследовании для регистрации и анализа люминесценции использовался метод лазерно-индуцированной ультрафиолетовой фотолюминесцентной спектроскопии, с применением прибора, представляющего собой источник лазерного излучения – эксимерный лазер (XeCl), высокочувствительный детектор люминесцентного сигнала, а также современную систему обработки и регистрации данных [11].
Интенсивность регистрируемого свечения или люминесценции непосредственно коррелирует со степенью ишемического повреждения клеток [12, 13]. Чем сильнее ишемия, тем интенсивнее свечение.
Цель исследования – оценка эффективности метода классической абдоминопластики под контролем люминесцентной спектроскопии.
Материалы и методы исследования
Всего в клиническом исследовании приняли участие 50 пациентов, оперированных в плановом порядке с 2020 по 2025 г., в хирургическом отделении № 2 Республиканской клинической больницы г. Нальчика. В проспективном, прямом, нерандомизированном исследовании участвовал 21 пациент. Пациентам выполнялась классическая абдоминопластика под контролем интраоперационной люминесцентной спектроскопии. Данные пациенты составили основную группу исследования. Вторая часть исследования заключалась в ретроспективном анализе результатов уже выполненной классической абдоминопластики традиционным способом, у пациентов, сопоставимых с представителями основной группы исследования по возрасту, полу, тяжести сопутствующей патологии, а также объему оперативного лечения. Данные пациенты составили вторую (контрольную) группу исследования (n = 29).
Средний возраст пациентов составил 51,9±4,6 лет. Мужчин было 10 (20 %), женщин – 40 (80 %). Срок наблюдения за пациентами составлял 3 месяца. Все пациенты в предоперационном периоде проходили стандартный перечень предоперационного обследования. Процедура измерения аутолюминесценции проводилась непосредственно во время операции. Специальный зонд – сдвоенное кварцевое волокно длиной 1 м с активным диаметром рабочей части 450 мкм, помещенное в стерильный рукав, позволяло регистрировать свечение в изучаемой зоне. Зонд располагался на расстоянии 1–2 см от поверхности кожного покрова передней брюшной стенки. Для индукции аутолюминесценции применялось импульсное излучение эксимерного лазера XeCl с длиной волны 308 нм в течение 3 мин. Дозировка лазерного излучения строго соответствовала действующим санитарным нормам, обеспечивая безопасность пациента.
Регистрация спектра люминесценции осуществлялась в диапазоне 350–780 нм с шагом 10 нм в течение 10 с. Это позволяет получить детальную информацию о спектральном составе излучения, что является ключевым для диагностики. Определение глубины диссекции проводилось интраоперационно с помощью иглы, соединенной с зондом. Игла послойно вводилась в подкожную клетчатку, позволяя точно установить границу пересечения кожно-жирового лоскута. По данным литературы выяснено, что появление участков некроза в гистологическом материале наблюдалось при интенсивности свечения люминесценции, не превышающем 0,95 ± 0,15 × 10⁵ фотон на частоте 410 нм [14]. Этот показатель был взят за ориентир при определении демаркационной линии между жизнеспособной тканью и некротической, по нему устанавливалась линия пересечения лоскута (рис. 1).
В случае наличия жировых депозитов в проблемных зонах, при выполнении оперативного лечения в основной группе, дополнительно выполнялась липосакция.
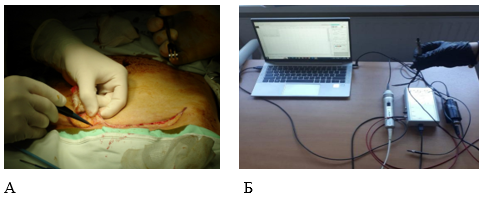
Рис. 1. Интраоперационная люминесцентная спектроскопия (А – измерение люминесценции выкраиваемого кожно-жирового лоскута, Б – общий вид установки для люминесцентной спектроскопии).
Источник: составлено авторами на основе полученных данных в ходе исследования
Регистрация люминесценции проводилась после подписания пациентами письменного добровольного информированного согласия на диагностическое исследование в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации (2004). Работа одобрена локальным этическим комитетом Кабардино-Балкарского университета им Х.М. Бербекова № 2 от 30.01.2020.
В послеоперационном периоде фиксировалось количество гнойных осложнений, площадь гнойных ран определялась с применением плантаметрического метода [15]. Для проведения измерений на раневую поверхность накладывали стерильную полиэтиленовую пленку и прослеживали через нее контур раны. Затем полученное изображение раны накладывали на миллиметровый лист бумаги и вычисляли миллиметры, заключенные в границах контура. Кроме того, определялось количество отделяемого по дренажам, а также учитывались сроки их удаления.
Для статистической обработки данных при сравнении групп исследования было использовано программное обеспечение SPSS Statistics 17.0. Результаты исследования были разнесены по шкале среднеарифметических значений (mean) ± стандартное отклонение (SD). Различия средних значений (p) в основных показателях послеоперационного периода оценивали с применением парного t-критерия Стьюдента, который считали достоверным при р < 0,05.
Результаты исследования и их обсуждение
При оценке раннего послеоперационного периода необходимо отметить, что технический успех операции наблюдался во всех изучаемых случаях в обеих группах исследования. Интраоперационных осложнений отмечено не было.
Площадь мобилизованного кожно-жирового лоскута в основной группе, сформированная под контролем люминесцентной спектроскопии, была статистически значимо меньше, чем в группе контроля. Перед иссечением избыточной кожи она составила в основной группе 456,6±12,8 см2, а в группе контроля – 617,6±13,8 см2; при р = 0,001.
Повышения лейкоцитов и СРБ до 5 суток в основной группе не отмечалось. На 5-е сутки у 7 (24,1 %) пациентов из группы контроля и у 5 (23,8 %) пациентов из основной группы отмечено развитие гипертермии, которая коррелировала с гиперлейкоцитозом и повышением уровня С-реактивного белка (СРБ). Остальные пациенты (22 из контрольной группы и 16 из основной группы) были выписаны из стационара в среднем через 4,33±1,1 день в удовлетворительном состоянии, без осложнений.
Уровень лейкоцитоза с 5-х суток у лихорадящих пациентов в основной группе был достоверно ниже, чем в группе контроля (5-е сутки исследования: основная группа – 14,5±1,8 х109/л, контрольная – 18,8±1,4 х109/л; при р = 0,043). Аналогичные данные получены при сопоставлении С-реактивного белка на 5-е сутки исследования (основная – 223,4±5,8 ЕД/л, контроль – 365,8±11,7 ЕД/л; при р = 0,015). Динамика данных показателей в дальнейшем сохраняет статистически значимую разницу (табл. 1).
Таблица 1
Динамика изменения маркеров воспалительной реакции в группах исследования
|
Показатель |
|
6 сутки |
8 сутки |
10 сутки |
12 сутки |
14 сутки |
|
Лейкоциты крови, г/л |
Основная |
13,2±1,2 |
11,8±1,9 |
12,2±1,5 |
9,8±1,9 |
7,6±1,4 |
|
Контроль |
19,2±1,1* |
18,3±1,2* |
20,1±3,5* |
17,1±1,8* |
15,8±3,3* |
|
|
СРБ, Е/л |
Основная |
244,2±8,8 |
213,4±10,7 |
189,2±6,1 |
109,2±5,4 |
87,2±5,7 |
|
Контроль |
369,4±7,8* |
333,4±5,7* |
290,5±8,8* |
296,4±7,4* |
190,4±5,8* |
Источник: составлено авторами на основе полученных данных в ходе исследования.
На перевязке на 5-е сутки наблюдения у 7 (24,1 %) лихорадящих пациентов в контрольной группе и у 4 (19,0 %) в основной отмечено нагноение послеоперационной раны. У оставшегося пациента в основной группе с лихорадкой в первые 5 суток исследования, гнойных осложнений не отмечалось. Гипертермия у него была связана с реакцией на сетчатый имплант. На фоне проведения антибактериальной терапии (цефтриаксон (натриевая соль) 1,0 внутримышечно 1 раз в сутки) к 7-м суткам лихорадка купирована. У остальных пациентов гнойных осложнений в процессе госпитализации в группах исследования не отмечалось.
У 6 (20,7 %) пациентов контрольной группы нагноение раны сопровождалось краевым некрозом лоскута. В основной группе таких осложнений отмечено не было.
Средняя площадь гнойной раны у 4 (19,0 %) респондентов основной и у 6 (20,7 %) респондентов контрольной групп на 5-е сутки исследования была сопоставима и составила по данным планиметрического исследования в основной группе 17,2±1,1 см2, в контрольной – 18,7±1,5 см2, при р = 0,554. В дальнейшем увеличения площади гнойной раны в основной группе отмечено не было. В результате ежедневных перевязок с санацией гнойной полости к 14 суткам послеоперационного периода отмечено полное заживление послеоперационной раны вторичным натяжением у всех пациентов основной группы (табл. 2).
Таблица 2
Скорость заживления гнойных ран в группах исследования
|
Группы |
6 сутки, см2 |
7 сутки, см2 |
8 сутки, см2 |
9 сутки, см2 |
10 сутки, см2 |
11 сутки, см2 |
12 сутки, см2 |
13 сутки, см2 |
14 сутки |
|
Основная (n = 4) |
16,2±1,2 |
15,8±2,3 |
12,2±3,1 |
10,4±2,4 |
8,9±3,1 |
6,8±2,3 |
3,9±3,9 |
2,8±1,1 |
Вторичные швы |
|
Контрольная (n = 6) |
45,4 ±3,4* |
38,6 ±7,8* |
35,8 ±4,1* |
32,3 ±4,3* |
29,0 ±4,9* |
21,8 ±3,9* |
17,8 ±3,6* |
15,1 ±1,1* |
11,5 ±6,8* |
Примечание. * – различия в группах статистически значимы, р < 0,05.
Источник: составлено авторами на основе полученных данных в ходе исследования.
В группе контроля местное лечение гнойных осложнений было достаточно трудным. Сложности были обусловлены продолжающимся краевым некрозом кожного лоскута. Выполнение этапных некрэктомий в контрольной группе сопровождалось некоторым увеличением лейкоцитоза и субфебрилитетом (10-е сутки исследования, табл. 1). У 1 (3,4 %) пациента контрольной группы отмечался некроз с распространением по всей ширине раны, с захватом подкожно-жировой клетчатки. Первоначальная площадь раны у данного пациента статистически значимо была больше, чем у остальных участников исследования, составляя на 7-е сутки – 98,6±7,8 см2, а на 14-е сутки – уже 187,5±6,8 см2 (рис. 2).
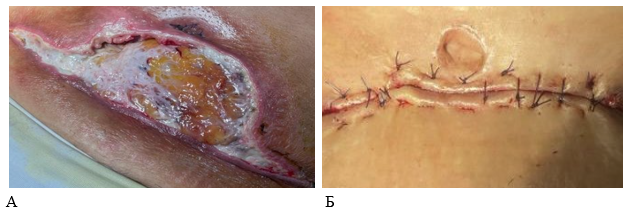
Рис. 2. Состояние послеоперационной раны у пациентов в группах сравнения на 14-е сутки (А – контрольная группа, Б – основная, перед снятием швов).
Источник: составлено авторами на основе полученных данных в ходе исследования
Увеличение площади раны в контрольной группе было обусловлено этапными некрэктомиями. В таких условиях требовались длительные перевязки сначала в стационаре, а затем в поликлинике. Заживление кожной раны вторичным натяжением у пациентов с гнойными осложнениями в группе контроля в среднем происходило 57,5±2,8 дней.
В основной группе его мобилизация проводилась под люминесцентным контролем, в связи с чем часть подкожно-жировой клетчатки оставалась на апоневрозе. При оценке объема лимфореи в раннем послеоперационном периоде в группах исследования отмечаются статистически значимые различия. Например, на 3-и сутки объем отделяемого по дренажу в основной группе составил 214,8±15,8 мл, а в группе контроля – 389,4±21,4 мл; при р = 0,025) (табл. 3).
Таблица 3
Количество серозного отделяемого по дренажам в раннем послеоперационном периоде, мл
|
|
2-е сутки |
4-е сутки |
6-е сутки |
8-е сутки |
|
Основная группа |
145,2±20,8 |
226,8±11,8 |
140,9±11,8 |
71,1±10,2 |
|
Контрольная группа |
159,2±21,4 |
382,4±17,4* |
302,2±10,2* |
182,2±15,1* |
Примечание. * – различия статистически значимы (р < 0,05).
Источник: составлено авторами на основе полученных данных в ходе исследования.
Кроме того, различались сроки удаления дренажей Редона. В группе контроля удаление дренажей осуществлялось через 10,5±1,3 дней, а в основной группе – через 7,5±1,1 дня; при р = 0,017. Таким образом, в контрольной группе они удалялись позже.
При дальнейшем наблюдении у 3 (14,3 %) пациентов из основной группы и у 6 (20,7 %) – из контрольной были зафиксированы повторные госпитализации по причине гнойных осложнений. Причиной всех осложнений явилась нагноившаяся серома подкожной клетчатки. Пациентам выполнено дренирование подкожной клетчатки под ультразвуковым наведением. В послеоперационном периоде проводилось промывание гнойных полостей и антибактериальная терапия препаратами широкого спектра действия. Во всех случаях отмечено выздоровление пациентов. Важно отметить, что у данных пациентов в раннем послеоперационном периоде, в процессе стационарного лечения осложнений не отмечалось.
Проведенное исследование доказало целесообразность использования люминесцентной спектроскопии кожно-жирового лоскута при абдоминопластике. Данный метод, в основе которого лежит оценка динамики изменений интенсивности люминесцентного свечения и его спектральных характеристик при ишемизации тканей, позволил дать объективные критерии выбора ширины и глубины выкраиваемого кожно-жирового лоскута.
В результате выполнения абдоминопластики под контролем люминесцентной спектроскопии удалось добиться оптимального эстетического результата при сохранении жизнеспособности тканей. Учитывая отсутствие случаев краевых некрозов кожно-жирового лоскута в основной группе, данный метод диагностики явился достаточно точным, что позволило безошибочно определить достаточную ширину сепарации и границу отсечения кожно-жирового фартука без нарушения его кровоснабжения.
Важно подчеркнуть, что полученные результаты лечения пациентов в основной группе сопровождались статистически значимым снижением количества осложнений и объема лимфореи при выполнении абдоминопластики под контролем люминесцентной спектроскопии. При этом, в отличие от пациентов контрольной группы, при нагноении отсутствовала необходимость выполнения им многократных некрэктомий. В данной группе в результате распространения некроза кожи и подкожной клетчатки отмечалась постоянное увеличение площади раны и снижение процессов ее регенерации в динамике исследования
Заключение
Таким образом, использование интраоперационной люминесцентной спектроскопии при выполнении классической абдоминопластики без особых усилий позволяет уточнить ее объем и снизить количество послеоперационных осложнений, связанных с избыточной мобилизацией кожно-жирового фартука и его ишемизацией.



