Введение
Метастатический колоректальный рак (КРР) представляет собой летальное заболевание с пятилетней выживаемостью, составляющей 14% [1]. В свою очередь метастатическое поражение составляет около 50–60% всех случаев КРР [2]. В клинической практике для химиотерапии метастатического КРР (мКРР) используются такие препараты, как 5-фторурацил (5-FU), капецитабин, иринотекан и оксалиплатин, а также фолиновая кислота, которая действует синергично с 5-FU. Эти препараты демонстрируют высокую эффективность, тем не менее сопряженную с высокой токсичностью в отношении здоровых клеток. Помимо этого, опухолевые клетки развивают устойчивость к химиотерапевтическим препаратам [3].
В процессе метастазирования можно выделить такие этапы, как миграция опухолевых клеток, их инвазия, интравазация и экстравазация. Миграция и инвазия опухолевых клеток становятся возможными благодаря приобретению ими подвижности, ослаблению межклеточной адгезии, полимеризации актина на ведущем крае клетки и процессу эпителиально-мезенхимального перехода (ЭМП) клеток [4; 5]. Терапия, нацеленная на угнетение подвижности опухолевых клеток, может предотвратить или затормозить процесс метастазирования, не оказывая (или оказывая минимальное) системного токсического действия [6]. Мишенями для веществ, влияющих на подвижность опухолевых клеток, могут быть молекулы клеточной адгезии, факторы роста и их рецепторы, процесс полимеризации актина и сокращения актомиозина, различные этапы ЭМП [7-9].
Перспективной областью исследований, направленных на поиск новых веществ с антиметастатической активностью, являются вторичные метаболиты растений (ВМР). Среди ВМР можно выделить такую группу соединений, как алкалоиды, которые представлены гетероциклическими азотсодержащими соединениями, характеризующимися большим структурным разнообразием [10]. В настоящее время уже существуют противоопухолевые препараты на основе алкалоидных соединений, одобренные FDA: винбластин и камптотецин [11]. Тем не менее поиск других алкалоидов, обладающих противоопухолевыми свойствами, продолжается. К настоящему времени было изучено значительное количество соединений in vitro и in vivo, а также выявлены основные механизмы действия алкалоидов на клетки различных типов рака, в том числе – подавление миграции и инвазии опухолевых клеток [12]. Были также выявлены антимиграционные свойства некоторых алкалоидов в отношении клеточных линий КРР [13]. В исследовании, посвященном изучению противоопухолевых свойств ВМР, выделенных из белокопытника гибридного (Petasites hybridus (L.) G.Gaertn., B.Mey. & Scherb.), авторами ранее была обнаружена способность нового индольного алкалоида подавлять подвижность клеток иммортализованной клеточной линии рака кожи А431 [14].
Цель исследования: изучить влияние нового алкалоида, выделенного из белокопытника гибридного, на подвижность клеток иммортализованных клеточных линий КРР.
Материалы и методы исследования
Клетки линий НТ-29, НСТ 116 и Сасо-2 выращивали на флаконах Т75 (Thermo Fisher Scientific, США) в 10 мл полной питательной среды (ППС) на основе среды DMEM c конечным содержанием FBS 10% (для Сасо-2 – 20% FBS) (БиоЛот, Россия), L-глутамина 1% (Thermo Fisher Scientific, США), неосновных аминокислот 1% («БиоЛот», Россия), пенициллина-стрептомицина 1% («БиоЛот», Россия) в СО2 инкубаторе при 37 °С с 5% содержанием СО2.
Алкалоид выделяли из растений белокопытника гибридного Petasites hybridus (L.) G.Gaertn., B.Mey. & Scherb по методике, описанной авторами ранее [15]. Тестируемому веществу было присвоено рабочее название «Р1».
Предварительный опыт для определения концентраций алкалоида, не оказывающих цитостатического и цитотоксического действия на клетки культур КРР, проводили следующим образом. Клетки линий НТ-29, НСТ 116 и Сасо-2 высевали в 96-луночные планшеты в количестве 5 тыс. клеток/лунку в 100 мкл ППС. После адгезии клеток ко дну лунок планшета среду культивирования заменяли на ППС с добавлением тестируемого соединения в серии двукратных разведений от 44 до 0,34 мкмоль/л. Клетки с тестируемым веществом инкубировали в течение 24 часов в СО2 инкубаторе, затем вносили 10 мкл/лунку смеси ядерных красителей Hoechst 33342 (1 мг/мл) (ThermoFisher, США) и этидия бромида (10 мг/мл) (Servicebio, Китай). Визуализацию результатов окрашивания осуществляли с помощью автоматизированного имиджера LionheartFX (BioTek, США), подсчет количества живых и мертвых клеток проводили с использованием программного обеспечения Gen5. Жизнеспособность клеток рассчитывали как отношение числа живых клеток в опыте с добавлением тестируемого соединения к количеству живых клеток в контроле, выраженное в процентах. Для каждого варианта опыта было заложено по 8 повторов, эксперимент повторяли трижды.
Для теста на зарастание дефекта монослоя клетки линий НТ-29, НСТ 116 и Сасо-2 высевали в 24-луночные планшеты в количестве 50 тыс. клеток/лунку в 1 мл ППС. Клетки инкубировали в СО2 инкубаторе при 37°С с 5% содержанием СО2 до достижения 80% конфлюэнтности, затем наносили вертикальный дефект на монослой клеток стерильным наконечником объемом 200 мкл. После нанесения дефекта производили замену среды культивирования: в контрольных лунках – на ППС, в опытных – на ППС с концентрациями алкалоида, подобранными на основании результатов предварительного опыта. Всего было заложено по 12 повторов для каждого варианта опыта. Опыт повторяли трижды.
Для статистической обработки данных использовали программное обеспечение Microsoft Excel. Нормальность распределения выборки проверяли с использованием критерия Шапиро-Уилка. Статистическую значимость различий проверяли при помощи t-критерия Стьюдента. Значения параметра степени зарастания дефекта монослоя приведены как среднее значение±стандартное отклонение.
Результаты исследования и их обсуждение
По результатам предварительного опыта было установлено, что концентрации тестируемого алкалоида Р1 ниже 11 мкмоль/л не оказывают значимого влияния на жизнеспособность клеток исследуемых клеточных линий КРР (данные не приведены), поэтому данные концентрации были использованы для основного эксперимента.
В результате основного эксперимента было установлено, что клетки исследуемых линий КРР обладают различной подвижностью. Наиболее подвижными были клетки линии НТ-29 (степень зарастания дефекта в контроле равна 70,2±18%), а наименее подвижными – НСТ 116 (20,45±8,4%). Промежуточным уровнем подвижности обладали клетки линии Сасо-2 (58,68±12,8%) (рис.).
Добавление Р1 оказало ингибирующее влияние на подвижность клеток только в культуре НТ-29. Инкубирование в присутствии Р1 в концентрации 11 мкмоль/л вызвало статистически значимое снижение степени зарастания дефекта монослоя с 70,2±18% в контроле до 56,87±12,2% в опыте (t=2.21, df=70) (рис.). При добавлении тестируемого алкалоида в концентрации 5,5 мкмоль/л в культуре НТ-29 наблюдалось снижение значения степени зарастания дефекта монослоя до 59,13±12,2%, однако разница со значением данного параметра в контроле оказалась статистически не значимой (t=1,81, df=70). Концентрация Р1 2,75 мкмоль/л уже не вызывала заметного снижения подвижности клеток культуры НТ-29 (степень зарастания дефекта равна 75,67±6,5%).
Несмотря на то, что в культуре Сасо-2 при добавлении тестируемого алкалоида в концентрации 11 мкмоль/л также наблюдалось снижение показателя степени зарастания дефекта монослоя с 58,68±12,8% в контроле до 49,7±14,9% в опыте, разница была статистически не значимой (t=1.58, df=70). При более низких концентрациях Р1 снижения степени зарастания дефекта монослоя по сравнению с контролем в культуре Сасо-2 не наблюдалось (61,42±9,2% при 5,5 мкмоль/л и 56,0±14,8% при 2,75 мкмоль/л).
Наконец, в культуре НСТ 116 не было зафиксировано статистически значимых изменений в степени зарастания дефекта монослоя под действием Р1 в сравнении с контролем.
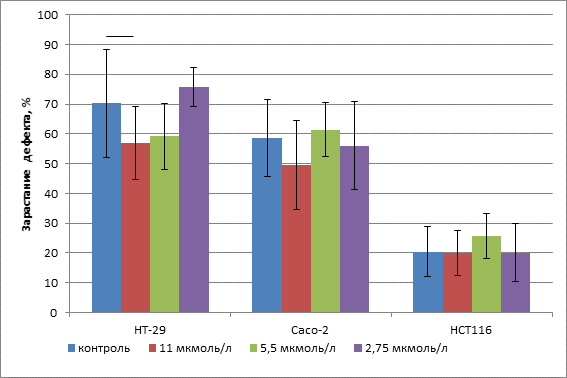
Влияние алкалоида Р1 на подвижность клеток иммортализованных клеточных линий КРР. Составлено авторами по результатам данного исследования.
* - разница статистически значима, р<0,05.
В литературе на данный момент описаны различные алкалоиды, которые проявляют цитотоксическую и антимиграционную активность в отношении клеток КРР путем воздействия на различные сигнальные пути. Наиболее изученным алкалоидом, проявляющим такие свойства, является берберин. Существуют данные, подтверждающие его антимиграционную активность в отношении клеточных линий SW480, SW-620, НСТ-8, HCT 116, LoVo, HT-29. В исследовании Park J.J. и соавторов было выявлено, что берберин вызывает снижение уровня интегрина β1 и фосфорилированных Src, FAK и p130Cas через активацию АМФ-киназы в клетках линий SW-620 и HCT116 [16]. Liu X. с соавторами провели исследование, в результате которого было показано, что берберин снижает уровни экспрессии COX-2/PGE2, что приводит к подавлению активации сигнального пути JAK2/STAT3 и, как следствие, к снижению уровня экспрессии целевых генов MMП-2 и ММП-9, результатом чего является сниженная способность клеток линий SW-620 и LoVo к инвазии и миграции [17]. В результате экспериментов Liu Y. с соавторами было обнаружено, что берберин повышает уровень экспрессии PLZF, что приводит к убиквитинированию SCAP, результатом чего является снижение интенсивности липогенеза и, как следствие, миграционной и инвазивной способности клеток линии НСТ-8 [13]. Ni L. с соавторами при помощи биоинформатических методов выявили, что берберин может значительно ингибировать экспрессию гена-концентратора HEY2, что связано с подавлением миграционной способности клеток КРР [18].
Помимо берберина, были изучены противоопухолевые и антимиграционные свойства таких алкалоидов, как EHLJ7 (производное коптизина), цикловиробуксин D (CVB-D), софокарпин, фанхинолин, винорелбин. B работе Jiang F. и соавторов противоопухолевый эффект цикловиробуксина D, а также снижение подвижности клеток линий DLD-1 и LoVo, были достигнуты преимущественно за счет ингибирования сигнального пути CTHRC1-AKT/ERK-Snail [19]. В исследовании Chai С. и соавторов было установлено, что четвертичное производное алкалоида растительного происхождения коптизина EHLJ7 снижает миграционную способность и приводит к апоптозу клеток линии HCT 116 через ингибирование сигнального пути PI3K/AKT [20]. Алкалоид софокарпин продемонстрировал антимиграционное действие в отношении клеток линий HCT 116 и SW-620, опосредованное ингибированием сигнального пути MEK/ERK/VEGF [21]. Jung Y.Y. с соавторами выявили, что алкалоид фанхинолин через ингибирование сигнальных путей c-Met/PI3K/Akt/mTOR и Wnt/β-катенин способствовал снижению миграционной и инвазивной способности клеток линий HCT 116 и SNU-1040 [22]. В работе Liu H. и соавторов было показано, что винорелбин – полусинтетический алкалоид – оказывает влияние на процесс ЭМП путем регуляции экспрессии E-кадгерина, N-кадгерина, виментина и факторов транскрипции Snail, ММП-2 и ММП-9 в клетках линии НСТ 116 [23]. Стоит отметить, что винорелбин в сочетании с другими препаратами в клинических испытаниях показал свою эффективность в отношении метастатических видов рака слюнной железы (винорелбин в сочетании с цисплатином) [24], молочной железы (винорелбин в сочетании с капецитабином) [25].
Таким образом, полученные результаты подтверждают, что новый алкалоид способен подавлять подвижность клеток некоторых культур КРР. Однако ввиду сложности процесса миграции клеток, включающего в себя работу различных молекулярных механизмов, а также структурного разнообразия алкалоидных соединений и множества механизмов их противоопухолевого и антимиграционного действия, без проведения дополнительных исследований невозможно однозначно утверждать, каким именно образом алкалоид Р1 подавляет подвижность клеток линии НТ-29.
Заключение
Новый алкалоид Р1 снижает подвижность клеток линии НТ-29. В рамках проведенного авторами исследования невозможно сделать вывод о механизме действия Р1, в связи с чем требуется дальнейшее его изучение с применением более широкого арсенала молекулярно-генетических и биоинформатических методов.



