Введение
Ожирение является сложным многофакторным заболеванием. Распространённость избыточной массы тела и ожирения за последние десятилетия удвоилась и охватывает в настоящее время почти треть населения мира. Независимо от географического местоположения, этнической принадлежности и социально-экономического статуса показатели распространённости ожирения увеличились как среди лиц женского, так и мужского пола во всех возрастных группах [1].
Ожирение является пятым по значимости фактором риска смертности в мире. Многочисленные исследования показали, что ожирение тесно связано с различными хроническими заболеваниями, а именно с сахарным диабетом 2 типа, сердечно-сосудистыми заболеваниями, злокачественными новообразованиями. Ожирение в детском возрасте способствует развитию тревожности и депрессивных состояний [2].
Одним из основных факторов, влияющих на развитие детского ожирения, является роль родителей в формировании образа жизни и обеспечении правильного питания, особенно в первые годы жизни (до 5 лет). Именно установившиеся в детстве неправильные пищевые привычки, в частности употребление высококалорийных продуктов питания, в дальнейшем способствуют развитию ожирения [3].
Наиболее распространённой программой по снижению массы тела стали диеты и физические нагрузки, однако ни одна из этих программ до сих пор в полной мере не доказала свою эффективность.
Общепризнано, что ожирение возникает в результате стабильного положительного энергетического баланса, когда потребление энергии с пищей превышает энергетические потери. Избыточная энергия используется в синтезе триглицеридов, которые, накапливаясь в клетках жировой ткани, увеличивают жировые отложения, потенцируя нарастание массы тела. В настоящее время пищевая индустрия производит высококалорийные, более переработанные и доступные по цене продукты питания с низким содержанием натуральных питательных веществ, что и является основной движущей силой эпидемии ожирения [Ошибка! Источник ссылки не найден.].
Известно также, что гипоталамус, расположенный в основании мозга, играет одну из ключевых ролей в контроле потребления пищи. Вентромедиальный отдел гипоталамуса ответственен за сытость и подавление чувства голода, тогда как латеральный гипоталамус связан с увеличением потребления пищи. Гормон лептин, вырабатываемый адипоцитами, регулирует потребление пищи с помощью нервных цепей через рецепторы (Lep-R), в основном расположенные в гипоталамических нейронах. Рецепторы к грелину, известные как рецепторы секреторного гормона роста (GHS-R), находятся в мембранах переднего гипофиза [4]. Следует отметить, что у людей с ожирением и у пациентов после бариатрической операции обнаружены низкие уровни грелина [Ошибка! Источник ссылки не найден.]. Установлено, что уровень грелина положительно коррелирует с сывороточными маркерами воспаления у пациентов с активными воспалительными заболеваниями кишечника [5]. При этом значительное влияние на обмен веществ, включая выработку гормонов, таких как глюкагоноподобный пептид (GLP-1) и пептид YY (PYY), оказывает микробиота кишечника. Эти гормоны играют ключевую роль в регуляции аппетита, секреции инсулина и чувствительности к лептину [8]. В частности, нормализация уровня Bifidobacterium spp. в желудочно-кишечном тракте ассоциируется с положительными изменениями в метаболических процессах. Увеличение их численности может стимулировать секрецию GLP-1 и PYY, которые, в свою очередь, помогают снизить риск развития инсулинорезистентности [9].
Изучение роли микробиоты в обмене лептина и грелина начато относительно недавно, в ходе проведенных исследований получены неоднозначные результаты, что делает настоящее исследование актуальным.
Цель исследования
Уточнить влияние высокожировой диеты на обмен грелина и лептина, а также уровень рецепторов к ним в жировой ткани и головном мозге у лабораторных животных, в том числе в условиях проведения синбиотической коррекции.
Материал и методы исследования
Исследование выполнено на базе кафедры патологической физиологии и кафедры детских болезней ФГБОУ ВО «БГМУ» Минздрава России. Экспериментальные животные содержались в виварии с достаточным дневным освещением, вентиляцией, оптимальной температурой (до 24 °С) и влажностью 50-55%. Для каждой экспериментальной группы использовались клетки из полипропилена размером 460х300х160 мм.
Эксперимент проводился на половозрелых крысах линии Wistar (n=44) обоих полов весом 250-300 г и их потомстве от рождения до 7-недельного возраста весом 45-58 г. В контрольную группу вошли крысята, рождённые от матерей, получавших физиологическое сбалансированное питание. Соотношение макронутриентов: белки - 23,3%, жиры - 11,6%, углеводы - 65,1%, соответствовало разработанным нормам [10]. После рождения эти крысята также находились вначале на лактотрофном питании, а в последующем - на сбалансированном питании взрослого типа.
В питание беременных самок было включено свиное сало (51% суточного калоража) в соответствии с рекомендациями по моделированию высокожировой диеты [10]. После рождения потомство отделяли от матерей, при этом сохраняли те же экспериментальные условия перекорма жирами. В возрасте 5 недель животные были разделены на две подгруппы. В основную группу вошли крысята, находившиеся на исключительно высокожировом типе питания. В группу сравнения включены крысята с аналогичным типом диеты, но дополнительно получавшие синбиотик «Нормобакт» (ОАО «Акрихин», Россия), содержащий штаммы Lactobacillus acidophilus LA-5 и Bifidobacterium BB-12 вместе с фруктоолигосахаридами в соотношении 1:1. Препарат вводился один раз в день в течение 14 дней с помощью зонда, дозировка рассчитывалась в зависимости от массы животного.
В возрасте 7 недель все крысята выводились из эксперимента путём декапитации под эфирным наркозом, проводился забор крови, жировой ткани и материалов головного мозга с последующей центрифугацией. Эксперименты над животными осуществлялись в соответствии с Директивой Европейского парламента и Совета Европейского союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, использующихся для научных целей, а также с Федеральным законом от 27.12.2018 № 498-ФЗ (ред. от 27.12.2019) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации».
Биохимический анализ плазмы крови, включавший основные параметры жирового и углеводного обмена, выполнялся на автоматическом анализаторе СА-400 (FURUNO ELECTRIC CO., LTD, Япония) с использованием диагностических наборов от DiaSys Diagnostic Systems GMBH (Германия). Содержание грелина в плазме определяли методом конкурентного иммуноферментного анализа с набором ELISA для крыс, а уровень лептина - с помощью сэндвич-метода иммуноферментного анализа с использованием набора для лептина от Cloud-Clone Corp. (Китай). Подготовка тканей для анализа проводилась с помощью гомогенизации и ультразвуковой обработки (Bioruptor UCD-200, Diagenode, США), а затем центрифугирования при 10 000 g и 5ºС. Уровень рецепторов к грелину (GHS-R) и лептину (LEPR) в мозговом веществе и жировой ткани измеряли с помощью наборов SEC516Ra и SEA083Ra для крыс (Cloud-Clone Corp., Китай). Фотометрическое измерение осуществлялось с использованием многоканального микропланшетного ридера (Tecan infinite f50, Австрия). Отбор животных для эксперимента, методы исследования и протоколы вывода животных из эксперимента были одобрены локальным этическим комитетом ФГБОУ ВО «БГМУ» МЗ РФ (протокол № 5 от 22.05.2019 г.). Статистический анализ данных проводился с помощью программы Statistica 6.0, достоверность межгрупповых различий оценивалась с использованием U-критерия Манна-Уитни, также проводился корреляционный анализ по Пирсону. Различия считались статистически значимыми при уровне значимости р<0,05.
Результаты исследования и их обсуждение
Использование рациона с высоким содержанием жиров животного происхождения привело к значительным изменениям в биохимических показателях плазмы крови лабораторных крыс по сравнению с контрольной группой. Установлено статистически значимое повышение содержания глюкозы, АЛТ, холестерина, триглицеридов, ЛПНП и снижение уровня Апо-А1, ЛПВП (табл.).
Наиболее значимые биохимические показатели плазмы крови крыс с исключительно высокожировым типом питания и с высокожировым типом питания, корригированным синбиотиком, Me [25; 75]
|
Показатель |
Контрольная группа |
Основная группа (высокожи-ровой тип питания) |
Группа сравнения (высокожировой тип питания + синбиотик) |
Р1 |
Р2 |
P3 |
|
Глюкоза, ммоль/л |
6,99 [6,70; 7,10] |
10,05 [8,80; 10,70] |
6,90 [6,80; 7,20] |
0,0003 |
0,0004 |
0,7623 |
|
АЛТ, Ед/л |
47,50 [45,0; 50,0] |
52,50 [50,0; 56,0] |
50,50 [49,00- 54,00] |
0,0065 |
0,2413 |
0,1212 |
|
Холестерин, ммоль/л |
1,75 [1,60-2,10] |
2,40 [2,30-2,50] |
2,39 [2,30-2,50] |
0,0002 |
0,8798 |
0,0002 |
|
Триглицериды, ммоль/л |
0,955 [0,920-0,970] |
1,175 [1,050-1,250] |
1,025 [1,000-1,100] |
0,0001 |
0,0450 |
0,0001 |
|
Апо-А1-протеин |
0,045 [0,04-0,05] |
0,03 [0,01-0,03] |
0,05 [0,04-0,05] |
0,0376 |
0,0211 |
0,6231 |
|
ХС ЛПВП, ммоль/л |
1,01 [1,01-1,040] |
0,880 [0,760-0,930] |
0,97 [0,82 – 0,99] |
0,0001 |
0,0451 |
0,0002 |
|
ХС ЛПНП, ммоль/л |
0,665 [0,66-0,67] |
0,73 [0,69-0,98] |
0,65 [0,60-0,67] |
0,0004 |
0,0013 |
0,7054 |
|
Примечание: *Р1 - статистическая значимость различий «контрольная группа – основная группа»; **P2 – статистическая значимость различий «основная группа - группа сравнения»; ***P3 – статистическая значимость различий «контрольная группа - группа сравнения». |
||||||
Источник: составлено авторами.
У крыс, получавших пищевую нагрузку жирами в сочетании с синбиотической коррекцией, также подтверждено повышение показателей холестерина, триглицеридов, АЛТ и снижение уровня ЛПВП (р ≤ 0,005). При этом уровень глюкозы, ЛПНП и Апо-А1-протеина оставались в пределах нормы (р ≤ 0,005).
Интересные данные получены при изучении обмена грелина и лептина у лабораторных животных. При высокожировом типе питания у крыс препубертатного возраста зафиксированы изменения уровней этих гормонов в плазме крови, а также плотности рецепторов к ним в головном мозге и жировой ткани (рис.).
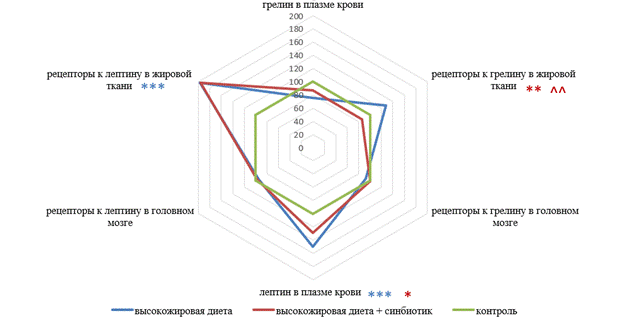
Уровни лептина, грелина в плазме крови, плотность рецепторов к ним в жировой ткани и веществе головного мозга у крыс в зависимости от типа питания
Примечание: * статистическая значимость различий в сравнении с группой контроля (* р < 0,05);
** р ≤ 0,01;
*** р ≤ 0,001); ^ статистическая значимость различий в сравнении с группой пищевой нагрузки жирами в сочетании с синбиотиком (^ р < 0,05; ^^≤ 0,01).
Высокожировая диета способствовала существенному повышению уровня лептина в плазме (р ≤ 0,001) и рецепторов к нему в жировой ткани (р ≤ 0,001), а также тенденции к снижению плотности лептиновых рецепторов в головном мозге (р > 0,05). Кроме того, получены данные о снижении грелина в плазме на фоне уменьшения плотности его рецепторов в тканях головного мозга и повышения - в жировой ткани (р > 0,05).
У животных, получивших синбиотическую коррекцию, также определен высокий уровень лептина (р < 0,05), сниженный уровень грелина (р > 0,05) в плазме крови. При этом установлены данные, свидетельствующие в пользу патогенетической обоснованности применения синбиотической коррекции на фоне нагрузки жирами. Так, у животных, получавших синбиотик, плотность рецепторов к лептину в жировой ткани статистически значимо не отличалась от контрольной группы крыс, находившихся на сбалансированном типе питания. Также в эксперименте получен статистически значимо более низкий уровень плотности рецепторов к грелину в жировой ткани в сравнении с контролем и с показателями крыс, находившихся на высокожировой диете без коррекции.
Помимо представленных данных, у крыс с пищевой нагрузкой жирами в сочетании с синбиотиком обозначена положительная тенденция к более высокому уровню плотности рецепторов к лептину и грелину в головном мозге. Возможно, в целях достижения статистически значимых значений выявленного эффекта, а также повышения эффективности действия синбиотика необходима пролонгация курса приема препарата.
Для более детального изучения патогенетических механизмов нарушений обмена веществ у лабораторных животных в условиях высокожировой нагрузки проведен корреляционный анализ биохимических параметров плазмы крови, показателей грелина, лептина в плазме крови, а также их центральных и периферических рецепторов.
Выявлена статистически значимая положительная корреляция между содержанием лептина в плазме и важными биохимическими параметрами, такими как общий холестерин (r=0,6794, p=0,031), триглицериды (r=0,77664, p=0,010) и глюкоза (r=0,8103, p=0,004). Определена отрицательная корреляция между значениями лептина и холестерином ЛПВП (r= - 0,7461, p=0,013).
Анализ корреляции содержания грелина в плазме с биохимическими показателями крови показал отрицательную корреляцию уровня данного гормона с глюкозой (r= -0,8716, p=0,001) и триглицеридами (r=-0,8053, p=0,005), положительную - с холестерином ЛПВП (r=0,8644 p=0,001).
Полученные данные позволили установить, что у крыс препубертатного возраста, находившихся на исключительно высокожировом типе питания, выявленные в работе отклонения основных показателей жирового и углеводного обмена коррелировали с уровнями лептина и грелина в плазме крови.
Изучению влияния лептина и грелина на жировой и углеводный обмен посвящено большое количество научных исследований [11; 12]. Грелин и лептин оказывают широкий спектр краткосрочных, среднесрочных и долгосрочных регуляторных действий на центральном и периферическом уровнях, включая эффекты метаболического программирования, которые обуславливают правильное развитие и участие жировой ткани в энергетическом гомеостазе [13].
Существенные нарушения обмена грелина и лептина наблюдаются при целом ряде заболеваний и патологических состояний, и в первую очередь при ожирении [6]. Полученные авторами настоящей статьи данные о повышении уровня лептина и снижении грелина в плазме крови в условиях избыточного питания согласуются с рядом современных исследований [11; 12].
В настоящее время основное внимание исследователями уделяется изучению механизмов реализации лептина через центральную нервную систему, при этом количество работ, посвящённых изучению рецепторов к лептину и грелину в жировой ткани, ограниченно [14-16]. Основными рецепторами лептина в жировой ткани являются LepR-b, плотность которых влияет на реализацию конечных эффектов этого регуляторного пептида. Так, у грызунов с дефицитом питания и исходно низким уровнем лептина установлено, что лептин стимулирует транспорт глюкозы в клетки мышц и бурой жировой ткани, способствует снижению глюкозы и инсулина в крови, а также усиливает липолиз в белой жировой ткани. У грызунов в условиях избытка питания и повышенного уровня лептина описаны противоположные эффекты [17].
Полученные в настоящем эксперименте данные позволяют предположить, что описанная выше неоднозначность действия лептина в условиях его исходно низкого и высокого базального уровня объясняется разной плотностью рецепторов лептина в жировой ткани. Так, в условиях нагрузки жирами и гиперлептинемии установленные отклонения жирового и углеводного обмена сопровождались статистически значимым повышением плотности лептиновых рецепторов адипоцитов.
Раздел настоящей работы, посвящённый исследованию роли микробиоты в патологическом обмене веществ, включая особенности метаболизма лептина и грелина, в условиях избыточной нагрузки пищевыми жирами, также представляет немаловажный научный интерес. Положительное влияние нормальной микробиоты на биохимические процессы в условиях избытка жиров в пище и развития алиментарного ожирения доказано как в экспериментальных, так и клинических работах [8; 9]. Это объясняет важность её изучения в контексте лечения метаболических заболеваний. В настоящем эксперименте у «высокожировых» крыс синбиотическая коррекция способствовала сохранению нормального уровня глюкозы, ЛПНП и Апо-А1-протеина в сыворотке крови.
Исследование, проведённое на животных моделях с ожирением и сахарным диабетом 2 типа, показало, что микробиота может влиять на чувствительность к лептину и грелину [9]. В настоящей работе это положение получило подтверждение - использование синбиотика в условиях нагрузки пищевыми жирами позволило предотвратить патологическое увеличение плотности рецепторов к лептину и грелину в жировой ткани и, следовательно, способствовало сохранению их чувствительности на физиологическом уровне.
Заключение
Применение высокожировой диеты позволяет создать оптимальную модель нарушений обмена веществ у экспериментальных животных.
Изучение важнейших регуляторов обмена жиров - лептина и грелина - подтверждает патогенетические механизмы развития ожирения, а также выявляет роль нормальной микробиоты в его профилактике.
Высокожировая диета способствует существенному повышению уровня лептина в плазме и плотности рецепторов к нему в жировой ткани. Анализ корреляционных данных позволяет выдвинуть гипотезу об участии лептина и грелина не только в регуляции липидного, но и углеводного обмена в условиях экспериментальной патологической пищевой нагрузки жирами.
Применение синбиотика, содержащего штаммы Lactobacillus acidophilus LA-5 и Bifidobacterium BB-12 в соотношении с фруктоолигосахаридами 1:1, на фоне высокожировой диеты предупреждает ряд отклонений углеводного и жирового обмена, а также патологическое увеличение количества рецепторов к лептину и грелину в жировой ткани в эксперименте. Полученные данные позволяют выдвинуть положение о том, что использование синбиотиков может способствовать повышению эффективности патогенетической терапии ожирения в клинической практике.



