Введение
Интраоперационный нейрофизиологический мониторинг (ИОНМ) является одним из ключевых методов профилактики неврологических осложнений при ортопедических и нейрохирургических вмешательствах на позвоночнике [1, 2]. Одной из важных его составляющих является мониторинг нервно-мышечной блокады (НМБ), который позволяет поддерживать достаточную релаксацию мышц для удобства хирурга и одновременно сохранную нервно-мышечную передачу для надежной регистрации двигательных функций. Моторные вызванные потенциалы (МВП) и спонтанная/стимуляционная электромиография (ЭМГ) возможны только при сохраненной передаче, тогда как глубокая релаксация затрудняет или делает невозможной их регистрацию. С другой стороны, недостаточная релаксация может затруднять выполнение хирургических манипуляций. Кроме того использование миорелаксантов сопряжено с риском послеоперационной остаточной нервно-мышечной блокады, что также требует тщательного контроля [3, 4]. Появление миорелаксантов и методов контроля их действия стало важным шагом в повышении безопасности анестезии и качества хирургического вмешательства, включая повышение надежности ИОНМ [5].
Частота послеоперационного остаточного нейромышечного блока остается высокой при отсутствии мониторинга нервно-мышечной проводимости. По данным исследований, у примерно 40 % пациентов наблюдается неполное восстановление мышечной силы при пробуждении [6]. Использование количественного нейромышечного мониторинга позволяет существенно снизить риск данных осложнений и практически исключить потребность в повторной интубации из-за мышечной слабости [4, 7]. Тем не менее во многих клиниках по-прежнему применяются субъективные методы оценки блокады, несмотря на их низкую надежность: затухание ответа трудно ощутить тактильно до тех пор, пока степень блока не достигает 60–70 % [8]. Это особенно актуально при проведении ИОНМ, когда отсутствие объективного контроля НМБ может привести к неверной интерпретации изменений МВП, ЭМГ и других модальностей. В связи с этим профессиональные сообщества разработали современные стандарты, согласно которым количественный мониторинг нейромышечной передачи (НМП) должен применяться при каждом использовании миорелаксантов [9, 10]. При этом у некоторых анестезиологов возникает вопрос, необходим ли повсеместный мониторинг НМП в эпоху широкого применения антидотов НМБ, при этом их рутинное применение ограничено высокой стоимостью препаратов [11].
Цель исследования – обобщить современные данные о мониторинге нервно-мышечной передачи при спинальных операциях и сформировать актуальное представление об оптимальных подходах к управлению НМБ и безопасности пациентов в условиях ИОНМ.
Материалы и методы исследования
При подготовке обзора был проведен целенаправленный поиск и анализ научной литературы, посвященной мониторингу нервно-мышечной передачи при хирургических вмешательствах на позвоночнике. В обзор включены публикации, отобранные по ключевым словам (neuromuscular monitoring, intraoperative neuromonitoring, spinal surgery, train-of-four и др.) в базах PubMed, ResearchGate, Google Scholar и РИНЦ. Основу проанализированных материалов составили статьи в рецензируемых медицинских журналах, данные клинических исследований, метаанализов, а также актуальные международные и национальные рекомендации по анестезиологии. Общий объем использованных источников – 43 публикации (9 отечественных и 34 зарубежных) за период с 2010 по 2024 г. Включенные работы охватывают как фундаментальные физиологические аспекты нервно-мышечной передачи, так и практические вопросы применения количественного мониторинга НМБ в разных клинических группах пациентов.
Результаты исследования и их обсуждение
Нервно-мышечный синапс играет ключевую роль в передаче импульсов от моторного нерва к мышечному волокну, вызывая сокращение мышцы. Нервно-мышечное соединение скелетной мышцы образовано окончанием мотонейрона и моторной концевой пластинкой мышечного волокна. При достижении нервным импульсом окончания аксона высвобождается ацетилхолин, который диффундирует через синаптическую щель и связывается с ацетилхолиновыми рецепторами на постсинаптической мембране мышечной клетки, вызывая деполяризацию и генерацию мышечного сокращения. Далее ацетилхолин быстро гидролизуется ферментом ацетилхолинэстеразой [12, 13].
Количественные методы мониторинга НМП. Современные методы количественного мониторинга измеряют мышечный ответ на электрическую стимуляцию периферического нерва и отображают результат в виде числового показателя (например, силы сокращения в процентах или относительных единиц). К методам такого мониторинга относятся механомиография (ММГ) и электромиография (ЭМГ), а также более новые технологии – акселеромиография (АМГ), кинемиография (КМГ), фономиография (ФМГ) и др. ММГ регистрирует силу изометрического сокращения или смещение мышцы в ответ на стимуляцию нерва. Несмотря на то, что она считается надежным исследовательским методом, громоздкость оборудования ограничивает ее применение в клинике [14]. АМГ регистрирует ускорение движения мышцы (обычно с датчика, закрепленного на дистальной фаланге большого пальца) согласно второму закону Ньютона. Благодаря простоте и надежности АМГ долгое время занимала лидирующую позицию среди клинических методов количественного мониторинга НМБ. Кинемиография применяет пьезоэлектрический датчик для оценки угла или амплитуды движения при сокращении – эта технология реализована в некоторых многофункциональных наркозных аппаратах. Однако из-за высокой вариабельности показаний КМГ не получила широкого признания [15]. Фономиография фиксирует низкочастотные звуки, сопровождающие мышечное сокращение; в экспериментальных работах показано, что ФМГ хорошо коррелирует с АМГ, ЭМГ и MМГ, однако в клинической практике применяется редко [16].
Наиболее часто в условиях ИОНМ используется электромиографический мониторинг, который не требует дополнительной аппаратуры. При ЭМГ измеряется вызванный электрический потенциал мышцы в ответ на стимуляцию нерва, что напрямую отражает деполяризацию мышечных волокон и косвенно – силу сокращения [14]. Современные клинические рекомендации рассматривают АМГ и ЭМГ как взаимозаменяемые с точки зрения клинического применения методы количественного мониторинга НМБ [14, 17]. Однако ЭМГ обладает рядом преимуществ в операционных условиях. В частности, она меньше зависит от подвижности конечности и ее массы: АМГ требует, чтобы палец, к которому прикреплен датчик, свободно двигался, тогда как при ЭМГ достаточно надежно наложить поверхностные электроды на целевую мышцу. В условиях ограниченной подвижности – например, когда пациент лежит на животе, а руки зафиксированы, – ЭМГ оказывается более предпочтительным методом мониторинга [4]. С другой стороны, ЭМГ может быть чувствительна к электрическим помехам. Оба метода значительно превосходят субъективную оценку глубины блока по способности выявлять остаточный паралич [8]. Согласно данным исследований, ЭМГ может регистрировать несколько более длительное остаточное действие миорелаксантов (время до полного восстановления НМП) по сравнению с АМГ [18].
Метод train-of-four (TOF) – наиболее распространенный протокол супрамаксимальной (на 20 % выше порогового) стимуляции периферического нерва при мониторинге НМБ. TOF представляет собой подачу серии из четырех импульсов с частотой 2 Гц (интервал 0,5 с). Метод позволяет оценивать как количество ответов на стимулы (TOF count), так и отношение амплитуды четвертого ответа к первому (TOF ratio), выраженное в процентах. TOF ratio может быть рассчитано только при наличии всех четырех ответов и служит основным количественным показателем степени блокады.
При TOF ratio, равном 100 %, амплитуды всех четырех ответов идентичны, что свидетельствует об отсутствии нервно-мышечной блокады. По мере углубления блока амплитуда четвертого ответа уменьшается. При значительном блоке четвертый ответ исчезает и становится возможной лишь оценка TOF count. При этом: TOF count = 3 – регистрируются только первые три ответа; TOF count = 2 – два ответа; TOF count = 1 – только первый; TOF count = 0 – ни одного ответа не регистрируется, что указывает на полную блокаду передачи. Таким образом, метод TOF позволяет дифференцированно оценивать как поверхностную, так и глубокую степень нервно-мышечной блокады, а также служит надежным ориентиром для восстановления функции нервно-мышечной передачи в периоперационном периоде (рисунок) [2, 7].

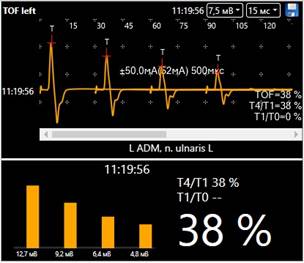
Иллюстрация декремента мышечного ответа при TOF-стимуляции: по оси абсцисс – последовательные стимулы (T1–T4), по оси ординат – относительная амплитуда мышечного сокращения.
Источник: составлено авторами по данным собственных наблюдений
Миорелаксанты разделяются на деполяризующие и недеполяризующие (чаще используемые) по механизму действия на постсинаптические рецепторы. Классическим деполяризующим миорелаксантом является сукцинилхолин, который, подобно ацетилхолину, вызывает кратковременную деполяризацию мышечного волокна с последующим временным параличом – блоком I типа, для которого характерно равномерное снижение силы всех четырех последовательных сокращений без эффекта затухания, TOF ratio при этом остается близким к 1,0 [12]. Однако при повторном или длительном введении сукцинилхолина может развиться блок II типа (или фаза II), клинически неотличимый от действия недеполяризующих релаксантов. Такой блок сопровождается характерным декрементом при TOF- и тетанической стимуляции [12].
Недеполяризующие миорелаксанты (векуроний, рокуроний, атракурий, цисатракурий и др.) действуют как конкурентные антагонисты ацетилхолина, препятствуя деполяризации мышечных волокон без первичного возбуждения. Для всех препаратов этой группы типично выраженное затухание ответа при TOF- или тетанической стимуляции, обусловленное истощением пресинаптических запасов ацетилхолина при повторной стимуляции [3]. В клинической практике TOF-стимуляция – основной способ мониторинга глубины НМБ, поскольку она не требует сравнения с исходной амплитудой, как, например, тест одиночного сокращения, а оценивает относительное снижение ответа, возникающее только при значимом блоке. Таким образом, TOF позволяет не только определить факт и степень нервно-мышечной блокады, но и судить о ее типе [19].
Альтернативные качественные методы. Если объективные мониторы недоступны, анестезиолог может оценивать реакцию на стимуляцию субъективно – с помощью периферического нервного стимулятора и наблюдения за сокращениями мышцы. Такие портативные устройства генерируют ту же последовательность импульсов (TOF) или тетаническое раздражение, однако интерпретация ответов (по числу и силе подергиваний) остается субъективной и обладает низкой чувствительностью: показано, что декремент невозможно надежно выявить, пока TOF ratio не снизится до 0,4–0,5 – значительно ниже безопасного порога 0,9 [8]. Несмотря на простоту метода, его надежность крайне ограничена. Ввиду широкой доступности современных объективных мониторов и доказанных клинических преимуществ, субъективный мониторинг НМБ в настоящее время считается устаревшим и нежелательным. Альтернативой также служат клинические тесты в конце операции (например, удержание головы в течение 5 с, максимальное сжатие кистей и др.), однако они также демонстрируют низкую точность и могут давать ложные результаты [8]. Значение количественного нейромышечного мониторинга сопоставимо с внедрением пульсоксиметрии и капнографии: технологии, когда-то считавшиеся избыточными, впоследствии существенно повысили безопасность анестезии [10].
Новые технологии мониторинга. Продолжается поиск новых устройств и методов мониторинга НМБ. Один из таких подходов – компрессомиография: метод, при котором манжета для измерения артериального давления со встроенными электродами (устройство TOF-Cuff) служит одновременно стимулятором нерва и датчиком мышечного сокращения, регистрируя изменения давления [20]. Манжета может быть расположена под хирургическими простынями, что удобно при ограниченном доступе. Показания компрессомиографии хорошо коррелируют с ММГ [21]. Другое направление – интеграция мониторинга НМБ в анестезиологическую аппаратуру. Современные наркозно-дыхательные аппараты могут оснащаться встроенными модулями АМГ или КМГ, подключаемыми по необходимости и отображающими TOF-ответ на экране основного монитора. Разрабатываются также экспериментальные системы с обратной связью, автоматически регулирующие дозу миорелаксантов на основании мониторинга TOF [22].
Перспективным направлением остаются беспроводные и портативные сенсоры, упрощающие установку и снижающие уровень электрических помех [23]. Активно исследуются и оптические методы – например, лазерные датчики, фиксирующие мельчайшие движения мышц дистанционно [16].
Кроме аппаратных решений, ведутся разработки новых миорелаксантов ультракороткого действия, быстро инактивируемых эндогенными аминокислотами [24], что потенциально снижает потребность в антагонистах. Расширяются и области применения современных препаратов: так, сугаммадекс успешно применяется при нейроэндоваскулярных вмешательствах для ускоренного пробуждения пациента после вмешательства [25].
Антагонисты НМБ и мониторинг восстановления. Полное восстановление нервно-мышечной передачи к моменту завершения операции – обязательное условие безопасной экстубации. Для ускорения восстановления традиционно применяются ингибиторы ацетилхолинэстеразы (например, неостигмина метилсульфат), которые повышают концентрацию эндогенного ацетилхолина в синапсе и конкурируют с недеполяризующим блокатором. Однако их эффективность снижается при глубоком блоке (TOF count 0–1) [26]. Согласно рекомендациям, неостигмина метилсульфат следует вводить при появлении как минимум двух ответов в TOF (TOF count ≥ 2), предпочтительно при TOF ratio не ниже 0,4–0,5. Оптимально титровать его под контролем количественного мониторинга до достижения TOF ≥ 0,9 [10, 26].
Появление селективного антагониста сугаммадекса, способного связывать стероидные миорелаксанты (рокурония бромид, векурония бромид) в плазме крови, стало важным достижением. Он позволяет антагонизировать даже глубокую блокаду за считаные минуты: доза 2 мг/кг эффективно устраняет умеренный блок (TOF count ≥ 2) за 2–3 мин [10]. Это особенно важно при спинальных операциях, если требуется провести мониторинг МВП или выполнить wake-up тест – сугаммадекс позволяет быстро восстановить нервно-мышечную передачу [2, 27]. Тем не менее даже при его применении остаточный блок возможен при отсутствии мониторинга [4]. Поэтому после антагонизации необходимо количественно подтвердить достижение TOF ratio ≥ 0,9 [11]. Мониторинг также помогает избежать преждевременного введения неостигмина метилсульфата, когда он еще неэффективен. Описаны случаи, когда у пациента с миастенией не удалось достичь нужного уровня восстановления после сугаммадекса и потребовалось дополнительное введение неостигмина метилсульфата для полной декураризации [28]. Таким образом, мониторинг облегчает индивидуализированный подход к восстановлению нервно-мышечной проводимости.
Особенности управления НМБ при спинальных операциях. Операции на позвоночнике, как правило, отличаются значительной продолжительностью, технической сложностью и необходимостью использования интраоперационного нейрофизиологического мониторинга (ИОНМ). Требования к глубине нервно-мышечной блокады (НМБ) при таких вмешательствах варьируют в зависимости от этапа операции. Так, во время хирургического доступа, выполнения манипуляций вблизи спинного мозга, оценки проводимости вегетативных волокон может потребоваться глубокая блокада (TOF count = 0) для исключения непроизвольных движений пациента и повышения точности мониторинга. Напротив, при регистрации МВП или ЭМГ (в том числе при тестировании установки транспедикулярных винтов) необходимо наличие сохранной нервно-мышечной передачи – то есть отсутствие или минимальная степень блока, чтобы не маскировать возможные неврологические изменения.
Для обеспечения оптимальной релаксации на разных этапах операции применяются различные стратегии управления НМБ. Один из распространенных подходов заключается в следующем: после начального болюсного введения рокурония для интубации и начала операции дальнейшее поддержание блокады осуществляется контролируемо – при необходимости дозирование прекращается или снижается, ожидается частичное восстановление TOF перед критическими фазами ИОНМ, и, при повторной необходимости, вводится дополнительная доза миорелаксанта. Существуют и более сложные стратегии, такие как так называемая «прерываемая» миорелаксация: в середине операции вводится сугаммадекс для временного восстановления двигательных функций, после чего, при необходимости, релаксация возобновляется с использованием повторной дозы рокурония. Такой подход успешно применяется, например, при проведении wake-up теста с мониторингом МВП в условиях осознанной седации – после пробуждения пациента и завершения оценки его двигательной активности проводится повторное введение релаксанта для завершения вмешательства [29]. Очевидно, что подобная тактика требует обязательного использования количественного мониторинга НМБ, позволяющего точно определять степень блокады на каждом этапе операции.
При проведении значительного количества спинальных операций, особенно с использованием комбинированной анестезии, следует иметь в виду, что ингаляционные анестетики (энфлуран, изофлуран, галотан) могут потенцировать действие миорелаксантов на 40 % и более. В отличие от них, пропофол такого эффекта не оказывает [8]. Это особенно важно при использовании изолированной ингаляционной анестезии во время доступа длительных вмешательств.
При ряде спинальных операций, например при удалении интрамедуллярных опухолей с использованием методики регистрации D-волны или соматосенсорных вызванных потенциалов (ССВП), допускается наличие выраженной степени блока, так как регистрация сигналов осуществляется напрямую с нервных структур, минуя мышечную передачу [2].
При длительных вмешательствах, например при коррекции сколиоза, при невозможности отказаться от релаксации предпочтение отдают непрерывной инфузии миорелаксанта, а не повторным болюсным введениям. Это обеспечивает более стабильную глубину блока, снижая амплитуду колебаний – при условии постоянной коррекции скорости инфузии на основании данных TOF-мониторинга. Возможно как ручное управление инфузией (врач регулирует подачу в ответ на изменения TOF), так и автоматическое [22]. При отсутствии объективного мониторинга даже опытные анестезиологи могут поддерживать избыточную блокаду дольше, чем необходимо, либо допускать ее ослабление, что приводит к нежелательным движениям во время критических этапов операции. Использование целевого контроля TOF позволяет удерживать глубину блока в оптимальном диапазоне [8]. Следует учитывать, что общее количество введенного миорелаксанта при инфузионной технике обычно выше, чем при болюсной, однако такая схема позволяет избежать резких пиков концентрации и, соответственно, резких перепадов блокады, что особенно важно при выполнении ИОНМ.
Практически доказанная схема управления может быть следующей: после болюса рокурония начинается инфузия для поддержания глубокого блока (TOF count = 0). За 15–30 мин до планируемой регистрации МВП инфузия останавливается, и после появления хотя бы одного-двух ответов TOF проводится либо введение антагониста, либо ожидается спонтанное восстановление TOF ratio до > 0,5. По завершении критического этапа, при необходимости, можно вновь ввести болюс рокурония или возобновить инфузию в меньшей дозе – ориентируясь на нужный уровень TOF count. При этом важно не ориентироваться исключительно на время, а использовать количественные показатели: повторное введение релаксанта чаще всего выполняется, когда амплитуда первого ответа (T1) достигает 10–25 % от контрольной, что обеспечивает достаточную мышечную релаксацию без риска накопления [30].
Проблемы и индивидуальные особенности мониторинга. На практике при использовании мониторов НМБ возникают различные технические и физиологические особенности. Прежде всего важна правильная установка и калибровка датчиков. АМГ датчики требуют регистрации исходной амплитуды сокращений до введения релаксанта; при отсутствии калибровки TOF ratio может ошибочно превышать 1,0 в фазе восстановления [31]. ЭМГ-мониторы в калибровке не нуждаются, но зависят от качества контакта электродов и уровня помех. В условиях ИОНМ часто используют игольчатые электроды, уже установленные для регистрации ССВП или МВП. При длительных операциях возможно увеличение сопротивления поверхностных электродов. Методика субмаксимальной стимуляции была предложена для оценки остаточного нервно-мышечного блока, однако пока не получила широкого применения при общей анестезии из-за ограниченной надежности [30].
Типичная точка стимуляции – локтевой нерв с регистрацией с m. adductor pollicis, чувствительной к миорелаксантам и коррелирующей с восстановлением дыхательной мускулатуры. Однако при спинальных операциях часто используют m. abductor pollicis и срединный нерв – без необходимости дополнительной установки электродов. При недоступности рук или наличии неврологического дефицита применяют стимуляцию большеберцового или лицевого нерва. Последний менее чувствителен к релаксантам: при TOF ~1,0 по лицу, на кисти может сохраняться TOF ~0,8 [16].
Осевые мышцы (диафрагма, мышцы брюшного пресса, гортани) в целом менее чувствительны благодаря лучшему кровоснабжению и быстрее восстанавливаются после блокады, за исключением случаев миастении и других заболеваний с нарушением НМП [16]. Диафрагма может начать восстанавливаться уже при TOF count 1–2 на кисти, что способно вызвать нежелательные дыхательные движения. Продолжительность действия рокурония на диафрагму примерно на 30 % короче, чем на adductor pollicis, поэтому при необходимости абсолютной неподвижности диафрагмы (например, при операции на грудном отделе позвоночника) простого контроля TOF на кисти недостаточно. В таких случаях применяют подсчет посттетанических сокращений (ПТС): после 5-секундной тетанической стимуляции 50 Гц регистрируют ответ на серию одиночных стимулов, что позволяет оценить сверхглубокий блок (TOF count 0). Если ПТС на кисти 5–8, это указывает на глубокий блок, однако диафрагма уже может частично работать. В практике для оценки состояния диафрагмы рекомендуют ориентироваться на комбинацию ПТС и клинических признаков (например, движения грудной клетки) [32].
Индивидуальные факторы пациента также влияют на интерпретацию мониторинга. Так, гипотермия усиливает блокирующий эффект миорелаксантов и замедляет восстановление мышечной силы [9], что отмечается более длительным сохранением низкого TOF ratio. Даже после введения неостигмина метилсульфата или сугаммадекса в условиях гипотермии возможно затяжное сохранение декремента.
Метаболические и системные заболевания тоже накладывают отпечаток: например, при сахарном диабете может развиваться нейропатия и изменяться чувствительность нервно-мышечного синапса к релаксантам, что требует более тщательного наблюдения НМБ [33]. У пациентов с тяжелыми заболеваниями печени или почек замедлен метаболизм некоторых миорелаксантов, а при электролитных нарушениях (гипокалиемия, гипермагниемия) сама по себе снижается возбудимость мышц.
Пациенты детского возраста представляют особую группу с точки зрения нейромышечного мониторинга. У детей всех возрастов чувствительность к препаратам может быть выше, а запас прочности дыхательной мускулатуры – ниже. Ранее считалось, что объективный мониторинг затруднен у новорожденных и грудных детей из-за маленьких размеров конечностей и сложности калибровки [34]. В последние годы появились специализированные детские датчики – например, миниатюрные многоразовые электроды и акселерометры, а также накожные клейкие электроды для ЭМГ, которые показали свою эффективность даже у новорожденных [35]. Следует учитывать при расчете доз и интерпретации TOF: восстановление у ребенка до TOF ratio 0,9 может не гарантировать столь же полной готовности к экстубации [36].
У пациентов с ожирением увеличен объем распределения лекарственных препаратов, и может потребоваться корректировка доз на основе идеальной массы тела. Избыточная жировая ткань ухудшает стимуляцию и регистрацию ответа. В таких случаях рекомендуется увеличение тока и ширины импульса для достижения супрамаксимальной стимуляции [33].
Нервно-мышечные заболевания (миастения, синдром Ламберта – Итона, мышечные дистрофии и др.) существенно влияют на поведение НМБ и ее мониторинг. У больных миастенией даже без введения миорелаксантов может наблюдаться выраженный декремент при TOF-стимуляции из-за уменьшенного резерва ацетилхолина и быстрого утомления рецепторов [27, 37]. Стратегия анестезии при миастении включает минимальное использование релаксантов, особенно в сочетании с ингаляционными анестетиками [38]. Если же релаксант применен, то обычно предпочтение отдается небольшим дозам короткодействующих средств под контролем мониторинга, с применением сугаммадекса [37], в ряде случаев с дополнительным введением неостигмина метилсульфата [28]. Синдром Ламберта – Итона (миастенический синдром при мелкоклеточном раке легкого) также сопровождается гиперчувствительностью к недеполяризующим релаксантам [39]. Клинические рекомендации по периоперационному ведению пациентов с нервно-мышечными заболеваниями однозначно указывают на обязательность количественного нейромышечного мониторинга и готовность к пролонгированной ИВЛ, даже если была введена стандартная доза антагониста [38].
Клинические исследования эффективности мониторинга и рекомендации. Влияние количественного нейромышечного мониторинга на исходы анестезии активно изучается в течение последних десятилетий. Результаты ряда рандомизированных исследований и метаанализов свидетельствуют о том, что применение объективного контроля НМБ достоверно снижает частоту остаточной нервно-мышечной блокады и связанных с ней осложнений [3, 40, 41]. Эти данные нашли отражение в современных клинических рекомендациях. В 2018 г. было опубликовано международное консенсусное заявление, в котором подчеркивается ненадежность исключительно клинических критериев оценки восстановления и подчеркивается необходимость повсеместного внедрения количественных методов мониторинга [8]. Согласно рекомендациям Европейского общества анестезиологов (2020) и Американского общества анестезиологов (2023), тактильная оценка TOF не может считаться достаточной, а достижение TOF ratio ≥ 0,9 является обязательным условием безопасной экстубации [10, 42, 43].
Заключение
Мониторинг нервно-мышечной передачи прочно вошел в современную медицинскую практику как важнейший элемент обеспечения безопасности пациентов при операциях, сопровождающихся использованием миорелаксантов, включая спинальную хирургию. Применение количественных методов контроля глубины блокады позволяет более точно дозировать препараты, предотвращая как недостаточную релаксацию, затрудняющую работу хирурга, так и избыточную – связанную с риском послеоперационных осложнений. Анализ литературы показывает, что при спинальных вмешательствах мониторинг НМБ имеет особое значение, поскольку позволяет адаптировать глубину блока в зависимости от этапа операции и требований нейрофизиологического сопровождения. При выполнении МВП и ЭМГ целесообразно минимизировать дозы миорелаксантов, вводя их фракционно под контролем TOF-стимуляции или используя прерываемую блокаду с последующей антагонизацией (например, сугаммадексом) при необходимости. Введение поддерживающих доз, а также экстубация пациента должны осуществляться только после объективного подтверждения восстановления нервно-мышечной передачи. С учетом накопленных доказательств и современных рекомендаций можно ожидать, что в ближайшем будущем количественный нейромышечный мониторинг станет такой же неотъемлемой и рутинной частью анестезиологического обеспечения, как капнография или пульсоксиметрия.



