Введение. Нейрон-специфическая енолаза (НСЕ) является формой фермента енолазы, который встречается в клетках нервной и эндокринной систем [1]. Ее повышение было отмечено при ишемическом инсульте (ИИ) и ряде других заболеваний с поражением нервной ткани [2; 3]. Однако специфичность этого вещества в отношении ишемического поражения, как и пиковые значения и сроки их достижения при ряде заболеваний с повышением НСЕ, остаются не четко определенными. Известно, что антитела к NR2-субъединице NMDA-рецептора (NR2-антитела) вырабатываются в организме в ответ на появление частиц NMDA-рецептора, которые высвобождаются в кровоток при повреждении мозга с нарушением целостности гематоэнцефалического барьера. Как и в случае с НСЕ, его повышение было зарегистрировано при ишемическом поражении мозга, в том числе при инсульте, при других видах острого повреждения мозговой ткани, и даже существуют данные о повышении его концентрации в крови при ряде хронических заболеваний [4; 5]. В различных исследованиях NR2–антитела оценивались в сыворотке крови в разное время даже при одних и тех же заболеваниях, что существенно осложняет поиск оптимального времени взятия биоматериала и пороговых значений данного биомаркера, превышение которого может дать достоверную информацию о наличии патологии.
Учитывая патофизиологическую гетерогенность процессов, протекаемых при ИИ, оценивание диагностических и прогностических параметров заболевания с помощью отдельных биомаркеров может быть недостаточным, в связи с чем целесообразно применение панели биомаркеров. Для достоверной и полной характеристики ИИ в панели должны применяться вещества, обладающие специфичностью к поражению мозговой ткани, чувствительные к степени повреждения и способные достаточно быстро отражать изменение состояния мозгового вещества, а также прогнозировать исходы с точки зрения как неврологических, так и функциональных расстройств.
Цель исследования. Определение значений НСЕ и NR2-антител как диагностических и прогностических биомаркеров острого периода ИИ.
Материалы и методы исследования. Работа выполнена в ФГБУ «НМИЦ им. В.А.Алмазова» (Санкт-Петербург, Россия). В исследование было включено 127 пациентов: 84 пациента в остром периоде ИИ (основная группа), а также 26 пациентов с хронической ишемией мозга (ХИМ) и 27 здоровых добровольцев (ЗД). Обследование в основной группе включало в себя неврологический осмотр, нейровизуализационное обследование, нейропсихологическое тестирование и лабораторное исследование, проводимые дважды – в первые 72 часа от развития симптомов и повторно на 10-14-е сутки (у пациентов с ХИМ и ЗД был проведен разовый анализ уровня биомаркеров). Для оценки уровня биомаркеров использовали сыворотку крови, анализ уровня NR2-антител проводился методом иммуноферментного анализа, концентрация НСЕ измерялась на автоматическом электрохемилюминесцентном анализаторе Сobas e 411, референсные значения для НСЕ составляли 16,3 нг/мл, а для NR2-антител – 2,0 нг/мл. Анализ полученных данных проводился в программе SPSS Statistics 26 с расчетом среднего значения и ошибки среднего, уровня значимости различий (различия считались значимыми при p<0,05) и оценкой корреляций с помощью непараметрических критериев Уилкоксона, Манна-Уитни и Спирмена. Кроме того, проводился ROC-анализ (англ. Receiver Operating Characteristic) чувствительности и специфичности с расчетом коэффициента AUC (англ. Area Under Curve).
Результаты исследования и их обсуждение
Среди факторов риска ИИ у пациентов основной группы чаще всего обнаруживали признаки атеросклероза (АС) брахиоцефальных артерий (93%), несколько реже встречалась артериальная гипертензия (73%), нарушения ритма сердца (35%), ранее перенесенный ИИ (33%) и сахарный диабет 2 типа (17%), а наличие вредных привычек отметили у 18% пациентов (курение – 14%, злоупотребление алкоголем – 4%). В 48% случаев ИИ классифицировали как неуточненный подтип, в 35% – как кардиоэмболический, в 12% – как атеротромботический, у остальных 5% пациентов – как лакунарный.
В начале ИИ тяжесть неврологических расстройств по шкале тяжести Национального института здоровья (NIHSS) в основной группе составила 7,4±0,6 балла, и к 10-14-му дню была отмечена значимая положительная динамика улучшения неврологического статуса (4,2±0,5 балла, p=0,0001). В дебюте ИИ 30 пациентов были отнесены в подгруппу с тяжелым неврологическим дефицитом (6 и более баллов по NIHSS, в среднем 13,5±1,1балла), 54 пациента – в подгруппу с легкой степенью неврологического дефицита (0-5баллов по NIHSS, в среднем 3,9±0,2 балла). К 10-14-му дню в тяжелой подгруппе оставались 13 пациентов (средний балл 13,0±1,6), остальные пациенты продемонстрировали легкую степень неврологических расстройств (средний балл 2,6±0,2).
Функциональные расстройства у пациентов с ИИ оценивали с помощью модифицированной шкалы Рэнкин (mRS), что позволило выделять подгруппы с неблагоприятным (3-6 баллов) и благоприятным (0-2 балла) функциональным исходом. В первые трое суток ИИ оценка пациентов основной группы составила 3,5±0,1 балла, при этом в подгруппе неблагоприятного исхода было 72 пациента со средней оценкой 3,7±0,1 балла. К 10-14-му дню неблагоприятный функциональный краткосрочный исход имели 43 пациента (средний балл 3,5±0,1), у 41 пациента исход оценили как благоприятный (средний балл 1,6±0,1), и в целом в основной группе также отмечено значительное улучшение функционального статуса (2,5±0,1, p=0,0001). Было установлено, что тяжесть неврологического дефицита и краткосрочный функциональный исход пациентов с ИИ не зависели от исходных уровней общего холестерина, глюкозы сыворотки крови и активированного частичного тромбопластинового времени. Однако у пациентов при наличии АС брахиоцефальных артерий в форме бляшек наблюдался более выраженный начальный неврологический дефицит (р=0,023) и менее благоприятный функциональный исход на 10-14-й день ИИ (р=0,007), что указывает на значительную роль АС как фактора риска более тяжелого течения и неблагоприятного прогноза ИИ. При проведении компьютерной томографии головного мозга удалось достоверно определить наличие очага ишемии у 45% пациентов основной группы: в 20% случаев определялся малый очаг (до 2 см максимальной величины измерения), в 14% – средний (от 2 до 5 см) и в 11% случаев – крупный очаг (более 5 см). Авторы убедились в наличии зависимости тяжести течения ИИ от размеров очага ишемии: у пациентов с крупным очагом ишемии степень неврологических нарушений как в дебюте (11,4±2,5 балла и 6,2±1,2 балла, р=0,027), так и в динамике (7,2±2,6 балла и 3,1±0,7 балла, р=0,031) была выше по сравнению с пациентами с малым очагом, а у пациентов со средним размером очага краткосрочный исход к 10-14-му дню по сравнению с пациентами с малым очагом был менее благоприятен (3,0±0,4 и 2,0±0,2 балла, р=0,047).
У 39 (46%) пациентов основной группы проводили оценку нейропсихологического профиля по шкалам когнитивных и тревожно-депрессивных симптомов. Согласно Монреальской шкале когнитивной оценки (MoCA), когнитивные нарушения имелись у 64% пациентов со средним баллом 20,4±1,0. Наличие тревожно-депрессивных расстройств оценивалось по Госпитальной шкале тревоги и депрессии (HADS): согласно подшкале тревоги, клинически выраженную тревогу демонстрировали 8% пациентов, субклинические симптомы тревоги – 13%, у остальных симптомы тревоги были минимальными; при оценивании депрессии по соответствующей подшкале, клинически выраженную депрессию обнаружили у 8% пациентов, а субклинически выраженные симптомы – у 26%, тогда как оценка в пределах нормы оставалась у 66% пациентов. Большинство пациентов продемонстрировали снижение степени выраженности психоэмоциональных расстройств к 10-14-му дню ИИ. При значительном неврологическом дефиците в дебюте заболевания и функциональном дефиците к 10-14-му дню степень когнитивных нарушений при ИИ оказалась выше (р=0,039 и р=0,027 соответственно), однако подобного влияния на наличие и выраженность тревоги и депрессии отмечено не было.
Как видно из таблицы, средние значения НСЕ при ИИ составили 27,6±3,2 нг/мл, превышая у большинства пациентов референсные значения (64%) в первые трое суток заболевания, а средние значения NR2-антител в основной группе составили 0,9±0,2 нг/мл, лишь у троих пациентов выходя за пределы референсных значений (4%). У пациентов с ХИМ концентрация НСЕ составила в среднем 21,8±2,8 нг/мл, а NR2-антитела в данной группе имели значения в среднем 0,7±0,1 нг/мл. В группе ЗД уровни НСЕ составили 15,9±1,1 нг/мл, а уровни NR2-антител – 1,1±0,2 нг/мл. Было установлено, что при ИИ в первые трое суток заболевания значения НСЕ выше, чем у ЗД (p=0,003), а NR2-антитела – ниже (p=0,045).
Значения уровней НСЕ и NR2-антител по группам пациентов
|
Биомаркер |
Группа ИИ (точка 1), n=84 |
Группа ХИМ, n=26 |
Группа ЗД, n=27 |
Уровень значимости различий |
|
НСЕ, нг/мл |
27,62±3,15 |
21,75±2,78 |
15,87±1,11 |
рии/хим=0,349 рии/зд=0,003 рхим/зд=0,117 |
|
NR2-антитела, нг/мл |
0,90±0,15 |
0,71±0,09 |
1,12±0,16 |
рии/хим=0,471 рии/зд=0,045 рхим/зд=0,074 |
Оба биомаркера при ИИ не отличались значимо от показателей при ХИМ (р=0,349 для НСЕ и р=0,471 для NR2-антител). К 10-14-му дню ИИ НСЕ продемонстрировала значимое снижение уровней в сыворотке крови пациентов основной группы, достигая в среднем 17,9±0,9 нг/мл (p=0,001), при этом NR2-антитела по сравнению с первичной оценкой незначительно нарастали, достигая значений 1,0±0,5 нг/мл (р=0,085), как видно на рисунке 1. Оба биомаркера на данном этапе оценки не демонстрировали значимых различий между группами пациентов (для НСЕ р=0,344 и р=0,379, для NR2-антител р=0,333 и р=0,083 при ИИ по сравнению с ХИМ и ЗД соответственно).
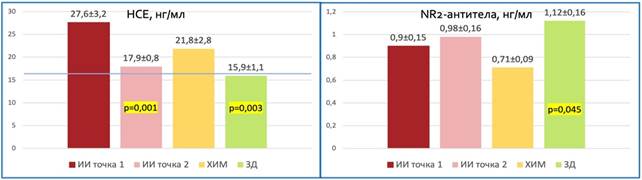
Рис. 1. Значения НСЕ и NR2-антител по группам пациентов в динамике
(точка 1 – первые 72 часа ИИ, точка 2 – 10-14-й день ИИ, р – уровень значимости различий по сравнению с основной группой в первые 72 часа ИИ)
Значимой зависимости уровней НСЕ от факторов риска инсульта, таких как артериальная гипертензия, ранее перенесенный инсульт, сахарный диабет и курение, получено не было (p=0,091, р=0,163 p=0,341, p=0,539 соответственно). Уровень NR2-антител был выше лишь у курящих пациентов (p=0,041), но при наличии артериальной гипертензии, сахарного диабета и ИИ в анамнезе также значимо не отличался (p=0,875, p=0,521, p=0,360 соответственно). Различий по уровню НСЕ в зависимости от выраженности АС брахиоцефальных артерий отмечено не было (р=0,051 и р=0,099 в точках 1 и 2 соответственно), а уровень NR2-антител был статистически значимо выше при наличии АС с бляшками, сужающими просвет менее, чем на 70% (р=0,034 и р=0,029 в точке 1 и точке 2 соответственно). Уровни НСЕ в первые трое суток ИИ были значительно выше при неблагоприятном функциональном исходе (р=0,012) и при тяжелом неврологическом дефиците ИИ (p=0,007), что также подтверждалось положительными корреляционными взаимосвязями. При этом в случаях атеротромботического подтипа ИИ корреляционная связь уровня НСЕ с тяжестью неврологического дефицита была сильнее (r=0,669), чем у пациентов всей основной группы (r=0,282). Кроме того, у пациентов с крупным очагом ишемии уровни НСЕ сильнее коррелировали с тяжестью неврологического дефицита и с выраженностью функциональных расстройств (r=0,731, r=0,706 соответственно, по сравнению с r=0,282 и r=0,285). В динамике концентрация НСЕ значительно снижалась у больных всех подгрупп, кроме пациентов с изначально низкой степенью функциональных расстройств (p=0,695). Значения NR2-антител в основной группе в первые трое суток ИИ оказались выше у тех пациентов, кто имел неблагоприятный краткосрочный функциональный исход на 10-14-е сутки заболевания (p=0,012), и у таких пациентов было отмечено наиболее значительное нарастание данного биомаркера между 1-3 сутками и 10-14 днем заболевания. Корреляционный анализ в основной группе пациентов не показал достаточно сильной взаимосвязи между уровнями NR2-антител и выраженностью неврологических и функциональных расстройств, однако при выделении пациентов с атеротромботическим подтипом ИИ появилась значимая связь уровня NR2-антител с тяжестью неврологического дефицита (r=0,91), которой в общей массе основной группы пациентов не отмечалось (r=0,021). У пациентов с ИИ при отсутствии нарушений когнитивного профиля уровни НСЕ более заметно снижались (p=0,009), а NR2-антитела возрастали (p=0,0089) по сравнению с пациентами, имевшими когнитивные нарушения. Похожим образом было выявлено, что среди всех пациентов основной группы именно у тех, кто не имел тревожно-депрессивных расстройств, уровни НСЕ значительно снижались (p=0,016), а NR2-антител – значительно нарастали к 10-14-му дню (р=0,008), в отличие от остальных пациентов. С помощью ROC-анализа и оценки индекса Area Under Curve (AUC) удалось провести оценку клинической информативности метода оценки начальных сывороточных уровней NR2-антител и НСЕ при ИИ. Информативность исследуемых биомаркеров в дифференциации ИИ и ХИМ была равнозначно слабой (для НСЕ AUC=0,561, для NR2-антител AUC=0,547), а для ИИ и ЗД биомаркеры показали разный результат: НСЕ продемонстрировала удовлетворительный результат (AUC=0,690), а NR2-антитела, напротив, имели низкий показатель (AUC=0,371). Информативность панели для дифференциации ИИ и ХИМ оставалась невысокой (AUC 0,555), а для различения ИИ и ЗД панель подходила лучше (AUC=0,701), несмотря на низкий самостоятельный показатель NR2-антител, как показано на рисунке 2.
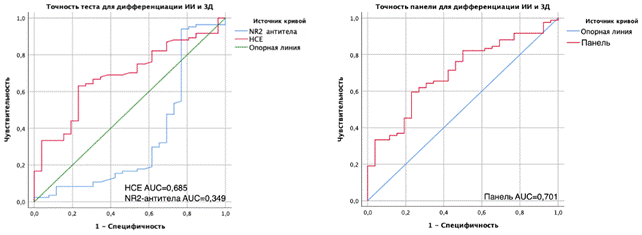
Рис. 2. Клиническая информативность НСЕ и NR2-антител индивидуально и в составе панели для дифференциации ИИ и ЗД
Информативность биомаркеров в отношении исходов ИИ оказалась несколько выше диагностической ценности: НСЕ для прогнозирования тяжести неврологического дефицита к 10-14-му дню ИИ показывала более высокий результат (AUC=0,719), чем NR2-антитела (AUC=0,650), и наоборот – для определения тяжести функционального исхода NR2-антитела показали более высокий результат (AUC=0,738) по сравнению с НСЕ (AUC=0,682). Тем не менее в обоих случаях прогнозирование тяжести ИИ на 10-14-е сутки оказалось более надежным проводить с помощью панели биомаркеров. Тяжелый неврологический дефицит определялся с индексом AUC=0,752, а неблагоприятный функциональный краткосрочный исход – с индексом AUC=0,748.
Хотя ранее в литературе приводились данные в пользу существования зависимости уровней NR2-антител от наличия хронических заболеваний и факторов риска ИИ [4], авторы убедились, что сывороточные уровни ни НСЕ, ни NR2-антител не зависят существенным образом от большинства подобных факторов, исследованных в данной работе. Данный факт может свидетельствовать о достаточно высокой специфичности изученных веществ в отношении острого повреждения мозговой ткани. Установлено повышение уровней НСЕ и снижение NR2-антител при остром ИИ по сравнению с ЗД, что согласуется с литературными данными в отношении НСЕ, при этом в большинстве исследований указано на возрастание NR2-антител при остром ИИ [2; 5]. Предполагается, что в условиях острого ИИ способность быстрой выработки NR2-антител в ответ на повреждение мозга зависит от объема вовлеченной мозговой ткани и происходит медленнее в условиях более обширной области поражения. Кроме того, в других работах указывалось на значимость постинсультной иммуносупрессии как фактора, осложняющего течение ИИ, что, в свою очередь, может замедлять выработку данного биомаркера с учетом его происхождения [6]. Опираясь на полученные данные о выраженной зависимости исследованных биомаркеров от тяжести течения заболевания именно при атеротромботической природе ИИ, можно предположить наличие патофизиологических причин для более значительного нарастания концентраций НСЕ и NR2-антител в сыворотке крови в подобных условиях. Этому вопросу в литературе ранее не отводилось достаточно внимания, лишь отдельные исследования учитывали подтип ИИ при изучении биомаркеров [7]. Дальнейшее изучение этой темы может открыть новые данные о патогенезе происхождения различных маркеров повреждения мозга и повысить ценность лабораторного метода оценки биомаркеров при ИИ. Кроме того, авторы убедились в наличии зависимости уровней НСЕ и NR2-антител от степени выраженности сопутствующих ИИ психоэмоциональных расстройств. Эта взаимосвязь, вероятно, реализуется за счет влияния тяжести ИИ, влияющей как на уровни биомаркеров повреждения мозга, так и на выраженность тревоги, депрессии и когнитивных нарушений [8]. Наконец, установлено, что исследуемые вещества имеют как диагностический, так и прогностический потенциал в отношении ИИ, а их совокупная оценка как панели позволяет повысить клиническую информативность данных методов лабораторной диагностики. И хотя многие исследователи ранее указывали на более высокий потенциал панели разнообразных биомаркеров по сравнению с отдельными веществами при ИИ, авторами не было обнаружено исследований, где на единой выборке пациентов проводилась бы одновременная оценка НСЕ и NR2-антител [3].
Заключение. Отражением повреждения мозговой ткани в остром периоде ИИ являются повышение количества НСЕ и снижение NR2-антител в сыворотке крови по сравнению с группой контроля, при этом в динамике к 10-14-му дню ИИ наблюдается значительное снижение уровней НСЕ, тогда как NR2-антитела демонстрируют незначительное возрастание с течением времени. Повышенные уровни НСЕ и NR2-антител в первые 72 часа развития ИИ выявляются у пациентов с тяжелым течением инсульта и неблагоприятным исходом к 10-14-му дню заболевания. Снижение НСЕ и повышение NR2-антител в динамике особенно значимо проявляется в случаях благоприятного течения ИИ в отношении неврологических, функциональных и психокогнитивных изменений. Полученные данные являются отражением их прогностического потенциала, и это делает возможным использовать НСЕ и NR2-антитела в качестве предикторов краткосрочного исхода ИИ. Данная комбинация биомаркеров не является достаточно специфичной для проведения дифференциальной диагностики ИИ на раннем госпитальном этапе, но благодаря своей чувствительности может быть полезна для отслеживания динамики состояния мозговой ткани при ИИ. Оценка уровней НСЕ и NR2-антител в период острого ИИ может способствовать выявлению ранних осложнений, уточнению реабилитационного потенциала в остром периоде ИИ и формированию индивидуальной тактики лечения.



