Введение
В настоящее время проблема хирургического лечения пациентов с заболеваниями панкреатобилиарной зоны, сопровождающимися нарушением проходимости желчных протоков, остаётся крайне актуальной ввиду неуклонного роста распространённости данной патологии [1]. Несвоевременное оказание медицинской помощи нередко становится причиной развития таких грозных осложнений, как механическая желтуха и холангит [2].
По данным различных исследований, холедохолитиаз выступает причиной механической желтухи в 50% случаев. Другие доброкачественные патологии внепечёночных желчных протоков, включая их стриктуры, стеноз большого дуоденального сосочка и псевдотуморозный панкреатит, становятся причиной желтухи в 12% случаев [3].
Активное внедрение малоинвазивных методов лечения механической желтухи, таких как эндоскопическая папиллосфинктеротомия, баллонная дилатация, стентирование и назобилиарное дренирование, позволило достичь значительных успехов в терапии данной патологии, минимизировав операционную травму [4; 5]. Однако выполнение данных методик не всегда возможно в связи с рядом факторов: парафатериальные дивертикулы, протяжённый (более 2,5 см) стеноз фатерова сосочка и терминального отдела холедоха доброкачественной и злокачественной этиологии, выраженная дилатация протоков, острый панкреатит небилиарной этиологии, резекция желудка в анамнезе и др. В связи с вышеуказанным, у 15-30% пациентов хирургическое вмешательство завершается формированием билиодигестивного анастомоза [6; 7]. Процесс заживления этого соустья всегда сопряжён с риском возникновения стриктуры. Так, традиционные способы формирования билиодигестивного анастомоза по Юрашу-Виноградову и Финстереру приводят к её развитию в 10-30% случаев [8].
Таким образом, разработка нового способа формирования билиодигестивного анастомоза, направленного на минимизацию риска стриктуры, остаётся важной и актуальной задачей современной хирургии.
Целью исследования был сопоставительный анализ морфологических особенностей и изменений микроциркуляции в области билиодигестивных анастомозов, созданных с использованием двух отличающихся хирургических техник.
Материалы и методы исследования
Экспериментальное исследование выполняли на 30 беспородных собаках с массой 15-30 кг. Все животные перед началом эксперимента проходили карантинный период продолжительностью 21 день, во время которого их ежедневно обследовал ветеринар для оценки общего состояния. Животных содержали в отдельных клетках с постоянным доступом к воде и гранулированному корму, чтобы исключить влияние индивидуальных физиологических особенностей на результаты эксперимента и стандартизировать условия регенерации билиодигестивного анастомоза, диагностические исследования проводили на одном и том же организме. Все хирургические процедуры проводил один и тот же хирург. Эксперимент был осуществлён с соблюдением норм лабораторной практики и стандартов методик исследования, в соответствии с Федеральным законом от 27.12.2018 № 498-ФЗ (ред. от 27.12.2019) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации» и был одобрен этическим комитетом Федерального государственного бюджетного образовательного учреждения высшего образования «Астраханский государственный медицинский университет» (ФГБОУ ВО «Астраханский ГМУ») Министерства здравоохранения России (протокол № 2022/141 от 17.06.2022 г.).
Модель механической желтухи животных создавали путём перевязки супрадуоденальной части общего желчного протока. На 3-и сутки после развития механической желтухи выполняли релапаротомию с ревизией внепеченочных желчных протоков. При ревизии обращал на себя внимание напряженный желчный пузырь, который пунктировали у дна с эвакуацией желчи.
В опытной группе (15 животных) после выделения желчного пузыря «от дна» выполняли резекцию желчного пузыря с оставлением части шейки желчного пузыря диаметром до 2 см, с сохранением пузырной артерии.
|
|
|
|
А |
Б |
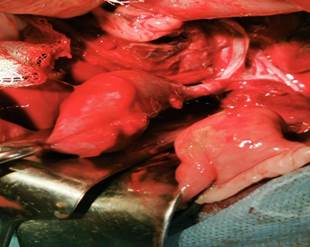
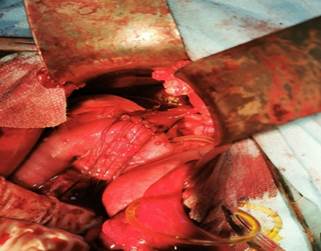
Рис. 1. Этапы холецистодуоденостомии: А - выделение желчного пузыря «от дна», Б - сформированный холецистоеюноанастомоз
Пузырный проток выделили до места впадения в общий желчный проток, затем бужировали пуговчатым зондом, соответствующим его просвету. После мобилизации двенадцатиперстной кишки по Кохеру выполняли дуоденотомию в поперечном направлении. Диаметр дуоденотомической раны не должен превышать диаметр оставшейся шейки желчного пузыря. Холецистодуоденальный анастомоз (ХЦДА) формировали однорядными узловыми швами рассасывающимся шовным материалом на атравматичной игле (Викрил 5/0). Шов проходил через серозно-мышечный-подслизистый слой стенки двенадцатиперстной кишки и серозно-мышечный слой культи шейки желчного пузыря. Расстояние между швами 2–3 мм [9].
В группе сравнения (15 особей) билиодигестивный анастомоз между холедохом и двенадцатиперстной кишкой накладывали «бок в бок» по методике Финстерера. Холедоходуоденоанастомоз (ХДА) шириной до 1,5 см накладывали однорядными узловыми атравматическими резорбируемыми швами (Викрил 5/0).
В контрольные сроки исследования (3, 7, 14, 30 суток) экспериментальных животных выводили из эксперимента путём внутривенного введения тиопентала натрия. В операционной проводили релапаротомию, оценивали степень выраженности спаечного процесса в гепатобилиарной зоне и расширение внепеченочных желчных протоков. Осуществляли забор органокомплекса, который состоял из печени, внепеченочных желчных протоков, двенадцатиперстной кишки и антрального отдела желудка. После завершения макроскопического анализа производили отбор образцов биопсии из областей сформированных анастомозов (для контроля и сопоставления). Полученные образцы подвергали фиксации в 10%-ном растворе формалина, затем осуществляли стандартную процедуру подготовки материала, включающую последовательную дегидратацию в спиртах с возрастающей концентрацией, пропитку парафином, помещение в парафиновые блоки и получение серийных срезов. Срезы подвергали депарафинизации, окрашиванию гематоксилином и эозином, а также по методу Ван Гизона. Патоморфолог, не осведомленный о принадлежности гистологических образцов к различным группам исследования, проводил микроскопическое исследование препаратов. Микроскопирование и фотодокументирование проводили с использованием морфометрического комплекса Leica DMR, Nicon Eclipse E400 с применением камеры Nicon DS-Fi2 и программного обеспечения NIS-Elements Basic Research. С целью оценки роли структурно-функциональной значимости клеток определяли их количество на площади 1 мм2 [10].
Для изучения микроциркуляции в области анастомоза использовали прибор «ЛАЗМА-МЦ» (НПО «ЛАЗМА», Россия). Непосредственно в зоне анастомоза выполняли сканирование с четырех противоположных точек (зона охвата 1 мм3). Измерения проводили на 3, 7 и 14-й день после хирургического вмешательства.
В ходе работы были изучены следующие параметры: показатель микроциркуляции (ПМ; усл. ед.), представляющий собой функцию концентрации эритроцитов в исследуемой области ткани и их усредненной скорости движения; среднее квадратическое отклонение (СКО; ϭ, усл. ед.), отражающее средний разброс значений перфузии относительно среднего значения ПМ и характеризующее временные изменения перфузии, а также отражающее усредненную вариабельность кровотока во всем диапазоне частот; и коэффициент вариации (Кv; %), определяющий отношение изменчивости перфузии к средней перфузии в зоне исследования, что указывает на вазомоторную активность сосудов. Помимо этого, вычисляли индекс эффективности микроциркуляции (ИЭМ; усл. ед.) по следующей формуле:
ИЭМ = АmaxLF/АmaxCF + AmaxHF,
где Amax обозначает максимальную амплитуду; LF – низкочастотные колебания кровотока; CF – пульсовые колебания; HF – высокочастотные колебания кровотока.
Полученные значения параметров в исследуемых группах сопоставляли с нормативными показателями, полученными из стенки двенадцатиперстной кишки, холедоха и желчного пузыря до хирургического вмешательства.
Статистическую обработку данных проводили с применением непараметрических статистик. Проверку нормальности распределения признаков осуществляли с помощью критерия Колмогорова - Смирнова. Описательная статистика признака включала медиану (Ме), указывали минимальные (min) и максимальные (max) значения признака. Кроме того, количественные параметры представляли в виде М±m, где М обозначает среднее арифметическое значение выборки, а m - стандартную ошибку среднего. Статистическую значимость оценивали с использованием U-критерия Манна-Уитни, а уровень значимости различий по отношению к контрольной группе считался статистически значимым при p< 0,05. Обработку и анализ собранных данных выполняли с использованием программного обеспечения Microsoft Office 2021 (США).
Результаты исследования и их обсуждение
Послеоперационных осложнений в ходе эксперимента не отмечалось. У всех собак, включенных в исследование, стул нормализовался в течение первых 24 часов.
При визуальном осмотре на 3, 7, 14 и 30-й дни эксперимента признаков воспаления брюшины, расхождения швов кишечника или гнойных образований в области соединения кишки обнаружено не было.
На 3-й день исследования в обеих группах в зоне анастомозов, макроскопически, были обнаружены локальные признаки отечности тканей и умеренные фибринозные наложения.
В зоне анастомозов на 3-и сутки исследования в обеих группах отмечались признаки экссудативного воспаления тканей как со стороны двенадцатиперстной кишки, так и культи шейки желчного пузыря и холедоха: разрушение компонентов слизистой оболочки, полнокровие сосудов, отёк, лейкоцитарная инфильтрация подслизистой основы. Следует отметить, что микроскопическая картина в обеих группах была схожая и статистически значимых изменений при морфометрическом анализе обнаружено не было.
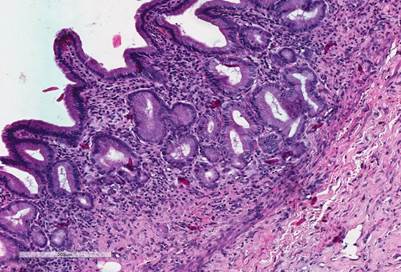
На 7-е сутки после оперативного вмешательства в обеих группах в зоне анастомоза отмечался отёк тканей. Также в группе с ХЦДА (опытная группа) было отмечено частичное восстановление слизистой оболочки, крипт и структур ворсинок двенадцатиперстной кишки (рис. 2А). В криптах отмечались многочисленные фигуры митоза, что свидетельствовало об активации процессов репарации тканей. В группе с ХДА (группа сравнения) было отмечено начало процессов коллагенизации, при этом сохранялись выраженное полнокровие сосудов, отёк, а также лейкоцитарная инфильтрации (рис. 2Б).
|
|
|
|
А |
Б |
|
|
|
|
Рис. 2. 12-перстная кишка собак в зоне анастомоза на 7-е сутки после операции. Окраска гематоксилином и эозином. Увеличение × 400. А - восстановление слизистой оболочки 12-перстной кишки после ХЦДА. Б - в зоне ХДА сохраняются полнокровие, отек и лейкоцитарная инфильтрация
|
|
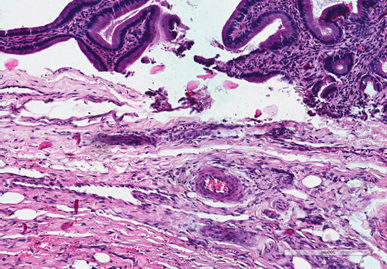
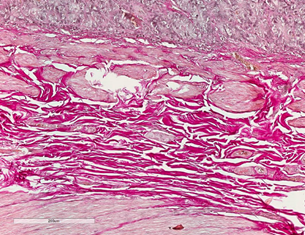
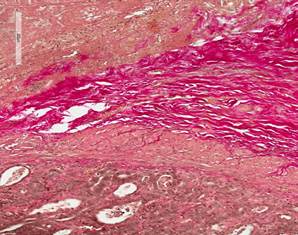
На 14-е сутки зона ХЦДА была представлена коллагеновым волокнами, что свидетельствовало о начале формирования соединительнотканного рубца (рис. 3А). В зоне ХДА были отмечены выраженные явления коллагенизации и фиброгенеза, признаки воспаления стихали как со стороны слизистой оболочки двенадцатиперстной кишки. Имела место нарастающая фуксинофилия, при этом коллагеновые волокна приобретали организованное направление (рис. 3Б).
|
|
|
|
А |
Б |
Рис. 3. 12-перстная кишка собак в зоне анастомоза на 14-е сутки эксперимента. Окраска по Ван Гизону. Увеличение × 320. А – в зоне ХЦДА коллагеновые волокна, начало формирования соединительной ткани. Б – в зоне ХДА выраженная коллагенизация с формированием соединительнотканного рубца
Далее на 30-е сутки в зоне ХЦДА отмечали умеренный фиброз тканей, с минимальными признаками воспаления. Сосудистый компонент был представлен сосудами, имеющими обычное строение. Определялись рубцовые соединения, которые были представлены соединительнотканными волокнами между стенкой двенадцатиперстной кишки и культей шейки желчного пузыря. В группе с ХДА имелись выраженные явление фиброза с формированием грубоволокнистой соединительной ткани. Явления воспаления носили более выраженный характер.
При анализе морфометрических данных в группах исследования общая клеточная плотность имела тенденцию к повышению на 7-е сутки после операции с дальнейшим плавным снижением к 30-м суткам (р>0,05). Количество нейтрофильных лейкоцитов на площади 1 мм2 статистически значимо повышалось в группе с ХДА на 7-е сутки после операции (р<0,05). В дальнейшем по мере стихания воспалительной реакции данный показатель прогрессивно снижался. Количество эозинофильных гранулоцитов в группах исследования имело тенденцию к повышению на 7-е сутки после операции, однако статистической разницы в значениях не выявлено (р>0,05). Количество фибробластов в параанастоматических тканях статистически значимо повышалось на 7-е сутки в группе с ХДА (р<0,05). Схожая тенденция была отмечена по количеству фиброцитов, которые статистически значимо повышались на 14-е сутки послеоперационного периода (р<0,05) (табл. 1).
Таблица 1
Динамика морфометрических показателей перианастомотических зон в группах исследования в различные сроки эксперимента
|
Показатели |
Опытная группа (n=15)
|
Группа сравнения (n=15) |
||||||
|
3-и сутки Ме min-max |
7-е сутки Ме min-max |
14-е сутки Ме min-max |
30-е сутки Ме min-max |
3-и сутки Ме min-max |
7-е сутки Ме min-max |
14-е сутки Ме min-max |
30-е сутки Ме min-max |
|
|
Общая клеточная плотность на 1 мм2
|
12321 10212-13897 |
13874 12633–14308 |
13245 12567-14276 |
10154 9453-12321 |
11987 10023-13267 |
14356 12678-15643 |
13245 12342-15234 |
11002 9563-12786 |
|
Нейтрофильные лейкоциты на 1 мм2 |
3423 2784-4012 |
2784 1934-3109 |
3034 2654-4786 |
1675 934-2015 |
3684 2043-4673 |
4329* 3984-5432 |
3452 2178-4231 |
1934 1067-2956 |
|
Эозинофильные гранулоциты на 1 мм2 |
1123 934-1945 |
1325 1123-2654 |
1154 1023-1389 |
1034 1003-1345 |
1154 1009-2134 |
1278 1034-2045 |
1182 1189-1389 |
1002 934-1287 |
|
Фибробласты на 1 мм2
|
164 92-278 |
184 104-278 |
193 113-304 |
121 94-198 |
234 198-298 |
356* 278-403 |
231 198-304 |
132 103-211 |
|
Фиброциты на 1 мм2 |
645 437-874 |
763 583-826 |
856 992-821 |
763 623-902 |
618 489-803 |
894 689-945 |
1892* 1289-2043 |
934 873-1189 |
* - показатели со значением изменений р<0,05 по сравнению с опытной группой
Все показатели, характеризующие микроциркуляцию в зоне анастомозов, в группах исследования на 3-и сутки послеоперационного периода были снижены по сравнению с референсными значениями. Отмечалось снижение уровня тканевой перфузии, а также угнетение вазомоторной активности капилляров, что связано в операционной травмой. На 7-е сутки послеоперационного периода в опытной группе отмечено достоверное повышение показателей ПМ и СКО по сравнению с группой сравнения (р<0,05). На 14-е сутки к вышеуказанным показателям присоединялись Kv и ИЭМ, которые были достоверно выше по сравнению с группой сравнения (р<0,05) (табл. 2).
Таблица 2
Показатели параанастоматической микроциркуляции в группах исследования (М±m)
|
Группы |
Показатели |
Референсные значения (n=15) |
3-и сутки |
7-е сутки |
14-е сутки |
|
Опытная (n=15) |
ПМ (п. е.) |
30,12±1,34 |
18,45±1,31 |
26,9±1,23* |
32,34±1,87* |
|
СКО (п. е.) |
4,91±0,87 |
2,34±0,45 |
3,99±0,19* |
5,02±0,17* |
|
|
Kv (%) |
11,89±1,39 |
6,78±0,93 |
9,89±1,76 |
11,86±3,21* |
|
|
ИЭМ (у. е.) |
1,43±0,08 |
0,87±0,07 |
1,38±0,06 |
1,69±0,14* |
|
|
Сравнения (n=15) |
ПМ (п. е.) |
30,12±1,34 |
16,04±2,32 |
18,15±1,67 |
20,23±2,05 |
|
СКО (п. е.) |
4,91±0,87 |
2,67±0,93 |
2,23±0,76 |
2,09±0,12 |
|
|
Kv (%) |
11,89±1,39 |
5,56±0,83 |
7,45±1,23 |
8,04±1,34 |
|
|
ИЭМ (у. е.) |
1,43±0,08 |
0,96±0,10 |
0,93±0,09 |
0,76±0,11 |
*- показатели со значением изменений р<0,05 по сравнению с группой сравнения.
Трудности в лечении больных с патологиями внепеченочных желчных путей нередко обусловлены образованием сужений (стриктур). В связи с этим анализ причин фиброзных изменений в области анастомоза крайне важен для объяснения неоптимальных результатов лечения [11]. Помимо технических аспектов хирургического вмешательства, на формирование стриктур влияет и воспалительный процесс, обусловленный желчной гипертензией и холангитом. Длительное повышение давления в желчных путях приводит к ишемии стенки и активации каскада воспалительных реакций, стимулирующих фиброгенез. Микроциркуляторные нарушения, вызванные воспалением, усугубляют гипоксию и способствуют отложению коллагена в области анастомоза [12; 13].
Одним из наиболее значимых вопросов является изучение воздействия морфологических характеристик структуры внепеченочных желчных путей. В отличие от других отделов пищеварительной системы, внепеченочные желчные пути не имеют подслизистого слоя, однако характеризуются развитой субсерозно-адвентициальной оболочкой, содержащей сосуды, обеспечивающие кровоснабжение стенки органа. Следовательно, обширная мобилизация стенок внепеченочных желчных протоков у пациентов с их заболеваниями может привести к нарушению кровоснабжения, гипоксии тканей и, как следствие, к формированию рубцовой ткани в зоне соединения, что вызывает стриктуру [14].
При формировании ХДА рекомендуется избегать циркулярной мобилизации стенок желчных протоков в пользу линейного рассечения протока без его полного выделения из окружающих тканей, что позволит минимизировать риск нарушения кровоснабжения [15]. Применение ХЦДА с сохранением a. cystica способствует поддержанию адекватного кровоснабжения области анастомоза, предотвращая кислородное голодание тканей и избыточное разрастание соединительной ткани с развитием фиброза и сужений [16]. Данное преимущество показывает перспективность предложенной методики и позволяет продолжить его разработку.
Заключение
Предлагаемая методика заключается в формировании билиодигестивного анастомоза между культей шейки желчного пузыря и двенадцатиперстной кишки. Данный способ позволяет в сравнительно ранние сроки купировать воспаление, поддержать адекватный уровень микроциркуляции, оптимизировать процессы регенерации и репарации в зоне анастомоза и предупредить формирование стриктур.