Введение
Несмотря на то что заболеваемость раком желудка (РЖ) неуклонно снижается на протяжении последних десятилетий, эта патология остается важной медицинской проблемой и входит в число самых распространенных видов рака в мире. Согласно статистике GLOBOCAN, РЖ занимает пятое место как по заболеваемости, так и по смертности среди онкозаболеваний. В нескольких странах Южной и Центральной Азии (Афганистане, Кыргызстане, Иране и Таджикистане) у мужчин это самый частый вид рака и основная причина смерти от рака. Самые высокие показатели заболеваемости наблюдаются в Восточной Европе и Восточной Азии, а самые низкие – на африканском континенте [1].
Более 90% случаев РЖ диагностируются как аденокарциномы, которые возникают из клеток желез слизистой оболочки желудка [2, 3]. Остальные злокачественные опухоли этой локализации являются лимфомами, развивающимися из лимфоцитов (в основном из В-клеток, очень редко – из Т-клеток), или саркомами – из желудочно-кишечной стромальной ткани [3]. Топографически РЖ можно классифицировать как некардиальный (нижний отдел желудка) и кардиальный (верхний отдел желудка). Основная причина некардиального РЖ предположительно связана с хронической инфекциейH. pylori.Кроме того, на развитие заболевания могут повлиять и другие факторы: возраст, наследственность, употребление алкоголя, курение [4, 5].
Лечение РЖ может включать хирургическое вмешательство, лучевую и таргетную терапию, пред- (неоадъювантную) и послеоперационную (адъювантную) химиотерапию. В последнем случае основными применяемыми препаратами являются оксалиплатин/цисплатин и 5-фторурацил (5-FU)/капецитабин [3, 6]. Перечисленные лекарственные средства доказали свою противоопухолевую эффективность, а также продлевали жизни пациентов и улучшали качество их жизни [7]. Общий показатель выживаемости больных РЖ показал тенденцию к росту. В периодах 2007–2011, 2012–2016 и 2017–2021 гг. он составил 38,3%, 40,6% и 42,9% соответственно. Однако стоит учитывать значительные различия в выживаемости в зависимости от пола, возраста, расы, первичной локализации, стадии и социально-экономического статуса. В частности, выживаемость больных РЖ на поздней стадии остается очень низкой (менее 10%) [8]. Поэтому, несмотря на успехи в лечении заболевания, поиск и внедрение новых веществ для терапии РЖ являются актуальной задачей.
Трополоны – небензольные ароматические соединения, содержащие уникальный циклогепта-2,4,6-триеноновый фрагмент, в последние года представляют значительный экологический и фармацевтический интерес. Повышенное внимание к этим веществам объясняется наличием у них разнообразных биологических свойств, включая противомикробную, противовирусную и противоопухолевую активность. Одними из примеров таких природных продуктов могут служить стипитатовая кислота, выделенная из Penicillium stipitatum, колхицин, полученный из лекарственного растения безвременника Colchicum autumnale, и β-туяплицин, или хинокитиол, обнаруженный в сердцевине Chamaecyparis taiwanensis [9]. Последнее вещество в недавних работах показало свою противоопухолевую эффективность в исследованиях in vitro. В работе А. Roy с соавт. β-туяплицин продемонстрировал сильное цитотоксическое действие на опухолевой линии рака полости рта KB-1, приводя к морфологическим изменениям клеток – сморщиванию и снижению их плотности. Проточная цитометрия показала апоптоз клеток в фазах S и gap-2/митоз (G2/M) по причине фрагментации ДНК [10]. В другом исследовании хинокитиол дозозависимо влиял на жизнеспособность клеток остеосаркомы человека MG-63. Тест на скорость зарастания дефекта монослоя выявил значительное снижение подвижности опухолевых клеток, тем самым было показано, что трополон предотвращает их миграцию [11].
В предыдущей публикации авторами этой статьи было показано цитотоксическое действие 2-(1,1-диметил-1hбензо[e]индолин-2-ил)-5,6,7-трихлор-1,3-трополона (JO-122 (2)) на клеточную линию человеческой аденокарциномы желудка AGS [12]. Поэтому целью настоящей статьи является исследование противоопухолевого эффекта трополона JO-122 (2) на PDX-модели аденокарциномы желудка.
Материалы и методы исследования
Протокол исследования был одобрен биоэтической комиссией ФГБУ «НМИЦ онкологии» Минздрава России (№ 7/225 от 06.09.2024). Работа была выполнена на 32 самках мышей линии Balb/c Nude в возрасте 4–7 недель и весом 18,5–24 г. Животные содержались в SPF-зоне вивария при температуре 21–23°С и влажности 40–70% со свободным доступом к стерильным корму и воде.
В исследовании использовали опухолевые фрагменты 4-го пассажа размером 2×2×2 мм из собственной коллекции ФГБУ «НМИЦ онкологии» Минздрава России. Изначально донорский материал (биоматериал для 1-го пассажа) был получен от пациента с диагнозом РЖ (от больного было получено информированное согласие). Препарат животным был введен подкожно в правый бок под анестезией (премедикация – рометар с концентрацией 20 мг/мл в дозе 1,5 мл/кг, или 30 мг/кг, анестезия – золетил в дозе 67,5 мг/кг). Замеры опухолевых узлов выполняли 2 раза в неделю. Их объем высчитывали по формуле:
V=LW2/2,
где L, W, – линейные размеры опухоли (мм).
Введение препаратов начали после достижения опухолевыми узлами объемов объема 70–100 мм3. Группа 1 получала перорально трополон JO-122 (2) в концентрации 20 мг/кг, предварительно разведенный в 1%-ном крахмальном геле, 3 раза в неделю. Соединение было синтезировано в научно-исследовательском институте физической и органической химии Южного федерального университета. Группа 2 получала 5-FU (ООО «ЛЭНС-Фарм», Россия) внутрибрюшинно в дозе 25 мг/кг 2 раза в неделю. В 3-й группе животные получали комбинацию этих препаратов (JO-122 (2) + 5-FU). Контрольной группе вводили перорально стерильную воду и внутрибрюшинно 0,9%-ный раствор NaCl. Оценку изменения динамики роста опухолевых узлов, взвешивание и наблюдение за состоянием животных проводили в течение 29 дней после начала лечения. Оценку противоопухолевой эффективности трополона JO122-(2) как в монотерапии, так и в комбинации вычисляли по формуле торможения роста опухоли (ТРО):
ТРО (%) = (Vк – Vo) / Vк × 100%,
где Vк и Vo – средний объем опухоли (мм3) в контрольной и опытной группе соответственно. На 30-е сутки животных подвергали эвтаназии методом дислокации шейных позвонков, выделяли и взвешивали опухолевые узлы.
Статистическую обработку проводили при помощи пакета программ Microsoft Excel 2013 и STATISTICA 12. Полученные данные были проверены на нормальность тестом Шапиро–Уилка, который показал нормальное распределение, что оправдывает использование параметрического t-критерия Стьюдента. Для контроля уровня семейной ошибки при проведении множественных сравнений была применена поправка Бонферрони. Значения вероятностиp<0,05 считали статистически значимыми. Данные представлены в виде среднего арифметического и стандартного отклонения.
Результаты исследования и их обсуждение
В ходе работы были получены данные о динамике роста подкожных опухолевых узлов аденокарциномы желудка при воздействии 5-FU и JO-122-(2) в монотерапии, в комбинации данных препаратов, а также в группе контроля. Было отмечено, что применение трополона JO122-(2) в монотерапии на животных-опухоленосителях не вызывало статистически значимого уменьшения размеров опухолей. На момент окончания эксперимента объем опухолевых узлов в данной группе составил 733,12±48,97 мм3, что в 1,06 раза меньше, чем в контроле. В группе контроля на момент окончания эксперимента опухолевые узлы достигали объема 779,01±58,14 мм3. В группе с введением 5-FU отмечали значимое отличие от контроля начиная с 25-х суток от начала введения веществ. На момент окончания эксперимента в данной группе среднее значение объема опухолевых узлов составило 566,17±31,07 мм3, что в 1,37 раза меньше контроля. В группе с введением комбинации препаратов 5-FU и JO-122(2) значимое отличие от контроля отмечали начиная с 18-х суток эксперимента. На момент окончания эксперимента опухоли достигли среднего объема – 446,17±64,86 мм3, что было в 1,75 раза меньше контроля. Данные, демонстрирующие динамику роста опухолевых узлов, представлены на рисунке 1.
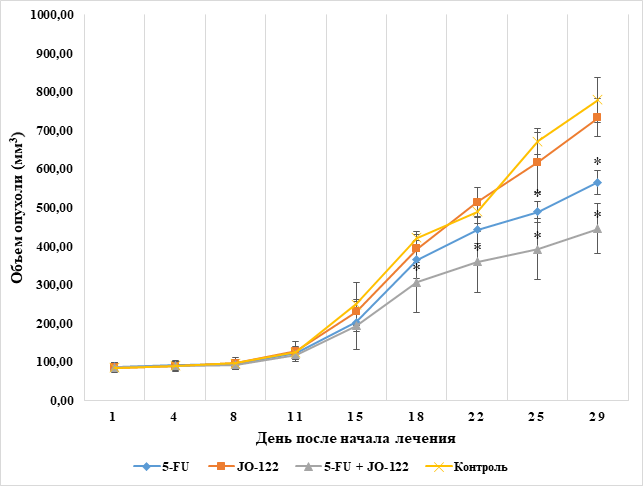
Рис. 1. Динамика изменения средних объемов опухолевых узлов в группах (составлено авторами)
Примечание: * – различия являются статистически значимыми при p<0,05 по сравнению с контролем
В ходе работы были получены значения индекса ТРО. Наибольшее значение индекса ТРО (52,73%) имело место в группе с воздействием комбинации препаратов 5-FU и JO-122-(2). Наименьшее значение индекса ТРО отмечали в группе с воздействием исследуемого вещества JO-122-(2) в монотерапии. Его значение составило 5,89%. Значение индекса ТРО для группы с введением 5-FU в монотерапии составило 27,32%. Данные о полученных значениях ТРО представлены в гистограмме на рисунке 2.
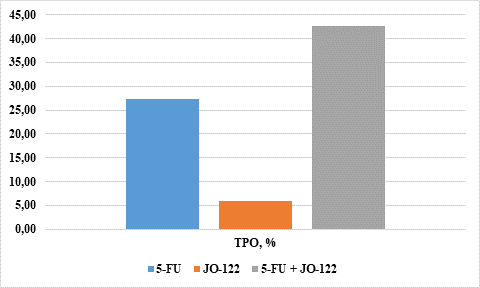
Рис. 2. Значения индекса ТРО при различных вариантах лечения (составлено авторами)
Также в данной работе была проведена оценка динамики изменения массы животных (рис. 3). Значимых отличий массы животных в экспериментальных группах по отношению к контролю выявлено не было. Мыши были умеренно активны, состояние кожного покрова оставалось удовлетворительным. В течение всего эксперимента не наблюдалось признаков отравления и гибели животных.
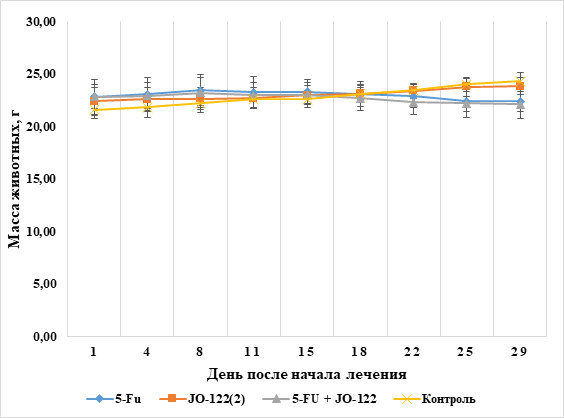
Рис. 3. Динамика изменения средних масс животных в группах (составлено авторами)
В текущем исследовании трополон JO-122-(2) в монотерапии на животных-опухоленосителях не показал статистически значимого уменьшения размеров опухолей по сравнению с контрольной группой. Однако в работе Y.J. Wu с соавт. трополон хинокитиол в монотерапии оказывал ингибирующее действие на CDX-модели мышиной меланомы (B16F10) и рака молочной железы (4T1), вызывая уменьшение веса и размера опухолевых узлов, а также увеличивал продолжительность жизни животных. Авторы отмечали, что хинокитиол может оказывать ингибирующее действие на экспрессию гепараназы – фермента, способствующего инвазии и миграции опухолевых клеток, путем снижения фосфорилирования протеинкиназы B (Akt) и внеклеточной регулируемой протеинкиназы (ERK) [13].
Полученные результаты свидетельствуют о более высокой эффективности комбинации исследуемых веществ (5-FU и JO-122-(2)). Данные, подтверждающие эту гипотезу, были получены в работе Y.J. Ni с соавторами [14], где изучали свойства производного трополона – хинокитиола – в отношении опухолевых клеток CT 26 и B16F10 в комбинации с терапией 5-FU. В работе было показано на этапах in vitro и in vivo, что хинокитиол усиливает эффективность стандартной терапии 5-FU, значимо снижая опухолевый рост в сравнении с контролем. Также в работе [15] P. Bai с коллегами оценивали потенциал хинокитиола как противоопухолевого препарата в отношении внутрипеченочной холангиокарциномы в монотерапии и в комбинации с палбоциклибом. В данной работе исследователи отмечали, что хинокитиол эффективно подавляет пролиферацию опухолевой сферы in vitro, ингибируя экспрессию путей ERK и P38, однако наиболее выраженный эффект снижения количества опухолевых клеток линии ICC наблюдали при комбинации хинокитиола и палбоциклиба, что позволило исследователям отметить перспективность изучения противоопухолевых свойств хинокитиола в комбинации с паблоциклибом [15].
Результаты исследований зарубежных авторов согласовываются с полученными в этой работе данными об усилении трополоном JO-122-(2) противоопухолевой эффективности стандартной терапии. Требуются дальнейшие исследования трополона, в том числе его предполагаемых механизмов действия.
Заключение
Таким образом в работе было выявлено, что 2-(1,1-диметил-1h-бензо[e]индолин-2-ил)-5,6,7-трихлор-1,3-трополон в монотерапии не проявляет значимого противоопухолевого эффекта в отношении клеток аденокарциномы желудка на PDX-моделях. Однако было установлено, что при комбинированном лечении с 5-FU, JO-122-(2) оказывает значимый противоопухолевый эффект в отношении подкожных ксенографтов. В совокупности с полученными экспериментальными данными и проанализированными источниками литературы можно заключить, что трополон JO-122-(2) является перспективным для дальнейшего изучения веществом и требуются дальнейшие исследования его свойств при сочетании со стандартной терапией в сравнительных экспериментах на различных опухолевых моделях.



