Введение
В структуре генетически обусловленных вариантов ожирения синдром Прадера–Вилли (СПВ) занимает лидирующую позицию. Данный синдром регистрируется с частотой 1 случай на 10–30000 живых новорожденных и возникает вследствие повреждения одного или нескольких генов в проксимальной части длинного плеча отцовской 15-й хромосомы или дисомией по 15-й материнской хромосоме [1, 2, 3]. Клинические проявления характеризуются не только неконтролируемой гиперфагией с развитием ожирения, но и задержкой роста, психомоторного и умственного развития (характерны затрудненная речь, скудный словарный запас, эмоциональная лабильность), гипогонадизмом (у мальчиков – гипоплазия полового члена и мошонки, крипторхизм; у девочек – недоразвитие половых губ и в 50% случаев – недоразвитие матки), а также апноэ во сне [1, 4, 5]. Фенотипические признаки синдрома включают ряд врожденных аномалий развития, таких как: микроцефалия, высокое готическое нёбо, микродантия, гипоплазия ушных раковин, синдактилия, клинодактилия, сколиоз, поперечная ладонная складка, нарушение координации, судороги и страбизм, а также симптомы сахарного диабета [6, 7]. Для детей с СПВ в период новорожденности характерны скудное питание в результате ослабленных сосательного и глотательного рефлексов; на втором году жизни они начинают прибавлять в весе с развитием ожирения и повышенного аппетита [8, 9].
Применение рекомбинантного гормона роста (р-ГР) для лечения ожирения, метаболических нарушений и недостаточности роста у больных СПВ в настоящее время являются сферой научно-практического интереса мирового сообщества [10, 11, 12]. С учетом того, что в России подобных исследований проводилось немного, даже отдельные клинические наблюдения на небольших выборках пациентов представляют ценность и могут служить обоснованием для обеспечения доступности данной терапии.
Цели исследования: описание клинического случая синдрома Прадера–Вилли с применением терапии соматотропином и оценка ее безопасности и эффективности.
Материалы и методы: клиническое наблюдение.
Результаты и их обсуждение
Пациент Л., 3 года. Ребенок от 4-й беременности в 36 лет, третьих родов, предыдущие беременности закончились: первая и вторая – срочными родами, третья – прерыванием по медицинским показаниям в сроке 19 недель вследствие диагностики синдрома Дауна. Беременность протекала с угрозой прерывания на 10–11-й неделе, рожден на сроке 38 недель мальчик весом 2810 г, ростом 52 см, 8/9 баллов по шкале Апгар.
Состояние при рождении удовлетворительное, но, со слов матери, сразу не закричал, сосал вяло, неохотно; мышечная гипотония, гипорефлексия, крипторхизм, потеря в весе за 4 дня – 180,0 г. На 4-й день жизни переведен в отделение патологии новорожденных (ОПН). При поступлении в ОПН состояние средней степени тяжести: отмечались вялость, снижение реакции на осмотр, глаза не открывал, мышечная гипотония, гипорефлексия, отказ от груди, кормление из бутылочки с докормом через зонд из-за вялости сосания, но вес набирал достаточно. Описаны: долихоцефалическая форма головы, клювовидный нос, широкий язык, массивные десны, умеренный акроцианоз кистей и стоп, мошонка гипоплазирована, яички в мошонку не опущены, со стороны остальных органов и систем – без особенностей. За первый месяц набрал 715,0 г (3545 г), вырос на 5 см (57 см). По данным ультразвукового исследования (УЗИ) мошонки в возрасте 1 месяц – яички не визуализируются. При проведении магнитно-резонансной томографии головного мозга с контрастированием данных за очаговую патологию не выявлено. Наследственные болезни обмена были исключены.
В возрасте 4 месяцев в лаборатории «Genetico» были выявлены ранее описанная гетерозиготная мутация в 3-м экзоне гена C10orf1 (chr10:101750131A>G, rs80356540) и ранее не описанная гетерозиготная мутация в 11-м экзоне гена DYNC1H1 (chr14:101460630_101460631delinsTT), требовавшие тщательного сопоставления с клиническими признаками и анализа происхождения мутаций. В возрасте 5 месяцев в Федеральном государственном бюджетном научном учреждении «Медико-генетический научный центр имени академика Н.П. Бочкова» у ребенка были выявлены молекулярно-генетические изменения, характерные для синдрома Прадера–Вилли (отсутствие неметилированного аллеля промоторной области гена SNRPN).
УЗИ пахово-мошоночной области в возрасте 6 месяцев подтвердило эхо-признаки пахового крипторхизма: оба яичка расположены в средней трети паховых каналов V – 0,5/0,4 куб. см с обеих сторон. В 7 месяцев по результатам консультации у главного внештатного специалиста по медицинской генетике был сформулирован окончательный диагноз: синдром Прадера–Вилли (МКБ-10; Q 87.1) в сочетании с изменениями в митохондриальной ДНК.
При объективном осмотре ребенка в возрасте 8 месяцев: рост 68 см, масса 7100 г, индекс массы тела (ИМТ) =15,57 кг/м2, SDS (Standard Deviation Score – число стандартных отклонений фактической величины от популяционного среднего) роста – 0,51, SDS ИМТ – 1,31. Состояние средней степени тяжести за счет проявлений синдромальной патологии, самочувствие страдало в меньшей степени. Телосложение нормостеническое, отмечалась долихоцефалическая форма черепа, кисти и стопы несколько уменьшены в размерах. Эмоционально позитивен, зрительный контакт хороший. Мышечная гипотония постоянного характера, опору на стопу не давал, мышечная сила снижена, хватательный рефлекс переменный, при подъеме за ручки не присаживался. Подкожно-жировой слой выражен умеренно, распределен равномерно. Шея укорочена, щитовидная железа не пальпируется. Дыхание пуэрильное. Тоны сердца ясные, громкие, ритмичные. Живот мягкий, печень +1,0 см выступала из-под края реберной дуги, край печени ровный, эластичный, безболезненный. Стул в норме. Диурез не увеличен. Половое развитие: мошонка гипоплазирована, подтянута, гонады объемом не более 0,5 см3 пальпируются у выхода из пахового канала при активном низведении. Отмечается сужение крайней плоти без деформации и без дистопии мочеиспускательного канала.
Выставлены основной диагноз: синдром Прадера–Вилли (Международная классификация болезней, 10-й пересмотр; Q 87.1) в сочетании с изменениями в митохондриальной ДНК и сопутствующий: двусторонний крипторхизм, паховая форма.
Была рекомендована терапия соматотропином 0,35 мг/сут и с целью коррекции крипторхизма – курсовое применение хорионического гонадотропина человека 500 ЕД внутримышечно 1 раз в неделю № 5–10 с дальнейшей оценкой его эффективности и выбором тактики хирургической орхидопексии до 2-летнего возраста.
Терапия соматотропином стартовала в возрасте 10 месяцев. По данным полисомнографического исследования в возрасте 1 года – апноэ не зарегистрированы, базовый уровень сатурации – 98%.
Через 1 год терапии соматотропином пациент осмотрен в возрасте 1 год 10 месяцев. Объективно: рост 97 см, вес 15,8 кг, ИМТ 16,3 кг/м2, SDS роста +0,69, SDS ИМТ +0,87. Реакция на осмотр адекватная, эмоции богатые, слова коверкает, но старается произносить. Нормостенического типа телосложения. Голова крупная. Кожа смуглая. Двигательная активность достаточная, мышечный тонус слегка снижен, ходит активно, но группируется небыстро, поэтому склонен к падениям. Слизистые естественной окраски. Зубная формула соответствует возрасту. Щитовидная железа не пальпируется. Дыхание везикулярное, тоны сердца несколько приглушены, ритмичные, 98 в минуту. Живот мягкий. Физиологические отправления в норме. Мошонка гипоплазирована, гонады слева не пальпируются, справа – у выхода из пахового канала, консистенция близкая к «водяночной». Начал посещать детское дошкольное учреждение, адаптировался хорошо. Лабораторные данные, представленные в динамике в таблице 1, демонстрировали отсутствие отклонений от референсных значений уровня тиреоидных гормонов, пролактина, показателей углеводного обмена, но отмечалось повышение концентрации соматомедина: от отрицательных значений SDS инсулиноподобного фактора роста-1 (ИФР-1) при первом обращении (–3,77) до резко положительных (+3,5, +1,98, +1,8) при применении гормона роста.
Таблица 1
Динамика лабораторных показателей пациента на фоне терапии соматотропином
|
Исследованные показатели |
Возраст |
Реф. значения* |
|||
|
5 месяцев |
1 год 5 месяцев |
1 год 8 месяцев |
1 год 10 месяцев |
||
|
Трийодтиронин (Т3) свободный, пмоль/л |
4,7 |
|
|
|
3,6–7,5 |
|
Тироксин (Т4) свободный, пмоль/л |
11,68 |
11,16 |
11,16 |
|
11,41–11,89 |
|
Тиреотропный гормон (ТТГ), мЕД/мл |
1,16 |
1,63 |
1,61 |
1,5 |
0,73–4,77 |
|
Соматомедин-С (ИФР-1), нг/мл |
19,9 (SDS ИФР -3,77) |
133 (SDS ИФР +3,5) |
101 (SDS ИФР +1,98) |
139 (SDS ИФР +1,8) |
–1,0≤SDS ИФР ≤ 1,0 |
|
Инсулин, меЕд/мл |
|
7,1 |
1,7–10,4 |
||
|
Глюкоза, ммоль/л |
|
4,7 |
3,3–5,5 |
||
|
Гликированный гемоглобин (НвА1с), % |
|
4,7 |
4,5–6,0 |
||
|
Кортизол, нмоль/л |
|
130 |
101–535 |
||
|
Пролактин, мЕд/л |
|
185 |
73–405 |
||
Примечание: *– референсные значения
По данным УЗИ пахово-мошоночной области в возрасте 1 года 10 месяцев описаны гидроцеле справа и крипторхизм (паховая форма) слева. Проведено рентгенологическое исследование, по результатам которого костный возраст соответствовал хронологическому.
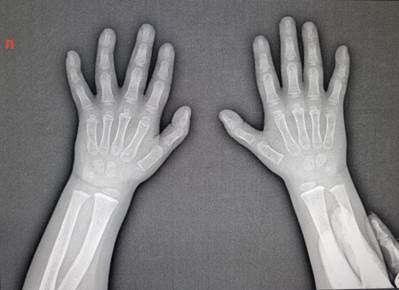
Рентгенографическое исследование кистей и лучезапястных суставов пациента на фоне применения терапии соматотропином продолжительностью 1 год
Для оценки состава тела была проведена биоимпедансметрия пациента на аппарате InBody770 (Корея), позволившая сравнить параметры состава тела у пациента с СПВ, находившегося на терапии, с параметрами ребенка такого же пола и возраста без СПВ. Основные показатели, характеризующие количество жировой ткани, площадь висцерального жира, скелетно-мышечную массу, протеины и минералы, оказались схожи.
Таким образом, терапия с применением р-ГР 0,35 мг/сут с первого года жизни у пациента обеспечила соответствие антропометрии и характеристик костного возраста возрастным нормам, уменьшение мышечной гипотонии, что позволило компенсировать основные проявления синдрома и начать социальную адаптацию пациента.
Большинство проявлений СПВ, согласно литературным источникам, поддаются лечению гормоном роста. Рекомендации зарубежных консенсусов по ведению пациентов с СПВ базируются на мнении, что дефицит соматотропина является постоянным проявлением СПВ, который не нуждается в дополнительном подтверждении для применения терапии рекомбинантного гормона роста [13].
Четко сформулированные принципы дозирования соматотропина с постепенным контролируемым повышением дозы крайне важны для практического мониторинга и лечения СПВ, особенно в детской популяции. Кроме того, внедрение методов профилактики развития факторов, негативно влияющих на респираторный тракт и утяжеляющих нарушения дыхания, безусловно, может способствовать снижению частоты самых опасных осложнений. Изучение патологии костной ткани при СПВ также важно для оценки и контроля эффективности и безопасности терапии р-ГР и повышения качества жизни.
На фоне проведения гормональной терапии соматотропином 0,35 мг/сут с первого года жизни у пациента, находившегося под клиническим мониторингом авторов, рост и вес соответствовали возрастным нормам, но наблюдались мышечная гипотония легкой степени тяжести, гидроцеле справа и крипторхизм слева. Лечение на сегодняшний день продолжено. Несколько настораживают повышенные значения SDS ИФР-1 на фоне терапии без данных за ускорение костного созревания или излишнее прогрессирование SDS роста, что требует обобщения групповых данных таких пациентов и сопоставления с клиническими характеристиками. Авторы надеются, что адекватное наблюдение и максимальное соответствие принципам стратегии «лечения до достижения цели» позволят в дальнейшем избежать прогрессирования проявлений заболевания, улучшить параметры физического развития, силы и активности, профилактировать ожирение, сохранять полноценную респираторную функцию.
Заключение
Отсутствие национального консенсуса по применению гормона роста у детей с синдромом Прадера–Вилли ограничивает возможности таких пациентов в полноценной реабилитации и повышении качества жизни.



