Введение. Спонтанное гипертензивное внутримозговое кровоизлияние принято считать наиболее тяжелым вариантом инсульта, определяющим 40%-ную летальность в ближайшие 30 дней от дебюта заболевания. Только не более 20% выживших через 6 месяцев после инцидента не нуждаются в постороннем уходе и могут себя обеспечивать [1, 2]. Многочисленные исследования определили широкий спектр предикторов исходов острого внутримозгового кровоизлияния, послуживших базой для формирования моделей прогноза смертности и функционального исхода [3–5]. Врачи, пациенты и их семьи часто желают уже в начале лечения иметь представление о его длительности и конечном итоге. Однако существующие прогностические модели предвзяты, и ни одна из них не имеет удовлетворительной точности [6]. Это особенно актуально в отношении пациентов, планируемых на хирургическое лечение – эвакуацию гематомы.
Интенсификация процесса оказания медицинской помощи в условиях все нарастающего объема медицинской информации, обусловленного ростом числа специализированных и дополнительных методов исследования, диктует необходимость использования в ходе рутинного медицинского анализа специализированных инструментов, минимизирующих риски принятия сомнительных решений. Эта сентенция особенно актуальна для неотложной хирургии в связи с дефицитом времени на диагностические мероприятия и неструктурированностью среды как источника информации. Одним из способов решения этой проблемы являются разработка и внедрение в практику систем поддержки принятия врачебного решения как одного из главных направлений использования искусственного интеллекта в медицине [7]. В зависимости от принципов их формирования такие системы связывают либо общепринятые базисные медицинские знания в отношении конкретной болезни, либо результаты клинических исследований с данными в отношении конкретного пациента и влияют на выбор хирургической технологии для оптимального исхода заболевания. В этом исследовании авторы попытались создать точные модели прогнозирования исходов операций по удалению гипертензивных внутричерепных гематом.
Цель исследования. Разработать систему поддержки принятия врачебного решения для прогноза исходов хирургического лечения гипертензивных внутричерепных гематом с использованием нейронных сетей.
Материалы и методы исследования. Для решения поставленной задачи был проведен ретроспективный анализ результатов обследования и лечения 226 больных, оперированных в Республиканской больнице с 01.01.2008 г. по 31.12.2016 г., и 154 больных, пролеченных с 01.01.2017 г. по 31.12.2023 г. В исследования не были включены больные с другими формами кровоизлияний (аневризма, травма, вторичные кровоизлияния и кровоизлияния в опухоль), кровоизлияниями в заднюю черепную ямку и ствол мозга, с грубыми мнестическими нарушениями, предшествовавшими сосудистой катастрофе. Дальнейшее обучение нейронной сети и апробация достоверности предсказания результата хирургического лечения проводились в течение 2017–2023 гг.
Исходные данные для анализа были получены с помощью информационной системы «Электронная медицинская карта» РМИС, разработанной компанией ООО «Алькона» для медицинских учреждений (рис. 1). Хранение и обработка результатов исследований осуществлялись на основе базы данных, реализованной с помощью пакета прикладных программ Microsoft Excel для операционной системы Microsoft Windows.
Рис. 1. Интерфейс системы сбора данных (составлено авторами)
Результаты исследования и их обсуждение. Совместно с сотрудниками ФГБОУ ВО «Чувашский государственный университет им. И.Н. Ульянова» была разработана система поддержки принятия врачебного решения (СППВР) с использованием методик машинного обучения и нейронных сетей, представленная в виде прогностической модели исхода хирургического лечения.
После анализа природы собранной информации была проведена предобработка данных, в том числе удаление пропусков и анализ категориальных признаков. Выделены данные до операции: возраст, пол, место жительства, время от появления симптомов до госпитализации, время начала оперативного лечения, гипертоническая болезнь (ГБ), сахарный диабет (СД), речевые нарушения, шкалы комы Глазго (ШКГ) при поступлении, гемипарез при поступлении, стволовая симптоматика, сопутствующие заболевания, количество тромбоцитов, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), протромбиновый индекс (ПТИ), объем гематомы в миллилитрах, ее локализация, смещение срединных структур. Данные об исходе операции были заменены на два класса: Live; Death.
В случае невозможности определения момента наступления дебюта заболевания (начала проявления симптомов инсульта) за точку отсчета принимали время, когда пациента последний раз видели здоровым. Объем гематомы вычисляли по формуле: (A+B+C)/2 +5%, где А и В – перпендикулярные диаметры в области наибольшего размера гематомы (в сантиметрах), а С – толщина гематомы = (число срезов КТ, на которых определяется гематома) х (толщина срезов).
Количественные показатели оценивали на нормальность распределения и описывали с помощью средних арифметических и стандартных отклонений, а также медиан и квартилей.
Наличие категориальных признаков представляет сложность для анализа данных, а мультикатегориальные признаки требуют добавления новой информации для их учета в алгоритмах машинного обучения. Преобразование проводили с использованием технологии One-Hot Encoding для категориальных признаков и Multi Label Binarizer для мультикатегориальных признаков. Значения признаков в исходном наборе были преобразованы в числовые значения и требовали обратной перекодировки для применения алгоритма Multi Label Binarizer. Другие категориальные признаки были оставлены без изменения, они уже были ранжированы в карте обследования операции.
После применения Multi Label Binarizer была построена корреляционная матрица, которая после выполнения расчета в программе STATGRAPHICS выглядит следующим образом (рис. 2).
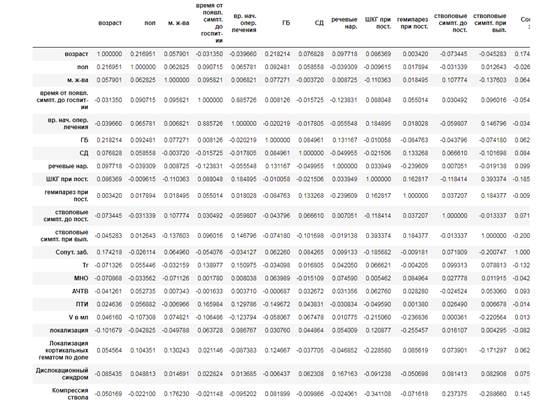
Рис. 2. Матрица корреляции (составлено авторами)
На основании данной матрицы можно сделать вывод, что наибольшую значимость имеют следующие признаки: возраст; время от дебюта заболевания до начала операционного лечения; ШКГ при поступлении; объем гематомы в миллилитрах; локализация кортикальных гематом по доле; количество тромбоцитов; МНО; АЧТВ; ПТИ; гипертоническая болезнь (табл. 1).
Таблица 1
Перечень показателей с вероятным положительным влиянием на исход хирургического лечения
|
Признаки |
Коэффициент корреляции |
|
Возраст |
0,229 |
|
Время от начала болезни до операции в часах |
0,0789 |
|
ШКГ при поступлении
|
0,353 |
|
Объем гематомы в миллилитрах
|
0,077 |
|
Локализация кортикальных гематом по доле |
0 |
|
Количество тромбоцитов
|
0,259 |
|
МНО |
0,5 |
|
АЧТВ |
0,25 |
|
ПТИ |
0,5 |
|
Гипертоническая болезнь
|
0,259 |
Примечание: составлено авторами
Далее в результате применения методов машинного обучения (многослойный персептрон) были проведены серии вычислений для определения набора оптимальных признаков. В совокупности полученных результатов оптимальным оказалось использовать набор из 6 признаков, таких как: возраст, время от появления симптомов болезни до начала операционного лечения, ШКГ при поступлении, количество тромбоцитов, АЧТВ, ПТИ.
В значительной степени этого удалось достичь благодаря предварительной обработке данных и извлечению новых признаков (рис. 3).

Рис. 3. Окно пользовательского интерфейса программы (составлено авторами)
Для оценки качества модели была применена кросс-валидация (метод оценки аналитической модели и ее поведения на независимых данных) на 10 блоках, при тестовой выборке 30%. Перекрестная проверка (кросс-валидация, Cross-validation) представляет собой метод оценки обобщающих способностей аналитической модели на независимых данных. Суть подхода заключается в том, что исходный набор данных разделяется на k равномерных подмножеств (folds). При этом в каждом из k циклов модель обучается на объединении k – 1 частей, а оставшаяся часть используется для тестирования. Такой процесс повторяется до тех пор, пока каждая из частей не будет применена в качестве тестовой выборки. Итоговая эффективность модели определяется как среднее арифметическое показателей, полученных на всех этапах тестирования, что обеспечивает наиболее сбалансированное использование имеющихся данных при оценке качества модели. В нашей работе точность предсказания составляет более 87%.
Проверка достоверности СППВР проведена на проспективном материале (154 больных) в виде законченных эпизодов лечения пациентов с геморрагическим инсультом. В итоге разработанная СППВР позволяет предсказать вероятность летального исхода и выздоровления с точностью до 93% и 87% соответственно.
В течение почти полувекового периода формирования концепции СППВР отношение к ней менялось от восторженного до откровенно нигилистического. В настоящее время прежний энтузиазм, подпитываемый сторонниками применения искусственного интеллекта, ратующими за замену врачебного мышления, опыта и знаний элементами машинного обучения, сменился трезвым взглядом на использование этого технологического решения. Последнее предполагает его применение как дополнительное подтверждение правильности выбора тактики лечения, особенно в случаях агрессивных его методов. Например, в сложных случаях расшифровки данных нейровизуализации допускается заменять решением программного пакета на основе искусственного интеллекта мнение одного из членов консилиума [8].
Небезынтересно, что точность шкал и формул прогнозирования различных нозологических форм (впрочем, как и итоговые цифры статистических популяционных исследований) различна для отдельных расовых групп [9]. В прежних своих исследованиях авторы обращали внимание на ценность эпидемиологического исследования, проведенного на данных, полученных в одном временном, территориальном и общественном континууме, определенной популяции в рамках конкретного региона, и на весьма условную корректность их интерполяции [10]. Прогностическая шкала, разработанная авторами на конкретном региональном материале, с достаточной точностью прогнозирует исход хирургического лечения больных с гипертензивными внутричерепными гематомами.
Результаты исследования согласуются с данными T. Desautels, R. Das, J. Egger, подтверждающими тот факт, что простые модели, базирующиеся на анализе группы из 6 клинических данных, дают не худшие, а часто лучшие результаты, чем модели из большего количества переменных [11–13]. Вероятно, это связано с более сложным измерением и адекватным сбором данных. Также существует мнение о возможности переобучения системы искусственного интеллекта. В любом случае, модели на основе ограниченного числа переменных проще в освоении и требуют минимума времени для интерпретации данных как отдельных лиц, так и групп пациентов с различным прогнозом [14, 15].
Заключение
Авторы далеки от мысли, что применение в клинике даже самого точного математически обоснованного компьютерного метода позволит принять единственно верное, часто судьбоносное для больного решение. Однако использование еще одного клинического инструмента, безусловно, способствует объективизации параметров принятия решений, часто носящих весьма эмоциональный характер.
Авторы выражают искреннюю благодарность сотрудникам кафедры прикладной математики и экономико-математических методов СПБГЭУ и лично профессору Фридману Григорию Морицовичу за профессиональные советы.



