Введение. В конце 2019 года в различных странах была зарегистрирована острая вирусная пневмония, которой дано определение «коронавирусная болезнь» (COVID-19). На июнь 2023 года установлено более 700 млн выявленных случаев COVID-19, более 6 млн заболевших умерли. Проблемой у перенесших коронавирус является наличие негативных ощущений в организме, сохраняющееся длительный срок после выздоровления. Данный патологический комплекс ВОЗ определила как «постковидный синдром – Long-COVID», развившийся после подтвержденного инфицирования вирусом SARS-CoV-2 в течение трех месяцев от момента заболевания. Состояние характеризуется наличием симптомов, которые невозможно объяснить альтернативным диагнозом, на протяжении не менее двух месяцев [1, 2]. На сегодняшний день доказано, что Long-COVID обусловливается не только непосредственным влиянием вируса, но и наличием биопсихосоциальных эффектов COVID-19 [3].
Частыми осложнениями коронавирусной инфекции являются астенизация и патологические изменения в периферических нервах, выявляющиеся при среднем и тяжелом течении заболевания. Поражаются, как правило, не только чувствительные, но и двигательные волокна, нередки сочетанные повреждения с легкой или средней степенью выраженности [4].
На сегодня остаются не до конца изученными механизмы, лежащие в основе поражений периферических аксонов, актуальны вопросы систематизации выявляемых патологических изменений центральных и периферических структур нервной системы. Все перечисленное играет важную роль в постановке правильного диагноза и корректном выборе фармацевтических методов лечения, методов нейрореабилитации и профилактических мер, требуется для адекватного прогнозирования полученных результатов, снижения до минимума негативного воздействия COVID-19 на организм заболевших.
На сегодняшний день актуален поиск препаратов, которые будут способствовать стабилизации и восстановлению структур нервной системы. Из существующих в настоящий момент наиболее эффективным может считаться комбинированный препарат, содержащий никотинамид, кокарбоксилазу, цианокобаламин и трифосаденина динатрия тригидрат. Препарат обладает сосудорасширяющим, метаболическим действием, способствует активизации тканевого и нуклеинового обмена [5, 6]. Доказано участие такого сочетания компонентов в препарате в процессах, восстанавливающих миелиновый слой аксонов периферической нервной системы, вследствие чего снижаются болевые ощущения, также препарат способствует возрастанию периферического кровообращения [7, 8].
Цель работы – оценить эффективность комбинированного препарата с метаболическим и вазоактивным действием в лечении пациентов с постковидным синдромом с астенией и снижением скорости проведения импульса по периферическим нервам.
Материалы и методы исслдеования. Для достижения поставленной цели были обследованы 30 женщин, средний возраст 48,5±2,7 года. Критериями включения в исследование являлись: пол – женский; возраст 40 лет и старше; наличие снижения скорости проведения импульса по периферическим нервам по данным электронейромиографии (ЭНМГ) как осложнения COVID-19; участники являются добровольцами, получено их письменное информированное согласие.
Критериями исключения являлись: беременность и период грудного вскармливания; декомпенсация цереброваскулярных заболеваний, наличие сердечно-сосудистой патологии, злокачественных опухолей, болезней почек и печени, заболеваний щитовидной железы, активного туберкулеза или других инфекционных заболеваний; зависимость от наркотиков или алкоголя; прием системной стероидной терапии или иммуносупрессивной терапии; наличие сенсибилизации и гиперчувствительности к компонентам препарата; текущее участие в любом клиническом исследовании или любом другом неинтервенционном исследовании препарата или устройства.
С целью коррекции выявленных нарушений применяли препарат, в состав которого входят: никотинамид (НАД+) 20 мг, кокарбоксилаза (тиамин пирофосфат) 50 мг, цианокобаламин (В12) 0,5 мг и трифосаденина динатрия тригидрат 10 мг. Препарат применяли по 2 мл внутримышечно, ежедневно, на курс 9 инъекций внутримышечно.
Препарат использовали для лечения исходя из комплексного действия компонентов на организм. Входящий в состав никотинамид обладает сосудорасширяющим эффектом и активно применяется при невропатиях, осложняющих течение сахарного диабета. Также положительное воздействие на периферические нервы оказывает цианокобаламин, уменьшающий невропатические боли, участвующий в синтезе миелина и стимулирующий обмен нуклеинов. Кокарбоксилаза активизирует метаболические процессы и тканевой обмен, а трифосаденина динатрия тригидрат – передачу возбуждения в адрен- и холинергических синапсах, под действием этих компонентов увеличивается периферическое кровообращение [9].
По результатам теста шкалы астенического состояния (ШАС) подтверждалось астеническое состояние обследованных. Выраженность астении определяли по количеству набранных баллов: «отсутствие астении» соответствовало 30–50 баллам, «слабая астения» – 51–75 баллам, «умеренная астения» – 76–100 баллам, состояние «выраженной астении» соответствовало 101–120 баллам [10].
Для оценки динамики выраженности изменений в состоянии тестированных периферических нервов после проведенного лечения проводили стимуляционную ЭНМГ. Был использован нейромиограф «Нейро-ЭМГ-Микро» (производство «Нейрософт», г. Иваново) [11]. Также проводили альгезиметрию (альгезиметр АВ-65), исследование осуществляли путем определения болевого порога при проколе кожи иглой (бугорок большеберцовой кости и 1-й палец стопы), результаты выражали в миллиметрах [12]. Также авторами была применена оценочная шкала «Neuropathy Symptom Score» [13].
Проведенное исследование соответствовало требованиям, предлагаемым Комитетом по биомедицинской этике. Пациенты были ознакомлены и подписывали информированное согласие на участие в данной работе. Не ущемлялись права и не подвергалось опасности благополучие привлеченных к исследованию лиц, что соответствовало требованиям биомедицинской этики, в соответствии с «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ № 266 от 19.06.2003 г. (действуют с поправками 2013 г.), Приказом Минздрава РФ № 200н от 01.04.2016 г. «Об утверждении правил надлежащей клинической практики». Заключение ЛЭК № 2 ФГБНУ ВСИМЭИ от 21.02.2023 г.
Статистическую обработку материалов выполняли на персональном компьютере с использованием стандартных программных средств Microsoft Excel 2011 (с пакетом Visual basic), пакета «Statistica 10.0», с применением непараметрического критерия Вилкоксона (Wilcoxoni) для связанных выборок. Различия считали статистически значимыми при р<0,05. Результаты исследований представлены в виде медианы (Ме), межквартильного размаха (Q25–Q75), минимального (Min) и максимального (Max) значений.
Результаты исследования и их обсуждение. Для терапии комбинированным препаратом подбиралась группа лиц с учетом наличия у пациентов астении и полиневропатии.
В начале и после лечения проведена оценка астенического состояния пациентов по ШАС. До лечения средний балл в обследуемой группе был 82, что свидетельствовало об умеренной астении. На фоне приема препарата у 100% обследованных астения не диагностировалась. Результаты представлены на рисунке 1.
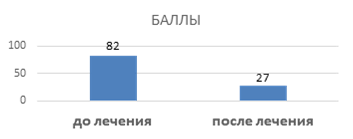
Рис. 1. Результаты ШАС (до и после лечения комбинированным препаратом)
Значения степени полиневропатии по оценочной шкале «Neuropathy Symptom Score» на фоне лечения снизились с 5,7 (5,5–6,1) до 4,2 (3,8–4,5) балла и уменьшились с выраженной степени до умеренной (р=0,03).
По показателям состояния моторного компонента ЭНМГ обследования отмечены тенденция к возрастанию скорости проведения импульса в дистальном отделе локтевого и большеберцового нервов, восстановление ранее завышенного значения проксимально-дистального коэффициента по срединному и локтевому нервам [11] (табл. 1).
Таблица 1
Показатели состояния моторного компонента периферических нервов у обследованных
до и после лечения, Me (Р25–Р75)
|
Показатель, ед. изм |
Срединный нерв |
|||||
|
До лечения (n=30) |
После лечения (n=30) |
p |
||||
|
М-ответ, мВ |
7,17 (5,41–9,16) |
8,16 (5,20–9,09) |
0,78 |
|||
|
СПИп, м/с |
69,70 (63,30–73,70) |
64,85 (61,60–71,20) |
0,15 |
|||
|
СПИл, м/с |
62,10 (51,10–62,20) |
68,70 (65,00–70,20) |
0,10 |
|||
|
СПИд, м/с |
|
54,10 (50,60–59,50) |
0,06 |
|||
|
П/Д коэффициент |
|
1,12 (1,06–1,23)* |
0,04 |
|||
|
РЛ, мс |
|
2,10 (1,46–2,40) |
0,11 |
|||
|
Локтевой нерв |
||||||
|
М-ответ, мВ |
|
7,80 (6,75–8,70) |
0,08 |
|||
|
СПИп, м/с |
|
65,80 (62,80–68,50) |
0,09 |
|||
|
СПИл, м/с |
54,80 (46,50–60,90) |
60,30 (58,30–62,00) |
0,30 |
|||
|
СПИд, м/с |
|
50,20 (56,00–58,0) |
0,06 |
|||
|
П/Д коэффициент |
1,25 (1,12–1,47) |
1,15 (1,10–1,37) * |
0,00 |
|||
|
РЛ, мс |
2,10 (1,75–2,40) |
2,00 (1,65–2,18) |
0,88 |
|||
|
Большеберцовый нерв |
||||||
|
М-ответ, мВ |
6,14 (4,62–7,87) |
7,48 (5,60–8,87) |
0,14 |
|||
|
СПИд, м/с |
40,20 (36,50–44,20) |
42,20 (39,50–48,20) |
0,07 |
|||
|
РЛ, мс |
2,10 (1,60–2,90) |
1,80 (1,61–2,40) |
0,13 |
|||
Примечания: 1) р – уровень статистической значимости различий по тесту Вилкоксона (Wilcoxoni), различия значимы при р<0,05; 2) сокращения: СПИп – СПИ в проксимальном отделе нервного ствола; СПИл – СПИ в области локтевого сгиба; СПИд – СПИ в дистальном отделе нервного ствола; П/Д коэффициент – проксимально-дистальный коэффициент (соотношение СПИп к СПИд); РЛ – резидуальная латентность.
Следует отметить, что у пациентов в группе «до лечения» отмечены сниженные показатели скорости проведения импульса в дистальном отделе моторного компонента локтевого и субпороговое снижение в дистальном отделе большеберцового нерва, что можно верифицировать как возможное наличие демиелинизирующих изменений в обследованных нервах [11].
Несмотря на отсутствие статистически значимых различий, анализ сенсорного компонента обследованных нервов, по данным ЭНМГ, на фоне лечения препаратом выявил тенденцию к возрастанию СПИ по срединному, локтевому нервам (табл. 2).
Таблица 2
Показатели состояния сенсорного компонента периферических нервов у обследованных до и после лечения, Ме (Р25–Р75)
|
Показатель |
До лечения (n=30) |
После лечения (n=30) |
p |
|
Срединный нерв |
|||
|
Сенсорный ответ (мкВ) |
7,70 (5,60–12,30) |
8,20 (6,40–10,30) |
0,12 |
|
СПИд (м/с) |
48,50 (44,30–53,50) |
50,90 (49,30–58,80) |
0,08 |
|
Локтевой нерв |
|||
|
Сенсорный ответ (мкВ) |
7,54 (5,60–11,20) |
8,27 (7,30–11,17) |
0,27 |
|
СПИд (м/с) |
50,00 (46,00–52,80) |
52,00 (49,00–56,30) |
0,06 |
|
n. Suralis |
|||
|
Сенсорный ответ (мкВ) |
6,00 (4,37–7,50) |
7,00 (5,78–8,50) |
0,18 |
|
СПИд (м/с) |
47,20 (45,50–53,80) |
48,90 (46,50–55,90) |
0,08 |
Примечания: 1) р – уровень статистической значимости различий по тесту Вилкоксона (Wilcoxoni), различия значимы при р<0,05; 2) сокращения: СПИд – СПИ в дистальном отделе нервного ствола.
У пациентов в группе «до лечения» были зарегистрированы сниженные показатели скорости проведения импульса сенсорного компонента локтевого нерва в дистальном отделе (менее 50 м/с), что характерно для полиневропатии [11].
При проведении альгезиметрии, на фоне лечения препаратом снизились показатели болевой чувствительности на бугорке большеберцовой кости – с 0,9±0,03 до 0,8±0,03 мм, на 1-м пальце стопы – с 0,8±0,03 до 0,7±0,02 мм.
На настоящий момент выделяют 3 группы неврологических осложнений, связанных с перенесенной инфекцией, вызванной вирусом SARS-CoV-2, одну из которых составляет поражение периферической нервной системы [14, 15, 16]. Частота неврологических проявлений постковидного синдрома на настоящий момент остается точно не известной, однако пациенты с подозрением на постковидную невропатию составляют существенную долю в общем числе пациентов с периферическими неврологическими расстройствами [17].
Астеническое состояние – одно из наиболее частых проявлений перенесенной инфекции разной степени тяжести. У пациентов с неврологической патологией астения может усугублять течение основного заболевания и снижать эффективность реабилитационных мероприятий [18].
Постковидная невропатия – нередкое осложнение новой коронавирусной инфекции. Непрямое действие вируса, связанное с периферической нервной системой по типу невропатии, рассматривается как один из возможных механизмов патогенного влияния COVID-19 на нервную систему.
В данном исследовании у пациентов была диагностирована умеренно выраженная астения по ШАС, выявлено снижение проведения импульса по моторному и сенсорному компонентам нервов верхних и нижних конечностей. При стимуляции моторного компонента локтевого нерва отмечалось снижение СПИ в дистальном отделе менее 50 м/с (нормативное значение), а при стимуляции дистального отдела моторного компонента срединного и большеберцового нервов отмечалось субпороговое снижение СПИ – 52,10 (47,60–55,50) м/с и 40,20 (36,50–44,20) м/с соответственно. Причем снижение СПИ по сенсорным и моторным аксонам периферических нервов зарегистрировано более чем у 80% пациентов в группе обследованных.
Выводы. Применение комбинированного препарата с метаболическим и вазоактивным действием у пациентов после перенесенной COVID-ассоциированной инфекции с астенией и изменениями в состоянии периферических нервов, выявленными при проведении ЭНМГ обследования, способствует:
-нормализации общего состояния пациентов;
-возрастанию скорости проведения импульса по периферическим нервам;
- снижению показателей болевой чувствительности на бугорке большеберцовой кости и 1-м пальце стопы.
Заключение. Таким образом, была показана эффективность метода лечения с помощью комбинированного лекарственного препарата с метаболическим и вазоактивным действием по результатам, полученным при применении ШАС, ЭНМГ-исследования и альгезиметрии. Выбор данного препарата был основан на анализе эффективности использования составляющих веществ лекарства у пациентов с постковидным синдромом. Так, применение никотинамида значительно улучшило состояние у пожилых людей, позволило избежать выраженных осложнений.



