Введение
Несмотря на достижения в хирургии и интенсивной терапии, перитонит, вызванный прободением толстой кишки, по-прежнему остается серьезной медицинской проблемой. Причины прободений толстой кишки могут быть связаны с травмами (в том числе случайными и медицинскими осложнениями), а также с нетравматическими факторами, такими как дивертикулит и перфорация, обусловленная различными злокачественными новообразованиями в толстой кишке. Смертность при каловом перитоните варьирует от 30 до 60%, что подчеркивает тяжесть этого заболевания и трудности в его лечении. Одной из основных причин этой летальности является распространенный перитонит с развитием сепсиса и полиорганной недостаточности [1, 2, 3].
Наиболее известной, доступной и простой в подсчете, надежно зарекомендовавшей себя и широко применяемой шкалой для оценки тяжести перитонита является Мангеймский индекс перитонита (МИП). МИП представляется одним из самых чувствительных и специфичных методов при прогнозировании исхода вторичного перитонита. МИП при перфорации толстой кишки с вторичным перитонитом служит эффективным способом для определения прогнозируемого уровня летальности среди прооперированных больных. Это позволяет предположить, что МИП также может быть использован при выборе хирургической тактики у больных с разлитым перитонитом.
Такие лабораторные показатели, как С-реактивный белок (СРБ), прокальцитонин (ПКТ), лейкоцитоз; клинические данные: диффузная боль в животе, тяжесть состояния и сопутствующие заболевания, играют немаловажную роль в прогнозировании исхода у пациентов с вторичным перитонитом и абдоминальным сепсисом и с большей частотой предопределяют неблагоприятный исход. Данные показатели являются маркерами воспаления, как следствие – полиорганной недостаточности. В связи с этим перечисленные показатели имеют высокую прогностическую ценность исхода перитонита и определения дальнейшей тактики лечения [4, 5, 6].
Применение системы оценки тяжести перитонита, учитывающей оценку патологического процесса в брюшной полости, тяжесть состояния больного и ряд лабораторных показателей, отражающих общую воспалительную реакцию организма, представляется авторам актуальной задачей.
Цель исследования. Оценка эффективности применения Мангеймского индекса при перитоните, обусловленном перфорацией толстой кишки, для определения вероятности летального исхода.
Материалы и методы исследования
Для достижения поставленной цели выполнен ретроспективный анализ медицинской документации пациентов с вторичным перитонитом. Проанализированы 84 истории болезни – 25 женщин и 59 мужчин с перитонитом, обусловленным перфорацией ободочной кишки. Все пациенты находились на стационарном лечении в хирургическом отделении ГКБСМП №15 и ГКБ № 16 г. Волгограда. Период наблюдения: 2015–2023 гг.
Всем пациентам выполнен комплекс клинико-диагностических исследований: УЗИ брюшной полости, рентгенография брюшной полости и грудной клетки, ЭКГ; анализ лабораторных показателей. При релапаротомии учитывали распространение перитонита и тип экссудата, наличие органной недостаточности. Оценивали критерии SIRS, уровень прокальцитонина и СРБ. Пациенты распределены на группы в соответствии с тяжестью абдоминального сепсиса: SIRS-0 – сепсис отсутствует; SIRS-1 – абдоминальный сепсис с нарушением функции одного органа; SIRS-2 – абдоминальный сепсис с полиорганной недостаточностью.
Для количественной оценки тяжести перитонита, выбора тактики лечения и прогнозирования результата лечения перитонита использовали шкалу МИП (табл. 1).
Таблица 1
Мангеймский индекс перитонита
|
Фактор риска |
Оценка тяжести, баллы |
|
Возраст старше 50 лет |
5 |
|
Женский пол |
5 |
|
Наличие органной недостаточности |
7 |
|
Наличие злокачественного образования |
4 |
|
Продолжительность заболевания более 24 ч |
4 |
|
Перитонит диффузный |
6 |
|
Экссудат (один ответ) Прозрачный Мутно-гнилостный Каловый |
0 6 12 |
|
Источник перитонита – не толстая кишка |
4 |
Показатели органной недостаточности: функция почек: уровень креатинина ≥177 мкмоль/, мочевина ≥1 моль/л, олигурия <20 мл/час; функция органов дыхания: РаО2 <50 рт. ст., РаСО2 > 50 рт. ст.; парез кишечника ≥24 часов.
Индекс МИП, несмотря на свою прогностическую ценность в отношении летальных исходов, до настоящего времени не применялся в разработке хирургических подходов к лечению патологий. В результате ретроспективного анализа идентифицированы хирургические маркеры прогрессирования перитонита. Эти показатели впоследствии были использованы для определения критериев необходимости проведения первой и последующих релапаротомий. Предложено объединить индекс МИП с существующими хирургическими показателями для оценки эффективности применения протоколов санации. Рекомендации относительно выполнения санаций по требованию при распространенном гнойном перитоните изложены в таблицах 2 и 3. При суммарной оценке более 30 баллов рекомендуется первая плановая санация брюшной полости.
Таблица 2
Интраоперационные критерии прогрессирования перитонита
|
Показания к программным санациям |
Баллы |
|
Париетальная брюшина (только один ответ): – блестящая, гиперемия на отдельных участках, сосудистый рисунок не определяется или имеется инъекция сосудистого рисунка; – тусклая, гиперемированная, с субсерозными кровоизлияниями и петехиями |
0
4 |
|
Наложения фибрина (только один ответ): – единичные нити фибрина, легко снимаемые, разрыхление прочно фиксированных наложений; – массивные, плотные, толстые, прочно фиксированные, неснимаемые |
0
4 |
|
Парез кишечника (только один ответ): – кишечные петли эластичные, стенка мягкая, единичные волны перистальтики при механическом раздражении; – эктазированные кишечные петли с легко повреждаемой серозной оболочкой, стенка плотная с выраженным отеком, отсутствие перистальтики |
0
4 |
|
Тенденция к формированию межкишечных абсцессов |
4 |
Таблица 3
Градация пациентов в зависимости от значения МИП
|
|
Лейкоциты, х109/л |
СРБ г/л |
Прокаль-цитонин, нг/л |
Креатинин, ммоль/л |
Мочевина, ммоль/л |
Альбумин, г/л |
Сепсис |
SIRS |
|
1-я группа (МИП менее 20 баллов) |
12,15±0,3 |
87,13± 2,1 |
0,75±0,2 |
100,27±5,2 |
7,8±0,9 |
32,1±2,1 |
Нет |
0 |
|
2-я группа (МИП 21–29 баллов) |
16,15± 1,2 |
129 ± 5,4 |
1,3±0,1 |
124,61±3,7 |
8,4±1,2 |
24,61±3,4 |
Да |
1–2 |
|
3-я группа (МИП более 30 баллов) |
20,65± 2,4 |
164±2,7 |
2,1±0,1 |
146,69±7,4 |
12,4±2,1 |
19,45±5,2 |
Да |
3 |
В 1-ю группу включены 30 человек (3 женщин и 27 мужчин, средний возраст пациентов составил 50±3,3 года) с перитонитом без проявления сепсиса и полиорганной дисфункции. У 15 больных верифицирована перфорация дивертикула ободочной кишки, у 13 – перфорация опухоли ободочной кишки, у 1 больной выявлена перфорация толстого кишечника инородным телом и у 1 пациента – ущемленная грыжа с некрозом сигмовидной кишки. При поступлении уровень лейкоцитов крови составил в среднем 12,15±0,3, среднее значение прокальцитонина – 0,75±0,2, СРБ – 87,13±2,1. Летальность в 1-й группе составила 10,0%, что обусловлено прогрессированием коморбидной (сердечно-сосудистой) патологии ИБС, ОИМ, ТЭЛА. Среднее значение МИП в 1-й группе – 15,7±0,8 балла. Время обращения от начала заболевания до госпитализации – от 1 до 8 часов. По распространенности и характеру экссудата в 1-й группе выделены следующие формы перитонита: гнойный диффузный, распространенный гнойный перитонит.
В 1-й группе выполнялись следующие операции: операция Гартмана (резекция опухоли сигмовидной кишки с закрытием дистальной части толстой кишки и формированием одноствольной стомы) – 6 операций. Операция по типу Гартмана (резекция сигмовидной кишки с пораженным участком перфорации дивертикула, закрытие дистальной части толстой кишки и формирование одноствольной стомы) – 15 операций. Правосторонняя гемиколэктомия: 1 операция с выведением илеостомы и закрытием толстой кишки; 3 операции с созданием илеотрансверзоанастомоза и установкой разгрузочной илеостомы; 1 операция с созданием илеотрансверзоанастомоза и установкой разгрузочной трансверзостомы – 5 операций. Левосторонняя гемиколэктомия: резекция левой половины толстой кишки с формированием одноствольной трансверзостомы и закрытием дистальной части толстой кишки – 3 операции. Из послеоперационных осложнений наблюдалось нагноение послеоперационной раны у 5 человек.
В 1-й группе было проведено 7 однократных санационных релапаротомий по плану из-за прогрессирования перитонита.
Во 2-ю группу включены 29 пациентов с перитонитом, проявлениями абдоминального сепсиса и наличием моноорганной дисфункции. Среди них 19 женщин и 10 мужчин. Средний возраст составил 59±3,3 года. У 12 больных верифицировали перфорацию дивертикула ободочной кишки, у 16 – перфорацию опухоли толстого кишечника. У 1 пациентки выявлен некроз стенки сигмовидной кишки на фоне неспецифического язвенного колита. При поступлении уровень лейкоцитов крови составлял 16,15±1,2. Среднее значение прокальцитонина было 1,3±0,1, СРБ – 129±5,4. Умерли 4 человека, что составило 13,8%. В данной группе летальность обусловлена ТЭЛА-2, прогрессированием перитонита с коморбидной патологией у 2 пациентов. Среднее значение МИП – 25,5±1,5 балла.
Во 2-й группе время обращения пациентов от начала заболевания до госпитализации составляло от 6 до 18 часов. В этой группе выполнялись следующие операции:
1) операция Гартмана – резекция опухоли сигмовидной кишки с заглушением дистального отдела толстой кишки и выведением одноствольной сигмостомы – 6 операций;
2) операция по типу Гартмана – резекция сигмовидной кишки с участком перфорации дивертикула, с заглушением дистального отдела толстой кишки и выведением одноствольной сигмостомы – 10 операций;
3) наложение колостомы – данные операции выполнялись при невозможности резецировать опухоль, в таких случаях накладывалась двухствольная колостома, – 2 операции;
4) правосторонняя гемиколэктомия: 2 операции с выведением илеостомы и заглушением толстой кишки, 5 операций с наложением илеотрансверзоанастомоза и наложением разгрузочной илеостомы, 1 операция с наложением илеотрансверзоанастомоза и наложением разгрузочной трансверзостомы, с интубацией толстой кишки за область анастомоза (всего 8 операций);
5) левосторонняя гемиколэктомия: резекция левой половины толстой кишки с наложением концевой, одноствольной трансверзостомы и заглушением дистального отдела толстой кишки – 4 операции.
Санационных релапаротомий по программе выполнено 8 (по поводу прогрессирования перитонита – 7, по поводу несостоятельности илеотрансверзоанастомоза – 1). Из послеоперационных осложнений: нагноение послеоперационной раны в пределах подкожно-жировой клетчатки – 7 случаев, несостоятельность илеотрансверзоанастомоза – 1.
В 3-ю группу включены 25 пациентов (3 женщины и 22 мужчины) с перитонитом, проявлениями абдоминального сепсиса, полиорганной дисфункцией органов и наличием септического шока. Госпитализация в стационар состоялась через 24 ч и более от начала заболевания. Средний возраст составил 59±5,3 года. У 7 больных верифицировали перфорацию дивертикула сигмовидной кишки, у 16 – перфорацию опухоль ободочной кишки, у 1 – перфорацию инородным телом и у 1 – колото-резаное ранение толстого кишечника с распространенным каловым перитонитом. При поступлении уровень лейкоцитов крови – 20,65±2,4, среднее значение прокальцитонина – 2,1±0,1, СРБ – 164±2,7. Летальность в этой группе составила 11 человек – 44% (прогрессирование полиорганной недостаточности и прогрессирование перитонита – 5 случаев). Послеоперационные осложнения: несостоятельность илеотрансверзоанамстомоза – 1, несостоятельность колостомы – 1. Среднее значение МИП – 35±1,4 балла.
В 3-й группе оперативное вмешательство:
1) операция Гартмана – резекция опухоли сигмовидной кишки с закрытием дистального отдела толстой кишки и выведением одноствольной сигмостомы – 5;
2) операция по типу Гартмана – резекция сигмовидной кишки с участком перфорации дивертикула, с закрытием дистального отдела толстой кишки и выведением одноствольной сигмостомы – 8;
3) двуствольная подвесная колостома при невозможности резецировать опухоль сигмовидной кишки – 6;
4) гемиколэктомия справа: операции с выведением илеостомы (1) и закрытием толстой кишки (4), с наложением илеотрансверзоанастомоза и наложением разгрузочной илеостомы (1), операция с наложением илеотрансверзоанастомоза и наложением разгрузочной трансверзостомы, с интубацией толстой кишки за область анастомоза (8);
5) гемиколэктомия слева: резекция левой половины толстой кишки с наложением концевой, одноствольной трансверзостомы и закрытием дистального отдела толстой кишки – 4;
6) субтотальная колэктомия: резекция толстой кишки с выведением концевой илеостомы, с заглушением прямой кишки – 1.
Послеоперационные осложнения в 3-й группе: нагноение послеоперационной раны – 6, несостоятельность илеотрансверзоанастомоза – 1, несостоятельность колостомы – 1, эвентрация послеоперационной раны – 1. Выполнено 8 санационных релапаротомий по программе.
На основании полученных данных первичная программная санация брюшной полости рекомендуется всем пациентам 3-й группы по шкале МИП более 30 баллов.
Пациентам 2-й группы (МИП 21–29 баллов) при наличии признаков прогрессирования перитонита. При показаниях для проведения программной санации рану зашивали редкими одиночными узловыми швами из пролена с наложением лапаростомы, также рассматривался вариант использования систем VAC с отрицательным давлением для лечения перитонита. Каждому пациенту проводилось от 1 до 7 процедур программной санации брюшной полости.
Статистическое исследование было проведено с помощью программного обеспечения StatTech версии 3.0.7, созданного российской компанией «Статтех». Количественные показатели были проанализированы на предмет соответствия нормальному распределению с использованием теста Колмогорова–Смирнова. Для показателей, соответствующих нормальному распределению, рассчитывались средние значения (M) и стандартные отклонения (SD), а также указывался 95%-ный доверительный интервал (CI). Значения p<0,05 считались статистически значимыми. Чтобы определить прогностическую ценность количественных параметров относительно летального исхода, использовали анализ ROC-кривых. Оценивали следующие показатели: чувствительность и специфичность каждой системы, площадь под ROC-кривой, положительную прогностическую ценность, отрицательную прогностическую ценность.
Результаты исследования и их обсуждение
Проводили комплекс обследования: лабораторные исследования (общий анализ крови (ОАК), общий анализ мочи (ОАМ), биохимия крови, определение уровня ПКТ, СРБ); коагулограмма; рентгенография органов грудной клетки; органов брюшной полости; ЭКГ; УЗИ органов брюшной полости – для выявления признаков синдрома системного воспалительного ответа у каждого больного в послеоперационном периоде. Выполнен подсчет МИП в каждой группе больных. Отмечено, что при увеличении значения МИП показатели летальности в каждой группе возрастают. Среднее значение МИП в 1-й группе – 15,7±0,8, во 2-й группе – 25,5±1,5, в 3-й группе – 35±1,4 балла. Количество баллов МПИ увеличивалось в 3-й группе по сравнению со 2-й группой. При значениях МИП более 30 баллов резко увеличивается летальность. Также выявлено, что показатели МИП при неосложненном течении заболевания были достоверно ниже, чем у больных с послеоперационными осложнениями.
В 1-й группе, где средний показатель МИП составил 15,7±0,8 балла, продолжительность послеоперационного периода была 24,5±1,9 дня. Лечение проходило без местных и системных осложнений. Несмотря на наличие клинических и лабораторных признаков воспаления, случаев сепсиса не было выявлено.
Во 2-й группе со средним значением МИП 25,5±1,5 балла длительность послеоперационного периода достигла 35,2±4,2 дня. У всех пациентов выявлены клинические и лабораторные признаки ССВР. Количество выявленных органных дисфункций – 1,0±0,4.
В 3-й группе (МИП 35±1,4 балла) послеоперационный период длился 20,8±8,2 дня. Выявлены клинические и лабораторные симптомы сепсиса с синдромом полиорганной недостаточности, при этом в патологический процесс вовлекались 3,6±0,4 органа дисфункции. Медиана показателей МИП для выживших и умерших пациентов в общей выборке представлена в таблице 4.
Таблица 4
Медиана МИП в зависимости от исхода заболевания
|
Показатель |
Категории |
МИП |
p |
||
|
M±SD |
95% ДИ |
n |
|||
|
Летальность: да – 0, нет – 1 |
Показатель 1 |
32±11 |
26–37 |
18 |
<0,001* |
|
Показатель 2 |
23±8 |
21–25 |
65 |
||
Примечание. * – различия показателей статистически значимы (p<0,05)
Среди всех 18 умерших пациентов средний показатель МИП составил 32±11 баллов. Среди всех выживших пациентов средний показатель МИП составил 23±8 баллов (рис. 1).
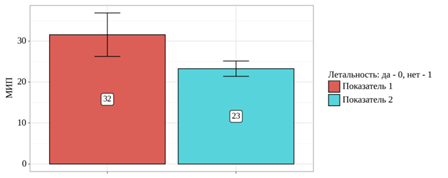
Рис. 1. Медиана показателя МИП в зависимости от исхода заболевания
Прогностические возможности МИП были исследованы посредством выполнения ROC-анализа путем анализа зависимости вероятности показателя смертности от значения МИП (рис. 2, 3).
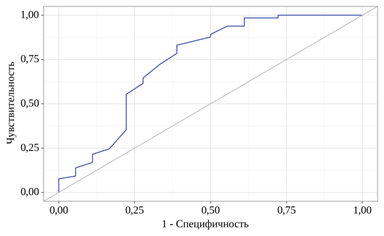
Рис. 2. Прогностическая ценность МИП при проведении ROC-анализа зависимости вероятности летального исхода от значений МИП: да – 0, нет – 1
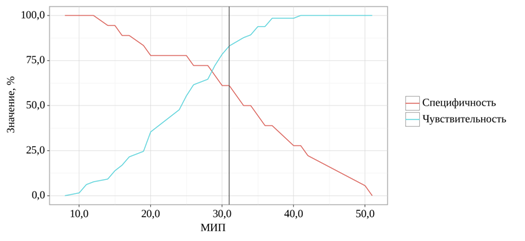
Рис. 3. Анализ чувствительности и специфичности модели в зависимости от пороговых значений показателя МИП
Площадь под ROC-кривой оказалась равной 0,740±0,072 при 95%-ном доверительном интервале от 0,599 до 0,882. Модель продемонстрировала статистическую значимость (p=0,002). Оптимальное пороговое значение для показателя МИП, соответствующее максимальному индексу Юдена, было установлено на уровне 31,000. При этом чувствительность модели составила 83,1%, а специфичность – 61,1% (рис. 3, табл. 5).
Таблица 5
Пределы значений показателя МИП
|
Порог |
Чувствительность (Se), % |
Специфичность (Sp), % |
PPV |
NPV |
|
34 |
89,2 |
50,0 |
86,6 |
56,2 |
|
33 |
87,7 |
50,0 |
86,4 |
52,9 |
|
31 |
83,1 |
61,1 |
88,5 |
50,0 |
|
30 |
78,5 |
61,1 |
87,9 |
44,0 |
|
29 |
72,3 |
66,7 |
88,7 |
40,0 |
|
28 |
64,6 |
72,2 |
89,4 |
36,1 |
|
26 |
61,5 |
72,2 |
88,9 |
34,2 |
|
25 |
55,4 |
77,8 |
90,0 |
32,6 |
Одним из маркеров диагностики сепсиса является ПКТ. Выполнен корреляционный анализ взаимосвязи показателя МИП и показателя ПКТ (табл. 6).
Таблица 6
Корреляционный анализ МИП/ПКТ
|
Показатель |
Параметры корреляционной связи |
||
|
ρ |
Теснота связи по шкале Чеддока |
p |
|
|
МИП – ПКТ |
0,583 |
Заметная |
<0,001* |
Примечание. * – различия показателей статистически значимы (p<0,05)
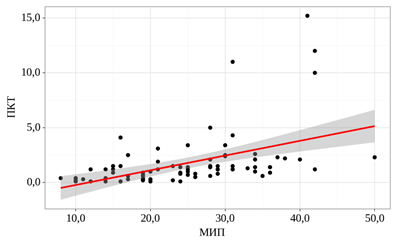 |
При оценке связи показателя ПКТ и показателя МИП была установлена заметной тесноты прямая корреляционная связь (рис. 4).
Рис. 4. График регрессионной функции, характеризующий зависимость показателя ПКТ от показателя МИП
Концентрация ПКТ до операции была статистически значимым предиктором наступления неблагоприятного события в исследуемой когорте пациентов с перитонитом. Увеличение концентрации ПКТ в 2 раза было ассоциировано с увеличением шансов смерти после операции в среднем в 2,02 раза.
Одним из маркеров системной воспалительной реакции является СРБ. При оценке связи показателя СРБ и показателя МИП была установлена прямая корреляционная связь (табл. 7, рис. 5).
Таблица 7
Исследование корреляционного анализа взаимосвязи показателя МИП и показателя СРБ
|
Показатель |
Параметры корреляционной связи |
||
|
ρ |
Теснота связи по шкале Чеддока |
p |
|
|
МИП – СРБ |
0,527 |
Заметная |
<0,001* |
Примечание.* – различия показателей статистически значимы (p<0,05).
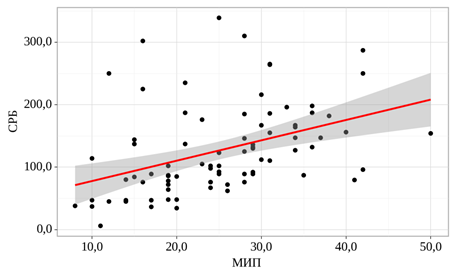
Рис. 5. График регрессионной функции, характеризующий зависимость показателя СРБ от показателя МИП
Среди пациентов с перфорацией толстой кишки увеличение уровня СРБ на каждые 10 мг/л было ассоциировано с ростом шансов наступления послеоперационного летального исхода в среднем в 1,1 раза.
Среди пациентов с перфорацией толстой кишки не было установлено статистически значимой связи уровня креатинина и шансов наступления смерти в послеоперационном периоде (ОШ для увеличения концентрации на каждые 10 мкмоль/л – 1,09 [95% ДИ: 0,95; 1,24], p=0,195).
Перитонит при перфорации толстой кишки является опасным для жизни состоянием с высоким риском летального исхода. Раннее определение тяжести состояния по МИП может помочь принять решение об объеме хирургического лечения и медикаментозного лечения [7]. Прогноз вторичного перитонита после перфорации толстого кишечника часто является неблагоприятным. Для оценки уровня смертности при перитоните и выбора оптимальной стратегии лечения активно используются системы количественной оценки индивидуальных факторов риска. Для прогнозирования уровня летальности часто применяют МИП, APACHE II [8], MODS, SOFA [9], шкалу индекса брюшной полости (ИБП) [10]. Анализ прогностической ценности этих систем показал, что только шкалы APACHE II и МИП оказывают независимое влияние на прогнозирование исходов перитонита (соотношение шансов составляет 6,7 и 9,8 для APACHE II и МИП соответственно), в то время как APACHE II обладает высокой специфичностью (90%) в предсказании благоприятных исходов, ее чувствительность к прогнозированию смертельных исходов при перитоните ниже (50–70%) [11]. Шкала APACHE II разрабатывалась для тяжелобольных пациентов в реанимационных отделениях и не учитывает такие факторы, как степень распространения перитонита и характеристики выпота. Ее расчет является сложным и требует значительных затрат времени. МИП представляет собой более простой инструмент оценки тяжести, разработанный и используемый именно для определения стадии тяжести перитонита, прогнозирования летальности и стратификации групп пациентов. При работе с таблицей МИП необходима только доступная информация из истории болезни. При оценке эффективности МИП при сопоставлении данных литературы у разных авторов показатель летальности в зависимости от балла индекса был разным.
Sanjeev Sharma с соавторами считают, что смертность неуклонно возрастает с увеличением показателя МИП. Для пациентов с оценкой <21 уровень смертности составлял 0%, при 21–27 баллах – 27,28%; а при >27 баллов – 100% (р<0,001). Для пациентов с оценкой <21 балл уровень заболеваемости составил 13,33%; при 21–27 баллах – 65,71%; при >27 баллах – 100% (р<0,001). Было обнаружено, что продолжительность боли >24 часов, органная недостаточность при поступлении, женский пол и каловый перитонит являются независимыми значимыми факторами в прогнозировании смертности среди исследуемой популяции. Для значения балла МИП 27 чувствительность составила 66,67%, специфичность — 100%, а положительная прогностическая ценность смертности — 100% при точности 94% [12]. С.Л. Битюков с соавторами публикуют следующие данные летальности: МИП менее 20 баллов – летальность до 5%, 21–29 баллов – до 25%, более 30 баллов – до 50% [13]. В работе L. Gueiros с соавторами было установлено, что уровень смертности составил 14,67% при значении балла МИП 32,8, чувствительность МИП составила 90,9%, специфичность – 78,13% [4].
Приведенные данные показывают высокий интерес к данной шкале прогнозирования показателей летальности в разных исследованиях. Высокая смертность среди пациентов с заболеваниями брюшной полости часто обусловлена полиорганной недостаточностью, предотвратить развитие и усугубление которой можно только посредством радикального хирургического вмешательства. Для определения оптимального способа завершения первой операции можно использовать информацию по определению способа завершения первой лапаротомии при перитоните, исходя из показателей ИБП и МПИ [14]. Большое количество операций Гартмана в проведенном авторами исследовании было обусловлено большим количеством пациентов с распространенным перитонитом при наличии рака толстой кишки. Низкий уровень летальности (примерно 10,3%) наблюдался у пациентов, у которых степень перитонеальных изменений была оценена менее чем в 20 баллов. Когда оценка увеличивалась с 21 до 25 баллов, показатель летальности составлял 13,3%. У пациентов с показателем МИП от 26 до 30 баллов летальный исход произошел в 44% случаев; при оценке тяжести перитонита свыше 30 баллов МИП летальность была крайне высокой. Показатель в 31 балл оказался наиболее чувствительным и специфическим для прогнозирования летального исхода. В случаях тяжелых форм перитонита, когда значение по шкале МИП достигает 30 и выше, особенно при наличии абдоминального сепсиса с полиорганной недостаточностью и значительной внутрибрюшной гипертензией, применение полуоткрытых методов лечения существенно снижает смертность по сравнению с традиционными подходами.
Традиционные методы лечения перитонита, которые применяются без признаков абдоминального сепсиса, характеризуются низкой частотой послеоперационных осложнений. Тем не менее, эффективность хирургического лечения при распространенном гнойном перитоните, сопровождающемся абдоминальным сепсисом, оставляет желать лучшего. Особенно это проявляется у пациентов с развившейся моно- или полиорганной недостаточностью. Анализ показывает, что лечение перитонита с однократной релапаротомией по плану можно назначать пациентам при показаниях с распространенным гнойным перитонитом даже без признаков абдоминального сепсиса и оценкой общего состояния пациента по шкале МИП не более 20 баллов. Повторные санации также необходимы пациентам с признаками абдоминального сепсиса и наличием либо отсутствием органной недостаточности при предоперационной оценке по шкале МИП от 20 до 29 баллов.
Релапаротомии по плану с многократными санациями или с использованием технологии вакуум-ассистированной лапаростомии в брюшной полости предпочтительны для пациентов с тяжелым абдоминальным сепсисом и полиорганной недостаточностью при показателях МИП 30 и выше. А.В. Шабунин с соавторами считают, что использование технологии вакуум-ассистированной лапаростомии у больных с распространенным перитонитом позволяет уменьшить количество вторичных гнойных осложнений, летальность, увеличить частоту фасциального закрытия брюшной полости [15].
При выборе метода лечения гнойного перитонита необходимо принимать во внимание следующие факторы риска, которые могут повлиять на результат заболевания: тяжесть абдоминального сепсиса, уровень внутрибрюшной гипертензии, источник перитонита, свойства экссудата, присутствие фибринозных отложений на брюшине и степень кишечного пареза.
Подход подсчета числа органных дисфункций по классификации Baue базируется на ежедневной проверке различных клинико-лабораторных показателей, что подразумевает необходимость добавления этих критериев к ежедневному мониторингу. Данные параметры могут быть определены в короткий срок в лечебном учреждении любого уровня.
Высокие прогностические способности некоторых биохимических показателей плазмы крови при перитоните, обусловленном перфорацией ободочной кишки, тесно взаимосвязаны с ведущими звеньями патогенеза перитонита.
Лабораторные показатели прокальцитонина и СРБ имеют большую прогностическую значимость в определении септического состояния при вторичном перитоните. Определение количества органных дисфункций совместно с определением МИП и лабораторными показателями повышает точность прогноза риска летального исхода.
Прогнозирование уровня вероятности летального исхода и возможность использования МИП совместно с интраоперационными критериями прогрессирования перитонита для определения показаний к программным санациям брюшной полости требуют дополнительных исследований на более обширном клиническом материале.
Заключение
Распространенный вторичный перитонит при перфорации толстой кишки характеризуется высокими показателями риска летального исхода. Поэтому при планировании лечения пациентов с перитонитом результаты прогностических индексов должны приниматься во внимание. Проведенное исследование свидетельствует о высокой точности МИП, на основании которого можно прогнозировать исход заболевания. Расчет МИП позволяет на раннем этапе не только определить общее состояние больного, но и прогнозировать риск летального исхода. Чем выше МИП, тем чаще наблюдаются органная недостаточность и септический шок. Простота расчета показателя МИП позволяет на ранних стадиях выявлять осложнения, наблюдающиеся у пациентов всех клинических стационаров, и, тем самым, повысить эффективность лечения.



