Введение
Повреждение кардиомиоцитов в посттравматическом периоде ушиба сердца обусловлено как нарушением структурной организации клеток вследствие первично-механического воздействия, так и вторично-ишемическими механизмами с последующим закономерным развитием биоэнергетической гипоксии [1; 2]. Экспериментальные исследования на моделях острой ишемии миокарда демонстрируют, что в ишемизированных кардиомиоцитах происходит деструкция цитоскелетного белка десмина [3]. В единичных публикациях, касающихся травматического повреждения сердца, также установлен факт деградации десмина как следствие механического повреждения [4].
При этом в патогенезе тупой травмы сердца значительную роль играет адаптация организма к действию стрессового фактора, реализуемая в рамках стресс-реакции. Ранее авторами была показана разница в течении посттравматического периода экспериментального ушиба сердца у крыс с высокой и низкой стрессоустойчивостью на основании различия биохимических показателей [5] и экспрессии иммуногистохимических маркеров [6].
Исходя из этого, авторы предположили, что у высоко- и низкоустойчивых к стрессу особей после моделирования тупой травмы сердца возможны различные варианты структурных нарушений кардиомиоцитов, в частности разные уровни экспрессии цитоскелетного белка десмина в динамике посттравматического периода ушиба сердца.
Цель исследования
Оценка экспрессии структурного белка десмина в миокарде крыс с высокой и низкой стрессоустойчивостью в динамике посттравматического периода ушиба сердца.
Материалы и методы исследования
Эксперимент выполнен на 106 белых беспородных крысах-самцах массой 250-300 г, содержавшихся в помещении с контролируемой температурой (22± 2°C) при свободном доступе к комбинированному корму и воде в соответствии с правилами проведения работ и содержания животных (Приказ Минздрава РФ от 01.04.2016 №199н «Об утверждении правил надлежащей лабораторной практики»). Протокол эксперимента был одобрен локальным этическим комитетом Омского государственного медицинского университета (протокол № 140 от 13.10.2021). На всех инвазивных этапах эксперимента использовали ветеринарный препарат Золетил 100 (тилетамин, золазепам) в дозе 30 мг/кг внутрибрюшинно.
Разделение крыс на группы по стрессоустойчивости проводили с помощью тестов «Принудительное плавание» по Порсолту в модификации М.С. Зайцевой и соавт. [7] и «Открытое поле», подробно процедура ранжирования животных изложена в предыдущих публикациях авторов [8].
Далее крыс разделили на группы в зависимости от уровня выявленной стрессоустойчивости: с высокой (n = 32), средней (n = 42) и низкой (n = 32) стрессоустойчивостью, при этом особи со средней устойчивостью к стрессу были исключены из дальнейшего эксперимента в соответствии с целью исследования. Из животных с высокой и низкой стрессоустойчивостью сформировали контрольную (n = 16) и опытную (n = 48) группы. В контрольную группу (К) включили две подгруппы животных: с высокой (КВ) и низкой (КН) стрессоустойчивостью. В опытную группу (О) вошли шесть подгрупп в соответствии с тремя исследовательскими точками посттравматического периода: с высокой и низкой стрессоустойчивостью и длительностью эксперимента 6, 12 и 24 ч. В итоге было сформировано восемь подгрупп (КВ, КН, ОВ-6, ОН-6, ОВ-12, ОН-12, ОВ-24, ОН-24) по 8 животных в каждой.
У особей из подгрупп опытной группы моделировали ушиб сердца при помощи оригинального устройства, имитирующего удар передней поверхности грудной клетки о стойку руля [9]. Затем через 6, 12 или 24 ч после травмы в зависимости от исследовательской точки (для особей подгрупп ОВ-6 и ОН-6, ОВ-12 и ОН-12, ОВ-24 и ОН-24 соответственно) сердца крыс извлекали и изготавливали срезы сердца, после чего окрашивали их раствором нитросинего тетразолия для определения зон наибольшего повреждения [6].
Из межжелудочковой перегородки, передних стенок левого и правого желудочков сердца выделили фрагменты размером 5х5 мм, фиксировали формалином, обезвоживали в спиртах нисходящей концентрации, заливали в парафиновые блоки. Гистологические срезы изготавливали на микротоме Epredia HM 340E (Epredia, Великобритания), наносили на стекла с адгезивным покрытием, депарафинизировали ксилолом, окрашивали, просветляли в карбоксилоле и накрывали покровными стеклами. Для оценки экспрессии структурного белка десмина проводили иммуногистохимическую реакцию с моноклональными мышиными антителами Anti-Desmin («Линбери Лаб», Россия), клон GM007, разведение 1:100, согласно рекомендациям производителя антител. Визуализацию иммуногистохимического окрашивания осуществляли с помощью «Универсальной двухстадийной системы детекции PrimeVision: антитела к IgG мыши/кролика – HRP/DAB» («ПраймБиоМед», Россия), после чего образцы докрашивали гематоксилином.
Иммуногистохимическую реакцию считали положительной при появлении окрашивания коричневого цвета в цитоплазме кардиомиоцитов, а также при наличии коричневого окрашивания вставочных дисков в местах соединения кардиомиоцитов. Микроскопию проводили на микроскопе Axioskop 40 (Zeiss, Германия) при 400-кратном увеличении в 10 полях зрения в каждом препарате. Поля зрения фиксировали в виде снимков с помощью камеры Axiocam 503 color (Zeiss, Германия) и графической программы ZenBlue.
Анализ результатов иммуногистохимического исследования миокарда проводили с учетом двух параметров: оценки цитоплазматического окрашивания кардиомиоцитов и окрашивания вставочных дисков. Цитоплазматическое окрашивание оценивали полуколичественным методом, при этом интенсивность иммуногистохимической окраски определяли по четырехбалльной шкале (0 – отсутствие окрашивания, 1 – слабая интенсивность окрашивания, 2 – умеренная интенсивность окрашивания, 3 – выраженное окрашивание). Площадь цитоплазматического окрашивания оценивали с использованием паттернов, отражающих процент окрашенных кардиомиоцитов от всех кардиомиоцитов в поле зрения, и присваивали соответствующий балл (0-20% – 0 баллов, 21-40% – 1 балл, 41-60% – 2 балла, 61-80% – 3 балла, 81-100% – 4 балла). После умножения балла интенсивности на балл площади окрашивания получали индекс экспрессии (максимум 12 баллов) для каждого поля зрения. Далее для всех 10 полей зрения каждого отдельного образца рассчитывали среднее арифметическое значение и индекс экспрессии. Окрашивание вставочных дисков оценивали с использованием количественного метода подсчета в 10 полях зрения для каждого препарата, после чего рассчитывали среднее арифметическое значение для каждой отдельной особи.
Количественные переменные проверяли на нормальность распределения с использованием тестов Шапиро-Уилка и Колмогорова-Смирнова. Во всех сравниваемых группах индексы экспрессии десмина имели распределение, отличное от нормального, вследствие чего полученные данные обрабатывали непараметрическими методами. Результаты представили в формате медианы (Me) и межквартильного интервала (Q1-Q3). Для обработки исследовательских групп использовали непараметрический аналог однофакторного дисперсионного анализа ANOVA – критерий Краскела-Уоллиса. После сравнения нескольких групп было проведено апостериорное сравнение post-hoc. Данные обрабатывали в программе Statistica 10. Статистически значимыми считали p < 0,05.
Результаты исследования и их обсуждение
По результатам иммуногистохимического исследования выявлено статистически значимое снижение экспрессии структурного белка десмина (p < 0,0001) и количества вставочных дисков (p < 0,0001) в зонах повреждения миокарда особей опытной группы по сравнению с контрольной (рис. 1). В данных иммуногистохимического исследования миокарда крыс контрольных подгрупп (КВ и КН) значимых различий выявлено не было. В опытных подгруппах отмечали постепенное снижение экспрессии десмина и количества вставочных дисков с увеличением срока посттравматического периода, при этом подгруппы низкоустойчивых к стрессу животных демонстрировали более низкие показатели в сравнении с высокоустойчивыми особями (рис. 1).
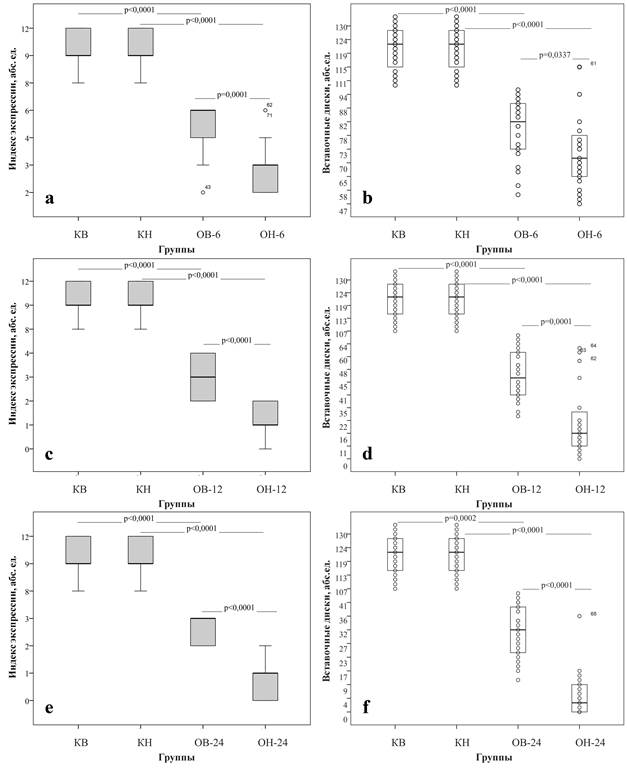
Рис. 1. Индексы экспрессии десмина (боксплоты – a, c, e) и количество вставочных дисков (диаграммы рассеяния – b, d, f) в миокарде крыс с высокой и низкой стрессоустойчивостью контрольных подгрупп (КВ, КН) и опытных подгрупп в исследовательских точках 6 ч (ОВ-6, ОН-6), 12 ч (ОВ-12, ОН-12) и 24 ч (ОВ-24, ОН-24) Примечание: достоверность различий между исследуемыми группами выражена в абсолютных значениях p.
В исследовательской точке 6 часов посттравматического периода уровень экспрессии десмина в миокарде высокоустойчивых к стрессу крыс (ОВ-6) был выше, чем у низкоустойчивых к стрессу особей (ОН-6) (рис. 1а). При количественной оценке вставочных дисков в миокарде крыс подгруппы ОВ-6 также были выявлены более высокие значения по сравнению с подгруппой ОН-6 (рис. 1b). Аналогичные различия в экспрессии десмина и количестве вставочных дисков между высоко- и низкоустойчивыми к стрессу животными наблюдали в исследовательских точках 12 ч (рис. 1 c, d) и 24 ч (рис. 1 e, f).
При качественной оценке экспрессии десмина в миокарде крыс контрольных подгрупп (КВ, КН) было выявлено однородное иммуногистохимическое окрашивание коричневого цвета высокой интенсивности диффузного характера с четким контурированием вставочных дисков в местах соединения кардиомиоцитов во всех полях зрения (рис. 2 a, b). В миокарде крыс, сердца которых извлекали через 6 ч после травмы, иммуногистохимическая реакция представляла собой окрашивание умеренной или высокой интенсивности диффузного или мозаичного характера, при этом интенсивность окрашивания вставочных дисков и их количество заметно снижались по сравнению с подгруппами контроля (рис. 2 c, d). В исследовательской точке 12 ч в миокарде особей подгрупп ОВ-12 и ОН-12 отмечали отдельные фокусы цитоплазматического окрашивания низкой и/или умеренной интенсивности, вставочные диски имели неоднородную слабоинтенсивную окраску (рис. 2 e, f). В подгруппе крыс с высокой стрессоустойчивостью и длительностью посттравматического периода 24 ч (подгруппа ОВ-24) наблюдали фокусы с окраской низкой интенсивности и/или отсутствие иммуногистохимического окрашивания, определялись группы кардиомиоцитов с сохранными вставочными дисками между ними и области отсутствия вставочных дисков (рис. 2g). При оценке участков поврежденного миокарда животных подгруппы ОН-24 было выявлено отсутствие цитоплазматического окрашивания во всех полях зрения и единичные с трудом определяемые вставочные диски с низкой интенсивностью окрашивания (рис. 2h).
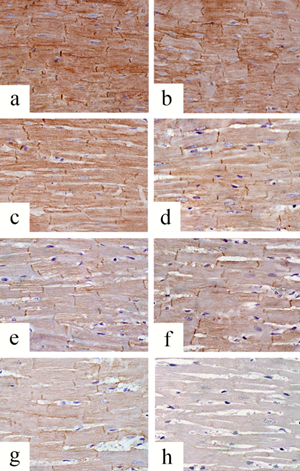 |
Рис. 2. Экспрессия десмина в миокарде крыс в посттравматическом периоде экспериментального ушиба сердца. Продольный срез миокарда. Иммуногистохимическая реакция с моноклональными мышиными антителами Anti-Desmin, увеличение х400
Примечание: a, b – миокард крыс контрольных подгрупп с высокой и низкой стрессоустойчивостью (подгруппы КВ, КН); c, d – миокард крыс опытных подгрупп с высокой и низкой стрессоустойчивостью в исследовательских точках 6 ч (подгруппы ОВ-6, ОН-6); e, f – 12 ч (подгруппы ОВ-12, ОН-12); g, h – 24 ч (подгруппы ОВ-24, ОН-24). Более детальная характеристика отдельных изображений представлена в тексте.
Цитоскелетный белок десмин локализуется в цитоплазме кардиомиоцитов в виде нитей, формируя клеточный каркас и связывая компоненты сократительного аппарата в единую функциональную сеть (сократительные белки, Z-линии, саркоплазматический ретикулум, митохондрии), а также во вставочных дисках, обеспечивая при этом соединение соседних кардиомиоцитов и передачу между ними потенциала действия [10].
Во многих экспериментальных и клинических исследованиях на моделях острой ишемии сердца, хронической сердечной недостаточности, тупой травмы сердца снижение экспрессии десмина свидетельствует о его деструкции [3; 4; 11], которую могут запускать такие факторы, как изменение рН тканей и последующая активация протеаз, появление активированных форм кислорода (АФК), снижение активности фосфорилирования белков из-за ишемии или вызванная гипоксией деполимеризация клеточных структур [12; 13]. Обусловленное этим разрушение эпитопа десмина способствует утрате его способности реагировать с антителами при проведении иммуногистохимической реакции [14].
По мнению авторов, более значительное снижение экспрессии десмина у низкоустойчивых к стрессу особей в сравнении с высокоустойчивыми особями может отражать более тяжелое механическое и гипоксическое повреждение кардиомиоцитов в условиях тупой травмы сердца. При этом менее тяжелое структурное повреждение миокарда у крыс с высокой стрессоустойчивостью, вероятно, обеспечивает относительную сохранность цитоскелетных белков, в том числе за счет активации тканевой стресс-ассоциированной реакции аутофагии.
Усиление деструкции десмина в миокарде крыс в динамике посттравматического периода ушиба сердца вне зависимости от уровня стрессоустойчивости может быть объяснено постепенным накоплением в цитоплазме кардиомиоцитов АФК, Ca2+, нарастанием гипоксии и энергодефицита. У особей с низкой устойчивостью к стрессу дополнительным фактором деструкции десмина, вероятно, служит активация апоптотических процессов в исследовательских точках 12 и 24 ч. Приведенные положения могут быть подтверждены как собственными исследованиями авторов [6], так и иными публикациями, в которых рассматриваются феномены запрограммированной клеточной гибели кардиомиоцитов [15; 16].
Заключение
В посттравматическом периоде экспериментального ушиба сердца происходит постепенное снижение экспрессии цитоскелетного белка десмина в зонах повреждения миокарда вне зависимости от стрессоустойчивости животных. Однако выраженность и динамика экспрессии белка различается у животных с высокой и низкой стрессоустойчивостью: снижение уровней экспрессии десмина у низкоустойчивых к стрессу особей более выражено в сравнении с высокоустойчивыми и отражает более значительные структурные повреждения кардиомиоцитов. Таким образом, полученные результаты демонстрируют различную степень деструкции цитоскелетного белка десмина в альтерированном миокарде в посттравматическом периоде ушиба сердца, обусловленную индивидуальной устойчивостью организма к стрессу.



