Введение
Исследования последних десятилетий показывают неуклонный рост случаев различных заболеваний аутоиммунного генеза с преимущественно гранулематозным типом воспаления, которые нередко приводят к летальным исходам [1]. Согласно данным мировой литературы, установлена тесная зависимость между увеличением количества случаев различных аутоиммунных гранулематозных заболеваний и дефицитом витамина D (VD) [2, 3]. Данная взаимосвязь предусматривает различные неклассические эффекты VD, опосредованные активацией собственных рецепторов (VDR), проявляющиеся влиянием на клеточный и гуморальный иммунитет [4]. Тем не менее, неклассические эффекты VD в отношении патогенеза аутоиммунных гранулематозных заболеваний с позиций влияния на ключевые межклеточные взаимодействия, особенно на клетки, экспрессирующие белок CD20, остаются недостаточно изученными.
CD20 – член семейства тетраспанов интегральных мембранных белков, состоящий из 297 аминокислот и синтезируемый исключительно клетками гуморального иммунитета, а именно В-клетками. Он экспрессируется практически всеми клетками данного дифферона (незрелыми и наивными В-клетками, В-клетками памяти и В-клетками герминативного центра), за исключением ранних пре-В-лимфоцитов или плазмоцитов [5]. Таким образом, CD20 является маркером практически всех В-клеток, а клетки, экспрессирующие его, являются CD20 позитивными (CD20+). В данном исследовании можно определить влияние парикальцитола практически на все В-клетки, за исключением ранних пре-В-клеток и плазматических клеток.
Изучены особенности распределения CD20+ клеток в очаге индуцированного гранулематозного воспаления. С целью индуцирования иммунного гранулематозного воспаления была модифицирована модель саркоидоза легких с использованием супероксиддисмутазы А (SOD A) [6]. Выбор данной модели обусловлен тем, что:
1) саркоидоз является морфологическим «эталоном» для изучения неспецифических иммунных гранулем, поскольку многие гранулематозные заболевания могут клинически и гистологически имитировать саркоидоз [7];
2) иммунное воспаление, индуцированное SOD A в эксперименте с мышами, показало гистологический и иммунофенотипический профили саркоидоза, которые хорошо коррелировали с профилями при саркоидозе у человека [8];
3) обнаружена обратная зависимость между уровнем VD и тяжестью гранулематозных заболеваний, включая саркоидоз [9].
Выбор CD20+ клеток обусловлен следующими факторами:
1) ранее была выявлена локализация CD20+ клеток на периферии тканей больных саркоидозом [10], в некоторых случаях количество CD20+ клеток превосходило количество Т-клеток [11];
2) B-клетки при саркоидозе реагируют на аутоантигены, что дополнительно подтверждается высоким процентом CD20+ клеток с фенотипом возрастных В-клеток (age-associated B cells), которые типичны для гранулематозных заболеваний [12];
3) саркоидоз можно успешно лечить с помощью анти-CD20 моноклональных антител, таких как ритуксимаб [13].
В доступной литературе отсутствуют иммуногистохимические исследования на экспериментальном материале, посвященные изучению особенностей распределения CD20+ клеток в очаге иммунного гранулематозного воспаления на фоне неклассических эффектов VD, опосредованных активацией VDR. В связи с этим целью данного экспериментального исследования было изучение неклассических эффектов VD в отношении особенностей распределения В-клеток, экспрессирующих белок CD20, в очаге гранулематозного воспаления с помощью иммуногистохимических методов.
Материал и методы исследования
Эксперименты над животными были выполнены в соответствии: с Директивой Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22 сентября 2010 г. о защите животных, использующихся для научных целей, с Федеральным законом от 27.12.2018 № 498-ФЗ (ред. от 27.12.2019 г.) «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации», а также с учетом рекомендаций этического комитета ФГАОУ ВО «КФУ имени В.И. Вернадского» (протокол № 10 от 27.10.2022 г.).
Исследование проводили на 40 белых крысах на базе Ордена Трудового Красного Знамени Медицинского института им. С.И. Георгиевского, г. Симферополь, Россия. В соответствии с поставленной целью, были изучены особенности распределения В-клеток, экспрессирующих белок CD20, в очаге аутоиммунного гранулематозного воспаления на фоне введения парикальцитола. Животных случайным образом распределили на группы: контрольную (К) (n=10) и экспериментальную группу (Э) (n=30), которую разделили на три подгруппы (Э1, Э2 и Э3). Экспериментальные крысы получали парикальцитол (19-нор-1,25-гидрокси-витамин D2) 1 раз в 3 дня из расчета ~200 нг/животное, который вводили внутрибрюшинно. При этом крысы Э1 (n=10) получали парикальцитол с первого дня эксперимента, крысы Э2 (n=10) получали парикальцитол с момента сенсибилизации SOD A, а крысы Э3 (n=10) получали парикальцитол с момента введения разрешающей дозы антигена. Крысы контрольной группы не получали парикальцитол. На 10-й день крысам интрадермально вводили антиген SOD A в дозе 50 мкг, растворенный в 0,25 мл полного адъюванта Фрейнда. Через 10 дней после этого вводили аналогичную дозу SOD A, растворенную в 0,25 мл физиологического раствора. Всех крыс вывели из эксперимента на 35-е сутки путем декапитации на фоне седации. Для этого животным вводили 0,1%-ный раствор медетомидина гидрохлорида объемом 0,2 мл внутрибрюшинно.
Супероксиддисмутаза А представляет собой металлофермент и фактор патогенности, секретируемый Mycobacterium и Nocardia. С одной стороны, он преобразует свободные радикалы кислорода, генерируемые макрофагами хозяина, в перекись водорода и кислород. С другой стороны, он стимулирует клеточный иммунный ответ в поврежденных тканях и органах. SOD A была синтезирована в компании AtaGenix Laboratories (Ухань, КНР) в 2023 г.
В качестве коррекции использовали фармакологический аналог VD – парикальцитол (Земпалар®, Италия) 5 мкг/мл в виде раствора для парентерального введения, который оказывает минимальное воздействие на концентрацию кальция и фосфора.
После эвтаназии и декапитации животных в месте введения SOD A определяли местное уплотнение тканей (инфильтрат), которое фиксировали в 10%-ном забуференном формалине. Для подготовки тканей к гистологическому анализу полученные образцы обезвоживали в серии этанолов с возрастающей концентрацией, начиная с 70% и заканчивая 100%, и просветляли в ксилоле. После этого образцы заливали парафином для создания твердых блоков, чтобы сохранить структуру тканей и получить качественные гистологические срезы. После парафинизации образцов тканей готовили срезы толщиной 4 мкм с использованием гибридного гистологического процессора Logos (Milestone Medical, Италия) и модуля Leica EG1150 (Leica Biosystems, Германия). Серийные гистологические срезы толщиной 4 мкм получены с использованием автоматического ротационного микротома Leica RM2255 (Leica Biosystems, Германия). Далее использовали стандартную гистологическую окраску – гематоксилин и эозин – для окрашивания полученных срезов. Для проведения качественной оценки морфологических преобразований с последующей морфологической оценкой иммунного воспаления использовали комплекс Olympus CX-33, включающий: микроскоп Olympus CX-33 40×100×400, цифровую камеру и персональный компьютер.
Для иммуногистохимического анализа диффузного гранулематозного инфильтрата, вызванного супероксиддисмутазой A, использовали гистологические срезы (~4 мкм). Окрашивание проводили с использованием полуавтоматического иммуногистайнера BondMax (Leica Biosystems, Германия). Протокол окрашивания включал депарафинизацию, термическую демаскировку антигенов, блокирование пероксидазы, инкубацию с антителами (АТ) в течение 15 минут при температуре 20°C и визуализацию с помощью системы Bond Polymer Refine (Leica Biosystems, Германия). Перед визуализацией проводили контрастное окрашивание гематоксилином на протяжении 2 минут для получения более детализированных изображений тканей и клеток, что облегчает их анализ под микроскопом. С помощью гистосканера Aperio CS2 (Leica Biosystems, Германия) были отсканированы все гистологические срезы. Для анализа изображений использовали программное обеспечение Aperio ImageScope и ImageJ.14.
Для идентификации клеток, экспрессирующих маркер CD20, в очаге воспаления использовали поликлональные АТ против CD20 IgG (кат. #DF13391; Affinity Biosciences ®).
Степень иммуногистохимической реакции оценивали как позитивную в случае коричневого окрашивания цитоплазмы или цитоплазматической мембраны. Степень окрашивания оценивали полуколичественно как сумму общей интенсивности коричневого окрашивания (минимальная реакция или ее отсутствие, умеренная или сильно положительная). В качестве позитивного контроля применяли образцы нёбных миндалин человека. Образцы, обработанные с отсутствием первичных АТ, использовали в качестве отрицательного контроля.
Статистический анализ проводили с помощью программного обеспечения Microsoft Office Excel и Statistica 10.0 и с использованием описательной статистики. Сравнительный анализ был проведен с использованием U-критерия Манна–Уитни. Результаты исследования были выражены с помощью медианы (М), первого (Q1) и третьего квартилей (Q3) в виде М [Q1; Q3]. Критический уровень значимости р<0,05.
Результаты исследования и их обсуждение
Оценивая экспрессию поверхностного маркера CD20, следует отметить, что во всех образцах кожи, полученных от контрольных животных, была выявлена иммунонегативная реакция, особенно в центральной и перифокальной области незрелой иммунной гранулемы, тогда как в межгранулемных областях были обнаружены единичные CD20+ клетки (рис. 1).
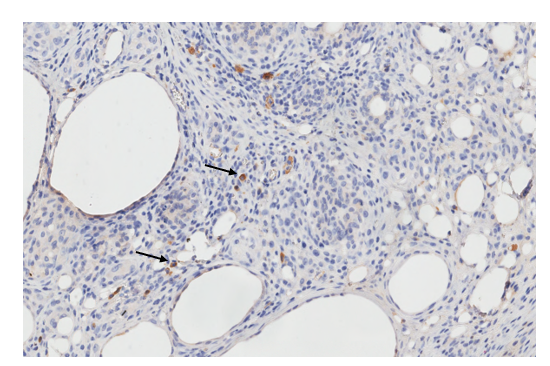

Рис. 1. Инфильтрация кожи (дермы) контрольной крысы с гранулематозным воспалением CD20+ клетками. Единичные CD20+ клетки в межгранулемных областях. Иммуногистохимическая реакция с антителами против CD20+ антигена. Ув. х400
Примечание: стрелка – CD20+ клетки.
Однако в экспериментальной группе, преимущественно в первой и второй подгруппах, были выявлены CD20+ клетки, которые местами формировали клеточные скопления на фоне созревания иммунных гранулем и характеризовались высокой степенью коричневого окрашивания цитоплазмы и цитоплазматической мембраны (рис. 2).
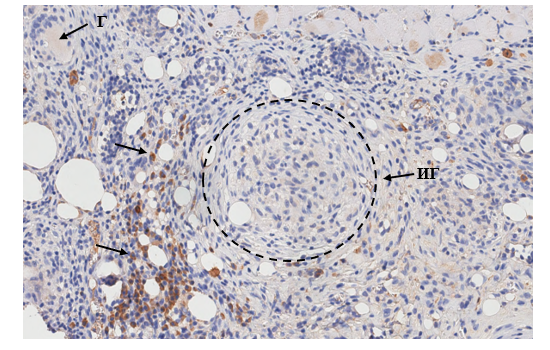


Рис. 2. Инфильтрация кожи (дермы) крысы первой экспериментальной группы CD20+ клетками. Скопления CD20+ клеток в перифокальной области иммунной гранулемы. Иммуногистохимическая реакция с антителами против CD20+ антигена. Ув. х400
Примечание: стрелка – CD20+ клетки, Г – гигантская клетка Пирогова–Лангханса, ИГ – иммунная гранулема.
Статистический анализ плотности CD20+ клеток в гранулематозном инфильтрате показал, что наибольший уровень экспрессии маркера CD20 был отмечен в группе Э2 и составил 17,0 [12,0; 24,0]. В контрольной группе была выявлена очень низкая экспрессия маркера CD20, которая была незначительно ниже аналогичного показателя в группе Э3 (1,0 [0,0; 2,0] и 3,0 [1,0; 6,0] соответственно, р=0,03). В первой экспериментальной группе уровень экспрессии маркера CD20 был выше в 7 раз по сравнению с контролем и составил 7,0 [3,5; 9,5] (р=0,0004).
Таким образом, в группах Э1, Э2 и Э3 после введения парикальцитола плотность CD20+ клеток достоверно увеличивалась по сравнению с контролем в 7, 17 и 3 раза соответственно (во всех случаях р=0,03), что обусловлено массовой миграцией клеток лимфоидного ряда в область иммунного воспаления. Резкое увеличение количества CD20+ клеток во всех экспериментальных группах свидетельствует о том, что не только клеточный, но и гуморальный иммунитет играет важную роль в патогенезе иммунной гранулемы.
Следует отметить, что увеличение уровня экспрессии маркера CD20 во всех экспериментальных группах может свидетельствовать о важной роли B-лимфоцитов в формировании и созревании иммунной гранулемы, особенно на этапе сенсибилизации и введения разрешающей дозы антигена. Это подтверждается тем, что количество CD20+ клеток было значительно увеличено на этапе сенсибилизации по сравнению с третьей экспериментальной группой, где вводили разрешающую дозу SOD A (р=0,000019) (таблица).
Уровень экспрессии маркера CD20 в контрольной и экспериментальных группах крыс (M [Q1; Q3])
|
Показатель |
КГ |
ЭГ 1 |
ЭГ 2 |
ЭГ 3 |
|
M [Q1; Q3] |
1,0 [0,0; 2,0] |
7,0 [3,5; 9,5]* |
17,0 [12,0; 24,0]* |
3,0 [1,0; 6,0]* |
Примечание: КГ – контрольная группа животных, ЭГ – экспериментальная группа животных, * – p<0,05 в сравнении с контролем.
В-лимфоциты, вероятно, рекрутируются из периферической крови и костного мозга [14] с целью выработки АТ и провоспалительных интерлейкинов, для элиминации антигена и координирования аутоиммунного процесса посредством влияния на другие иммунные клетки, которые также участвуют в формировании и созревании иммунной гранулемы [15]. Эти изменения в гранулематозном инфильтрате обусловлены иммуномодулирующим влиянием парикальцитола на CD20+ клетки через лиганд-ассоциированную активацию рецепторов VDR, что особенно выражено на этапе сенсибилизации и формирования иммунной гранулемы.
Заключение
Было обнаружено, что экспрессия маркера CD20 значительно увеличилась в экспериментальных группах по сравнению с контрольной группой. Это свидетельствует о важной роли B-лимфоцитов в формировании и созревании иммунной гранулемы, особенно на этапе сенсибилизации и введения разрешающей дозы антигена. Иммуномодулирующее действие парикальцитола, вероятно, способствует активации B-лимфоцитов, что подчеркивает его потенциал в терапии заболеваний, связанных с гранулематозным воспалением. Эти данные открывают новые перспективы для дальнейших исследований в области иммунологии и разработки терапевтических стратегий.
Автор выражает особую благодарность старшему преподавателю кафедры физики конденсированных сред, физических методов и информатики в медицине Физико-технического института КФУ Глушенкову А.Н. за оказанную помощь при написании настоящей статьи.



