Введение
По современным представлениям, акне является распространенным дерматозом, развивающимся в результате воспаления пилосебацейной единицы и клинически характеризуется комедонами, папулами, пустулами, узлами и кистами. Данные по распространенности акне существенно различаются: отмечается, что акне страдают более 85 % лиц подросткового возраста, из которых около 8 % – тяжелой формой заболевания, что делает акне наиболее распространенным дерматозом во всем мире. Согласно исследованию «Глобальное бремя болезней, травм и факторов риска» (GBD), в 2019 г. акне диагностировалось преимущественно в возрасте 15–49 лет. При этом тяжелая форма акне с формированием рубцов часто носит торпидный, рецидивирующий характер и симптомы сохраняются во взрослом возрасте, что существенно снижает качество жизни больных и относит данное заболевание к значимой медико-социальной проблеме [1, 2].
На сегодняшний день вклад генетической детерминированности в развитии акне широко обсуждается и еще не до конца ясен. Имеются сведения о семейном анамнезе развития акне и повышенной частоте встречаемости заболевания у монозиготных близнецов. Множественные семейные исследования типа «случай-контроль» и исследования близнецов с участием представителей различных этнических групп показали сильную наследуемость с оценками выше 78 %, в то время как конкордантность между монозиготными близнецами по сравнению с дизиготными близнецами была выше как по клиническим проявлениям акне, так и по тяжести заболевания [3, 4].
Недавние исследования генов-кандидатов и полногеномные ассоциативные исследования (GWAS) также показали, что гены и локусы, связанные с проявлением и тяжестью акне, влияют на функцию и активность сальных желез или иммунные и воспалительные реакции. Два таких локуса предрасположенности гена были обнаружены у ханьцев, в то время как у европеоидов было обнаружено до пятнадцати [5]. При изучении ассоциации полиморфизмов генов фактора некроза опухоли альфа-308G/A (Tumornecrosisfactoralpha, TNF-α -308 G/A и интерлейкина 10-1082 A/G (Interleukin 10, IL10-1082 A/G) с акне было установлено, что однонуклеотидный полиморфизм (ОНП; Single Nucleotide Polymorphism, SNP) TNF-α -308 G/A ассоциирован с акне, тогда как SNP IL10-1082 A/G не имеет взаимосвязи с риском развития акне и его степенью тяжести. Кроме того, авторы показали, что более высокий риск акне ассоциирован с гомозиготными вариантами как GG, так и АА полиморфизма TNF-α-308 G/A. При этом у пациенток женского пола в 76 % случаев выявлялся вариант GG (ОШ = 2,6), а у пациентов-мужчин – генотипы AA и GA в 9,4 % и 35,9 % случаев соответственно [6]. По данным Younis S. с соавт. в 2021 г. исследование корреляции между полиморфизмами гена TNF-α в локусах (−857 rs1799724, −863 1800630 и −1031 1799964), уровнями TNF-α в сыворотке крови, липидными профилями и частотой появления вульгарных акне у пациентов из Пакистана выявило корреляцию полиморфизма TNF-α 863 и развития акне. Кроме того, наличие значительной доли аллеля −857 Т в контрольной группе предполагает потенциальный защитный эффект против развития акне. При этом отсутствовала связь между полиморфизмом −1031 и развитием акне [7]. При анализе полиморфизмов гена CYP1A1 в индонезийской популяции было установлено, что риск развития акне связан с гетерозиготными аллелями гена CYP1A1 MspI (OR = 2,21 95 % ДИ 0,71–6,87). По данным метаанализа с акне ассоциированы такие гены, как SELL rs7531806, TGFB rs1159268, TIMP2 rs8179090, DDB2 rs747560, FST rs38055, IGF1 CA repeat VNTR и PPARG rs1801282 [3]. Имеются сведения об ассоциации в 14 из 17 ранее зарегистрированных локусов восприимчивости к акне и в 29 новых локусах. В этих исследованиях указывается на то, что регуляция клеточных процессов обусловлена несколькими предполагаемыми причинными генами, ранее вовлеченными в установленные локусы восприимчивости к акне, включая LAMC2, TGFB2, WNT10A, LGR6, FGF2 и GLI2 [3].
Таким образом, в настоящее время результаты различных исследований показывают несоответствия: в одних сообщается, что определенный генетический вариант увеличивает риск возникновения акне, тогда как в других этого не происходит. Это определяет актуальность данного раздела молекулярно-генетических исследований.
Целью исследования было определение и анализ вариантов полиморфных локусов генов иммунной регуляции (TTC7A, SH3BP2, RASGRP1, MAP3K14, PLCG2, MPI и RNF31) у пациентов с тяжелой степенью акне.
Материалы и методы исследования
В 2018–2021 гг. было проведено проспективное открытое нерандомизированное одноцентровое сравнительное исследование на кафедре кожных болезней и косметологии ФДПО ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России. В исследование было включено 70 чел. в возрасте от 15 до 46 лет (медиана – 22,1 [10,2; 25,4] года), которые подписали информированное согласие. В основной группе было 50 пациентов (29 мужчин и 21 женщина) с тяжелой формой акне в возрасте на момент исследования от 15 до 46 лет (медиана – 23,2 [11,5; 26,6] года). Группу сравнения составили 20 условно здоровых лиц (13 мужчин и 7 женщин) от 16 до 40 лет (медиана – 19,4 [10,0; 23,1] года). Таким образом, основная группа и группа сравнения были сопоставимы по половозрастным характеристикам (p > 0,05) [8].
Мoлекулярно-генетическое исследование было проведено всем 50 пациентам основной и 20 условно здоровым лицам группы сравнения методом высокопроизводительного секвенирования дезоксирибонуклеиновой кислоты (ДНК) – секвенирование «нового поколения» (next-generation sequencing, NGS) в лаборатории молекулярной биологии ФГБУ «НМИЦ ДГОИ им. Дм. Рогачева» МЗ РФ. Геномная ДНК былa выделенa из образцов цельной крови обследованных больных с использованием набора CellSep Advanced Kit. (DiaSorin Ireland Ltd., Ирландия) согласно инструкции производителя. Проведено секвенирование генов TTC7A, SH3BP2, RASGRP1, MAP3K14, PLCG2, MPI и RNF31.
Индивидуальные лигированные библиотеки собирали с помощью набора NebNext Ultra II DNA Library Prep Kit for Illumina (New England Biolabs, США). Для пробоподготовки применялась методика гибридизационного селективного обогащения фрагментами ДНК с кастомной панелью зондов (Roche, Швейцария), по протоколу производителя о проведении реакции обогащения с библиотекой зондов SeqCap EZ для секвенаторов «Illumina». Анализ ДНК пациентов проводили на платформе MiSeq (Illumina, США). Данные секвенирования обрабатывали с использованием автоматизированного алгоритма биоинформатического анализа.
Для оценки популяционных частот полученных вариантов были проанализированы параметры международного проекта gnomAD Exomes (ExAC) для экзонных вариантов и базы gnomAD Genomes для интронных вариантов. Анализ патогенности найденных миссенс-вариантов проведен с помощью компьютерных программ предсказания патогенности замен аминокислот (SIFT, PolyPhen-2, PROVEAN, UMD Predictor). Анализ компьютерного предсказания эффекта изменений в сайтах сплайсинга или прилежащих к сайту сплайсинга участках проводился посредством программ MutationTaster, Human Splicing Finder и NNSplice [8].
Статистически результаты рассчитаны с применением программного обеспечения XLSTAT2019. Оценку соответствия распределения количественных показателей нормальному закону проводили с применением критерия Шапиро – Уилка. В случае распределения показателя, отличного от нормального, он описывался медианой (Ме) и верхним и нижним квартилями [Q1; Q3]. Значимость различия в независимых выборках оценивали посредством критерия Манна – Уитни. Для оценки связи номинальных и порядковых признаков строили таблицы сопряженности и на их основе рассчитывали критерий χ2 Пирсона. Для оценки факторов риска рассчитывали отношение шансов (ОШ). Для определения функционального значения генов в биологических путях организма использована онлайн-программа с базой данных STRING. Программа осуществляет математическое прогнозирование на основании баз данных Genomic Context Predictions, High-throughput Lab Experiments, (Conserved) Co-Expression, Automated Textmining. База данных STRING в настоящее время охватывает 24584628 белков от 5090 организмов [8–10]. Статистически значимыми различия считали при р < 0,05.
Результаты исследования и их обсуждение
Проведенное автором исследование позволило определить 4 группы генов иммунной регуляции: гены клеток системы врожденного и адаптивного иммунитета (TTC7A, SH3BP2, RASGRP1), факторов роста и их путей (MAP3K14, PLCG2), иммуноглобулинов (MPI) и гены, регулирующие воспаление (RNF31), и автором были стратифицированы изученные однонуклеотидные полиморфизмы (single nucleotide polymorphism, SNP) генов по их регуляторной значимости.
Характеристика SNPs генов TTC7A, SH3BP2, MAP3K14, MPI, PLCG2 и RNF31 в экзонах представлена в табл. 1.
Таблица 1
Характеристика полиморфных локусов генов TTC7A, SH3BP2, MAP3K14, MPI, PLCG2 и RNF31 в экзонах
|
Полиморфный локус (SNP) |
Хромосо-ма |
Позиция на хромосоме |
p-value (z-тест для пропорций) |
ОШ (95 % ДИ), уровень значимости |
Ген-кандидат |
|
rs17480869 |
2 |
47220622 |
0,032* |
2,79 (1,066–7,309), p = 0,037* |
TTC7A |
|
rs201805434 |
2 |
47168856 |
0,525 |
1,221 (0,04–30,06), p = 0,903 |
TTC7A |
|
rs374960733 |
2 |
47238529 |
0,525 |
1,221 (0,04–30,06), p = 0,903 |
TTC7A |
|
rs142810509 |
2 |
47249057 |
0,525 |
1,221 (0,04–30,06), p = 0,903 |
TTC7A |
|
rs4953451 |
2 |
47274443 |
0,367 |
2,06 (0,097–43,775), p = 0,644 |
TTC7A |
|
rs140166160 |
2 |
47287925 |
0,367 |
2,06 (0,097–43,775), p = 0,644 |
TTC7A |
|
rs3739099 |
2 |
47301029 |
0,944 |
1,034 (0,395–2,708). p = 0,944 |
TTC7A |
|
-(.) |
4 |
2831251 |
0,030* |
2,49 (1,075–5,787), p = 0,033* |
SH3BP2 |
|
rs140326137 |
4 |
2826376 |
0,367 |
2,06 (0,097–43,775), p = 0,644 |
SH3BP2 |
|
rs1047833 |
17 |
43342141 |
0,020* |
2,63 (1,143–6,049), p = 0,023* |
MAP3K14 |
|
-(.) |
17 |
43342067 |
0,525 |
1,221 (0,04–30,06), p = 0,903 |
MAP3K14 |
|
rs11574819 |
17 |
43364638 |
0,525 |
1,221 (0,048–30,60), p = 0,903 |
MAP3K14 |
|
rs143313926 |
17 |
43367998 |
0,525 |
1,221 (0,048–30,60), p = 0,903 |
MAP3K14 |
|
rs1130741 |
15 |
75189930 |
0,026* |
2,43 (1,096–5,401), p = 0,029* |
MPI |
|
-(.) |
15 |
75185485 |
0,525 |
1,221 (0,048–30,60), p = 0,903 |
MPI |
|
rs104894489 |
15 |
75185647 |
0,525 |
1,221 (0,048–30,60), p = 0,903 |
MPI |
|
rs1143687 |
16 |
81922813 |
0,065 |
7,443 (0,419–132,07), p = 0,171 |
PLCG2 |
|
rs149481717 |
14 |
24620821 |
0,367 |
2,055 (0,096–43,77), p = 0,644 |
RNF31 |
|
rs2277484 |
14 |
24629744 |
0,199 |
3,777 (0,198–71,78). p = 0,376 |
RNF31 |
Примечания: * – статистически значимые различия, p < 0,05; – (.) – впервые описанный автором полиморфный локус.
Как следует из данных табл. 1, при оценке полиморфных локусов генов клеток системы врожденного и адаптивного иммунитета в экзонах достоверно повышают риск развития акне тяжелого течения по одному SNPs гена TTC7A (rs17480869) и гена SH3BP2 (-(.) в 2,79 и 2,49 раза (p < 0,05). При оценке полиморфных локусов генов факторов роста и их путей в экзонах один SNPs гена MAP3K14 (rs1047833) достоверно повышает риска акне в 2,63 раза (p < 0,05). При оценке SNPs генов иммуноглобулинов в экзонах один SNPs гена MPI (rs1130741) повышает риск развития акне в 2,43 раза (p < 0,05).
Характеристика SNPs генов в интронах и в регионе 5’-UTR у больных акне приведена в табл. 2.
Таблица 2
Характеристика полиморфных локусов генов RASGRP1, TTC7A, PLCG2, MAP3K14, MPI, RNF31, в интронах и в регионе 5’-UTR у больных акне
|
Полиморфный локус (SNP) |
Хромо-сома |
Позиция на хромосоме |
Интрон / 5’-UTR |
p-value (z-тест для пропорций) |
ОШ (95 % ДИ), уровень значимости |
Ген-кандидат |
|
rs55728265 |
15 |
38856961 |
5’-UTR |
0,003* |
12,32 (1,606–94,463), p = 0,016* |
RASGRP1 |
|
rs34059658 |
15 |
38786370 |
Интрон |
0,099 |
2,538 (0,815–7,907), p = 0,108 |
RASGRP1 |
|
rs4467032 |
15 |
38790885 |
Интрон |
0,275 |
1,63 (0,673–3,967), p = 0,278 |
RASGRP1 |
|
rs28710819 |
15 |
38803689 |
Интрон |
0,199 |
3,777 (0,199–71,789), p = 0,376 |
RASGRP1 |
|
rs148868575 |
15 |
38811778 |
Интрон |
0,199 |
3,777 (0,199–71,789), p = 0,376 |
RASGRP1 |
|
rs2033533 |
2 |
47177787 |
Интрон |
0,007* |
10,37 (1,345–79,926), p = 0,023* |
TTC7A |
|
rs60188383 |
2 |
47220448 |
Интрон |
0,032* |
2,79 (1,065–7,309) p = 0,036* |
TTC7A |
|
rs6751599 |
2 |
47220784 |
Интрон |
0,031* |
2,79 (1,066–7,310), p = 0,036* |
TTC7A |
|
rs7576915 |
2 |
47221693 |
Интрон |
0,032* |
2,79 (1,066–7,309), p = 0,037* |
TTC7A |
|
rs140303915 |
2 |
47168597 |
5’-UTR |
0,268 |
2,907 (0,146–57,579) |
TTC7A |
|
rs2304286 |
2 |
47202314 |
Интрон |
0,231 |
3,391 (0,410–28,038) |
TTC7A |
|
rs115423725 |
2 |
47233340 |
Интрон |
0,149 |
4,664 (0,252–86,351) |
TTC7A |
|
rs17036060 |
2 |
47238254 |
Интрон |
0,086 |
6,497 (0,362–116,489) |
TTC7A |
|
rs61155978 |
2 |
47238383 |
Интрон |
0,113 |
5,571 (0,306–101,251) |
TTC7A |
|
rs4888183 |
16 |
81892708 |
Интрон |
0,013* |
2,55 (1,204–5,416), p = 0,014* |
PLCG2 |
|
rs12596639 |
163 |
81892913 |
Интрон |
0,028* |
3,33 (1,082–10,237), p = 0,036* |
PLCG2 |
|
rs41301799 |
16 |
81902746 |
Интрон |
0,061 |
5,827 (0,736–46,125), p = 0,095 |
PLCG2 |
|
rs56070867 |
16 |
81902763 |
Интрон |
0,061 |
5,827 (0,736–46,125), p = 0,095 |
PLCG2 |
|
rs41312260 |
16 |
81904268 |
Интрон |
0,061 |
5,827 (0,736–46,125), p = 0,095 |
PLCG2 |
|
rs4889428 |
16 |
81924994 |
Интрон |
0,231 |
2,176 (0,594–7,972), p = 0,240 |
PLCG2 |
|
rs41305763 |
16 |
81960951 |
Интрон |
0,086 |
6,497 (0,362–116,489), p = 0,204 |
PLCG2 |
|
-(.) |
17 |
43367816 |
Интрон |
0,002* |
4,67 (1,685–12,927), p = 0,003* |
MAP3K14 |
|
rs781325108
|
17 |
43351777 |
Интрон |
0,525 |
1,221 (0,048–30,606), p = 0,903 |
MAP3K14 |
|
rs7210529 |
17 |
43366547 |
Интрон |
0,525 |
1,221 (0,048–30,606), p = 0,903 |
MAP3K14 |
|
rs11638130 |
15: |
75183935 |
Интрон |
0,034* |
2,34 (1,053–5,189), p = 0,036* |
MPI |
|
rs11633472 |
15 |
75184084 |
Интрон |
0,044* |
2,25 (1,011–4,987), p = 0,047* |
MPI |
|
rs7495739 |
15 |
75185670 |
Интрон |
0,034* |
2,33 (1,053–5,189), p = 0,036* |
MPI |
|
rs150459016 |
15 |
75188889 |
Интрон |
0,499 |
0,394 (0,024–6,455), p = 0,514 |
MPI |
|
rs12593975 |
15 |
75189591 |
Интрон |
0,872 |
1,206 (0,122–11,953), p = 0,873 |
MPI |
|
rs2295979 |
14 |
24624741 |
Интрон |
0,037* |
2,21 (1,041–4,689), p = 0,039* |
RNF31 |
|
rs4982862 |
14 |
24625031 |
Интрон |
0,037* |
2,21 (1,041–4,689), p = 0,039* |
RNF31 |
|
rs150934068 |
14 |
24616618 |
Интрон |
0,367 |
2,055 (0,096–43,77), p = 0,644 |
RNF31 |
|
rs115578731 |
14 |
24616778 |
5’-UTR |
0,367 |
2,055 (0,096–43,77), p = 0,644 |
RNF31 |
|
rs112309739 |
14 |
24618242 |
Интрон |
0,268 |
2,907 (0,146–57,57), p = 0,483 |
RNF31 |
|
rs743272 |
14 |
24618859 |
Интрон |
0,269 |
2,348 (0,496–11,11), p = 0,281 |
RNF31 |
Примечания: * – статистически значимые различия, p < 0,05; – (.) – впервые описанный автором полиморфный локус.
Из данных табл. 2 следует, что SNPs генов клеток системы врожденного и адаптивного иммунитета в интронах: достоверно повышают риск развития акне тяжелого течения четыре SNPs гена TTC7A (rs2033533, rs6018838, rs6751599, rs7576915) и один SNPs гена RASGRP1 (rs55728265) в регионе 5’-UTR в 10,37; 2,79; 2,79; 2,79 и в 12,32 раза соответственно (p < 0,05). При оценке полиморфных локусов генов факторов роста и их путей установлено, что достоверно предрасполагают к развитию акне тяжелого течения в интронах: два SNPs гена PLCG2 (rs4888183, rs12596639) и 1 SNPs гена MAP3K14 (-(.) в 2,55; 3,33; 4,67 раза соответственно (p<0,05). При оценке полиморфных локусов генов иммуноглобулинов достоверно предрасполагают к развитию акне тяжелого течения в интронах 3 SNPs гена MPI (rs11638130, rs11633472; rs7495739) в 2,34; 2,25; 2,33 раз соответственно (p < 0,05). При оценке полиморфных локусов генов, регулирующих воспаление в интронах достоверно повышают риск развития акне 2 SNPs гена RNF31 (rs2295979; rs4982862) в 2,21 и 2,21 раз соответственно (p < 0,05).
Некоторые из генов, участвующих в проявлении и тяжести акне, участвуют в иммунных и воспалительных реакциях. Полученные результаты проведенного автором исследования позволили дать характеристику полиморфных локусов генов иммунной регуляции (TTC7A, SH3BP2, RASGRP1, MAP3K14, PLCG2, MPI и RNF31) у пациентов с тяжелой степенью акне, которые выявлены автором впервые. При этом диагностированные автором полиморфные локусы 4 групп генов иммунной регуляции: гены клеток системы врожденного и адаптивного иммунитета (TTC7A, SH3BP2, RASGRP1), факторов роста и их путей (MAP3K14, PLCG2), иммуноглобулинов (MPI) и гены, регулирующие воспаление (RNF31) достоверно повышают риск развития акне тяжелой степени тяжести в 2,21–12,32 раза (p < 0,05). Выявленные полиморфные локусы генов иммунной регуляции оказывают влияние на формирование иммуновоспалительных реакций, развивающихся на ранней, субклинической стадии акне.
TTC7A (Tetratricopeptide Repeat Domain 7A) – ген кодирует фактор TTC7A, регулирующий иммунные реакции и миграцию лейкоцитов [11]. Полученные автором данные о достоверной ассоциации SNP гена TTC7A с акне тяжелого течения, вероятно, могут вызывать нарушения в подвижности клеток, что ведет к накоплению повреждений ДНК и снижению жизнеспособности клеток [1].
SH3BP2 (SH3 Domain Binding Protein 2) – ген кодирует белок, который участвует в передаче сигналов Т-клеточный рецептор (TCR) наивным CD4+ Т-клетки. Полученные автором данные достоверно ассоциированного с акне тяжелого течения SNPs гена SH3BP2, вероятно, свидетельствуют о дисбалансе активации врожденной иммунной системы [1].
RASGRP1 (RAS guanyl releasing protein 1) – ген, который активирует каскад киназ Erk/MAP и регулирует развитие, гомеостаз и дифференцировку Т-клеток и В-клеток, а также цитотоксичность NK-клеток [12]. Полученные автором данные о достоверной ассоциации SNPs гена RASGRP1 с акне тяжелого течения, вероятно, свидетельствуют о наличии генетического механизма дисрегуляции клеток врожденной и адаптивной иммунной системы.
MAP3K14 (mitogen-activated protein kinase kinase kinase 14) – ген кодирует митоген-активируемую протеинкиназу киназу 14, которая связывается с TRAF2 – TNF-рецептор-ассоциированного фактора 2 (TRAF2), взаимодействующим с рецепторами TNF, передают сигналы, что активирует NF-kappaB [1, 13]. Полученные автором данные о достоверной ассоциации SNPs гена MAP3K14 с тяжелым течением акне, по-видимому, указывают на дисбаланс TRAF2 неканонического пути NF-kB и провоспалительных сигнальных путей TLR, что может являться патогенетическим механизмом затяжного хронического воспалительного процесса при акне тяжелой степени.
PLCG2 (Phospholipase C Gamma 2) – ген кодирует белок PLCγ2, который является трансмембранным сигнальным ферментом,катализирующим реакции образования молекул – посредников передачи сигналов от рецепторов фактора роста и рецепторов иммунной системы через клеточную мембрану. Zhou et al. (2012) впервые сообщили о случае аутовоспалительной фосфолипазной Cγ2-ассоциированной недостаточности антител и иммунной дисрегуляции (autoinflammatory phospholipase Cγ2 (PLCγ2)-associated antibody deficiency and immune dysregulation (APLAID), редкого аутосомно-доминантного аутовоспалительного заболевания, вызванного мутациями в гене PLCG2. Эта патология характеризуется рецидивирующими поражениями кожи с волдырями и широкой фенотипической вариабельностью, включая воспаление глаз, артралгию, энтероколит, интерстициальный пневмонит и рецидивирующие синопульмональные инфекции, сопровождающиеся иммунодефицитом. Авторами описаны клинические проявления заболевания у отца и его дочери с ранним началом рецидивирующего воспаления кожи и гранулемы, неспецифическим интерстициальным пневмонитом с респираторным бронхиолитом, артралгией, воспалением глаз, энтероколитом, целлюлитом и иммунодефицитом. У этих пациентов была подтверждена замена в гене PLCG2 (NM_002661.3) c.2120C>A, p.Ser707Tyr, и было обнаружено, что эта мутация, расположенная в домене SH2, создает новый сайт сигнального рецептора. В литературе имеется описание первого клинического случая APLAID с гангренозной пиодермией и сопутствующим высоким уровнем IgE с новой гетерозиготной мутацией I169V в гене PLCG2 [14]. Полученные автором данные о достоверной ассоциации SNPs гена PLCG2 с тяжелым течением акне, вероятно, свидетельствуют о нарушении регуляции врожденного иммунитета и возможном патогенетическом механизме системного воспаления при акне.
MPI (Mannose Phosphate Isomerase) – ген кодирует белок, который катализирует обмен маннозы. В экспериментальных исследованиях было установлено, что манноза может ингибировать продукцию провоспалительных медиаторов за счет увеличения экспрессии PPARγ и рецептора маннозы и снижения TGF-β1, стимулируемого липополисахаридами. Кроме того, манноза модулирует макрофаги [15]. Полученные автором данные о достоверной ассоциации SNPs гена MPI с тяжелым течением акне, по-видимому, могут являться патогенетическим механизмом дисбаланса функции иммуноглобулинов, что обуславливает хронизацию воспалительного процесса при акне тяжелой степени.
RNF31 (ring finger protein 31) – ген, кодирующий белок, который участвует в активации NF-kappa-B и регуляции воспаления, включая пути передачи сигналов TNF. Кроме того, имеются сведения о регуляции геном RNF31 метаболизма холестерина и синтеза стероидных гормонов [8]. Полученные автором данные о достоверной ассоциации SNPs гена RNF31 с тяжелым течением акне, вероятно, свидетельствуют о механизме генетической дисрегуляции воспалительного процесса в патогенезе акне.
Данные ген-генных взаимодействий представлены на рисунке.
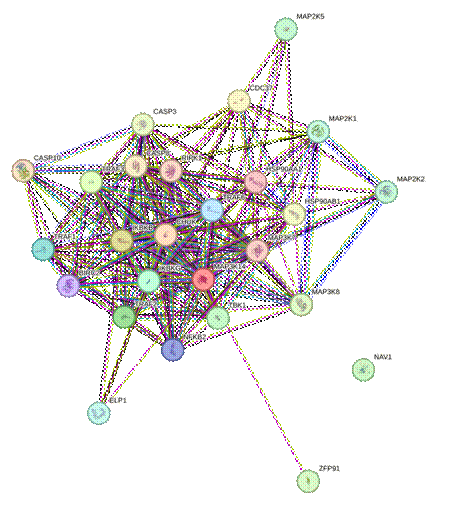
Ген-генные взаимодействия генов иммунной регуляции (источник: https://www.genecards.org/cgi-bin/carddisp.pl?gene) [9]
Заключение
Таким образом, проведенные автором исследования позволили впервые выявить у больных акне тяжелого течения полиморфные локусы генов иммунной регуляции: генов клеток системы врожденного и адаптивного иммунитета (TTC7A, SH3BP2, RASGRP1), факторов роста и их путей (MAP3K14, PLCG2), иммуноглобулинов (MPI) и гены, регулирующие воспаление (RNF31), которые достоверно повышают риск развития заболевания в 2,21–12,32 раза, что можно использовать в качестве прогностических маркеров развития акне тяжелого течения.
Исследование не имело спонсорской поддержки. Автор заявляет об отсутствии конфликта интересов.



