Введение. Ежегодно в Российской Федерации, в странах Европы и США количество открытых нейрохирургических операций на головном и спинном мозге увеличивается. В связи с этим сохраняется актуальность разработки новых пластических материалов, используемых для закрытия дефектов твердой мозговой оболочки (ТМО).
Сегодня в нейрохирургической практике имеются определенные материалы, разрешенные к применению в клинике, для закрытия дефектов ТМО: коллагеновые имплантаты DuraGen, DuraGen Plus, DuraGen Suturable, Lyoplant® – имплантат из чистого лиофилизированного коллагена перикарда крупного рогатого скота. В настоящее время коллагеновые имплантаты являются золотым стандартом в нейрохирургии для восстановления ТМО. Но эти материалы могут передавать прионы, при их использовании существует риск нежелательного иммунного ответа. Синтетические имплантаты имеют свои недостатки в виде высокого риска инфекционных осложнений. В связи с этим отдаленные результаты применения имплантатов не всегда полностью удовлетворяют как самого пациента, так и оперирующего хирурга. Следовательно, существует потребность в поиске и разработке материалов (аналогов ТМО), которые будут свободны от недостатков имеющихся имплантатов и иметь улучшенные свойства.
Перспективным направлением для решения данных задач является использование имплантатов из бактериальной наноцеллюлозы (БНЦ). Именно этот материал отвечает указанным выше требованиям. БНЦ, синтезируемая бактерией Acetobacter xylinum, состоит из биогенной структуры нановолокон, образованной путем самосборки. Она имеет более высокую способность удерживать воду, превосходную биосовместимость, высокую степень кристалличности и, следовательно, высокую прочность на разрыв, мелкоячеистую сеть по сравнению с чистыми природными биоразлагаемыми полимерами, такими как коллаген, хитин и желатин [1].
Во время оперативного лечения, после пластики ТМО имплантатами, возникает их непосредственный контакт с ликвором. Спинномозговая жидкость образуется в желудочковой системе мозга путем пропотевания плазмы крови через стенки сосудистых сплетений. За сутки в норме образуется от 400 до 500 мл ликвора. В нормальном люмбальном ликворе белка содержится 0,22–0,33 г/л. Альбумин является основным белком ликвора, его содержание в нормальной спинномозговой жидкости среди всех фракций белков составляет 62,7±10,5% [2].
Изучение взаимодействия ликвора, содержащего белки, и имплантатов из БНЦ очень важно, так как после замещения дефекта ТМО при избыточном осаждении альбумина на БНЦ и ее композитные материалы, при низкой его элюции из трансплантатов могут формироваться нежелательные наноцеллюлозо-альбуминные комплексы. Следует отметить, что на сегодняшний день в современной литературе имеются довольно скудные сведения, оценивающие динамику элюции альбумина из БНЦ.
Важной научно-практической задачей является изучение проникновения и вымывания белков ликвора из ткани БНЦ, используемой для пластики дефектов ТМО.
Цель исследования: изучение in vitro динамики миграции альбумина из БНЦ и ее композитов.
Материалы и методы исследования
Синтез нановолокон БНЦ производили с использованием бактерии Komagataeibacter Xylinus JCM 7644 в среде Хестрина–Шрамма в статических условиях в течение 10 суток в лаборатории НИИТО в стерильных условиях [3]. Далее нативную бактериальную целлюлозу передавали в Новосибирский институт органической химии им. Ворожцова СО РАН для обработки БНЦ наночастицами новохизоль™ (Наносферы хитозана — новохизоль™, зарегистрированный международный товарный знак Novochizol, был предоставлен NOVOCHIZOL SA (Monthey, Швейцария, www.novochizol.ch.)). Обработку проводили несколькими способами с добавлением 1% хитозана и 1%-ного раствора новохизоль™.
Таким способом было получено 5 видов материалов, которые использованы в качестве объекта исследования: 1) БНЦ (С), 2) композитный материал БНЦ – 1% новохизольТМ-ванкомицин (ZV), 3) композитный материал БНЦ – 1% хитозан-ванкомицин (NV), 4) композитный материал БНЦ – 1% новохизольТМ (Z), 5) композитный материал БНЦ – 1% хитозан (N).
Образцы нарезали с помощью пробойника на равные круги диаметром 5 мм. Для измерения пассивной диффузии белков из имплантатов БНЦ и ее композитов использовали в качестве модельного белка в готовом виде 20%-ный человеческий альбумин (Микроген). Исследования проводили в 10 повторениях.
Для проведения эксперимента все образцы предварительно инкубировали в 20%-ном растворе альбумина человека в количестве 0,5 мл в течение 24 часов до полного насыщения имплантатов альбумином. Раствор 0,5 мл 20%-ного альбумина содержит 100 мг альбумина. По окончании пропитывания исследуемые образцы однократно обмывали с помощью стерильного физиологического раствора путем погружения лоскута в избыточный объем физиологического раствора на 1 секунду и прикосновения обеими сторонами обмытого лоскута к фильтровальной бумаге (удаление избыточной жидкости).
Концентрацию высвободившегося человеческого сывороточного альбумина (ЧСА) из образцов определяли по следующей методике: каждый из исследуемых образцов, средний объем которых составлял 136 мкл, последовательно помещали в лунки микропланшета, содержащие 350 мкл стерильного физиологического раствора, сроком на 1 час. По истечении 1 часа образцы извлекали и перемещали в следующие лунки, содержащие 350 мкл свежего физиологического раствора. Такие манипуляции проводили на протяжении 6 часов. Во всей серии эксперимента проведены исследования с 50 образцами 5 имеющихся материалов (по 10 образцов для каждого). Продолжительность эксперимента была установлена опытным путем и обусловлена полным высвобождением альбумина из толщи БНЦ за данный промежуток времени.
Определение концентрации альбумина в элюате проводили с использованием теста с бромкрезоловым зеленым с помощью набора реагентов для определения концентрации альбумина в сыворотке и плазме крови – Альбумин-Ново (200) (АО Вектор Бест) фотометрическим методом путем измерения оптической плотности подготовленных проб. С помощью фотометра микропланшетного Sunrise Tecan с использованием программы idasoftWin при длине волны 620 нм проводили подсчет количества альбумина в опытных пробах и рассчитывали средние значения концентраций каждой группы. Проводили расчет содержания альбумина каждой лунки по формуле C = (E/Eк)*Cк, где Е – оптическая плотность раствора опытной пробы, Ек – оптическая плотность раствора калибровочной пробы, Ск – концентрация альбумина в калибраторе, мг/мл.
Нормальность значений концентрации альбумина в пробах оценивали критерием Шапиро–Уилка, однородность дисперсий между прошедшими часами исследовали F-критерием Фишера. Ввиду ненормальности всех распределений и разнородности дисперсий сравнение концентраций проводили непараметрическими критериями: U-критерием Манна–Уитни исследовали различия концентраций альбумина между группами для каждого прошедшего часа, критерием Вилкоксона анализировали различия концентраций альбумина между каждым прошедшим часом в отдельной группе.
Достигнутые уровни значимости p приведены с поправкой на множественные сравнения методом Бенджамини–Хохберга. Различия считались статистически значимыми при достигнутом уровне значимости p<0,05.
Расчеты и рисунки сделаны в IDE RStudio (версия 1.4.1106 © 2009-2021 RStudio, PBC), на языке R (версия 4.0.5).
Результаты исследования и их обсуждение
Результаты выделения альбумина во всех графиках оценивали по медиане. Количество выделившегося альбумина оценивали на 1-м, 2-м, 3-м и 4-м часах. На 5-м и 6-м часе выделение альбумина из исследуемых материалов отсутствовало (рис. 1).
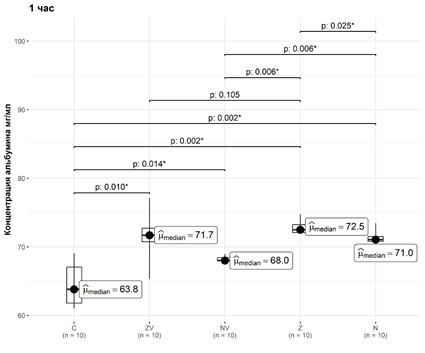 ,
,
Рис. 1. Динамика элюции альбумина из материалов за первый час
В первый час концентрация альбумина в группе С статистически значимо отличалась от концентрации альбумина в группах ZV, NV, Z и N: медианы и интерквартильные значения составили соответственно 63,8 [61,8; 67,03] мг/мл, 71,7 [70,75; 72,72] мг/мл, 68 [68; 68,42] мг/мл, 72,5 [72,1; 73,22] мг/мл и 71,05 [70,8; 71,5] мг/мл. Уровни значимости p достигли 0,020, 0,024, 0,010 и 0,010 соответственно.
В первый час концентрация альбумина в группе Z статистически значимо отличалась от концентрации альбумина в группах С, NV, и N: уровни значимости p достигли 0,010, 0,015, и 0,034 соответственно, статистически значимых отличий от группы ZV не обнаружено (p=0,117) (рис. 2).
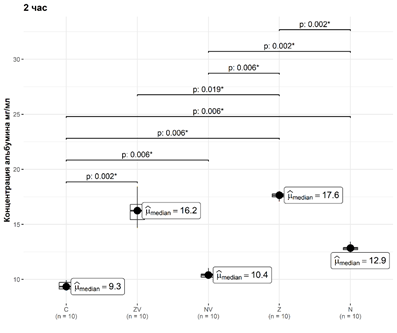
Рис. 2. Динамика элюции альбумина из материалов за второй час
Во второй час концентрация альбумина в группе С статистически значимо отличалась от концентрации альбумина в группах ZV, NV, Z и N: медианы и интерквартильные значения составили 9,35 [9,12; 9,73] мг/мл, 16,25 [15,43; 16,8] мг/мл, 10,4 [10,2; 10,5] мг/мл, 17,65 [17,5; 17,78] мг/мл и 12,85 [12,7; 12,9] мг/мл. Уровни значимости p достигли 0,005, 0,007, 0,007 и 0,007 соответственно.
Во второй час концентрация альбумина в группе Z статистически значимо отличалась от концентрации альбумина в группах С, ZV, NV и N, при этом уровни значимости p достигли 0,007, 0,019, 0,007 и 0,005 соответственно (рис. 3).
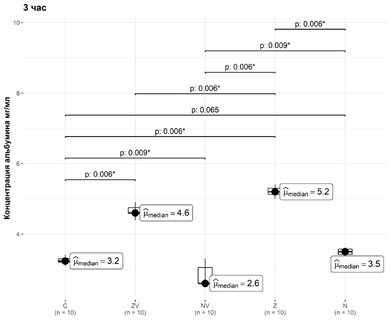
Рис. 3. Динамика элюции альбумина из материалов за третий час
В третий час медианные и интерквартильные значения концентрации альбумина в группах С, ZV, NV, Z и N составили 3,235 [3,2; 3,3] мг/мл, 4,6 [4,6; 4,75] мг/мл, 2,6 [2,6; 3,05] мг/мл, 5,2 [5,12; 5,3] мг/мл и 3,5 [3,42; 3,58] мг/мл соответственно.
При этом концентрация альбумина в группе С статистически значимо отличалась от концентрации альбумина в группах ZV, NV, Z; уровни значимости p достигли 0,008, 0,010 и 0.008 соответственно. Статистически значимых отличий от группы N не обнаружено (p=0,065). В третий час концентрация альбумина в группе Z статистически значимо отличалась от концентрации альбумина в группах С, ZV, NV и N: все уровни значимости p достигли значения 0,008 (рис. 4).
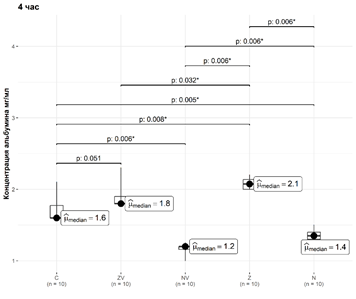
Рис. 4. Динамика элюции альбумина из материалов за четвертый час
В четвертый час медианы и интерквартильные значения концентрации альбумина в группах С, ZV, NV, Z и N составили 1,6 [1,6; 1,78] мг/мл, 1,8 [1,8; 1,9] мг/мл, 1,2 [1,16; 1,2] мг/мл, 2,075 [2; 2,14] мг/мл и 1,35 [1,3; 1,4] мг/мл соответственно.
В четвертый час концентрация альбумина в группе С статистически значимо отличалась от концентрации альбумина в группах NV, Z и N. Уровни значимости p достигли 0,008, 0,010 и 0,008 соответственно, статистически значимых отличий от группы ZV не обнаружено (p=0,051). В четвертый час концентрация альбумина в группе Z статистически значимо отличалась от концентрации альбумина в группах С, ZV, NV и N: уровни значимости p достигли 0,010, 0,035, 0,008 и 0,008 соответственно.
Полученные результаты эксперимента, отображенные на графиках 1–4, сведены в таблицу 1.
Таблица 1
Сводная таблица концентраций альбумина, высвободившегося из БНЦ и композитов, мг/мл
|
Группа |
1.С, мг/мл |
2. ZV, мг/мл |
3. NV, мг/мл |
4. Z, мг/мл |
5. N, мг/мл |
|
|
МЕД [Q1;Q3] |
||||
|
1-й час |
63,8 [61,8;67,03] |
71,7 [70,75;72,72] |
68 [68; 68,42] |
72,5 [72,1; 73,22] |
71,05 [70,8; 71,5] |
|
2-й час |
9,35 [9,12; 9,73] |
16,25 [15,43; 16,8] |
10,4 [10,2;10,5] |
17,65 [17,5; 17,78] |
12,85 [12,7; 12,9] |
|
3-й час |
3,235 [3,2; 3,3] |
4,6 [4,6; 4,75] |
2,6 [2,6; 3,05] |
5,2 [5,12; 5,3] |
3,5 [3,42; 3,58] |
|
4-й час |
1,6 [1,6; 1,78] |
1,8 [1,8; 1,9] |
1,2 [1,16; 1,2] |
2,075 [2; 2,14] |
1,35 [1,3; 1,4] |
|
Всего выделилось за 4 часа |
77,985 78,74 |
94,35 94,03 |
82,2 82,63 |
97,425 97,73 |
88,75 88,99 |
|
Остаток альбумина в имплантанте после 4 часов инкубации |
22,015 21,26 |
5,65 5,7 |
17,8 17,37 |
2,575 2,27 |
11,25 11,05 |
Имплантаты из БНЦ хорошо выполняют функцию гематоэнцефалического барьера. Наноматериалы могут иметь очень большое отношение площади поверхности к осаждаемому материалу, что позволяет адсорбировать биомолекулы в большом количестве [1].
Для гомеостаза центральной нервной системы и стабильного гематоэнцефалического барьера (ГЭБ) требуется перенос молекул с периферии к мозгу, эту функцию выполняет альбумин. Без ГЭБ невозможно нормальное функционирование центральной нервной системы (ЦНС). Общий белок в ликворе – один из самых чувствительных индикаторов патологии ЦНС. Альбумины легко проходят через ГЭБ, а поступление крупных белковых молекул существенно затруднено [4].
Белки, присутствующие в спинномозговой жидкости, в основном происходят из плазмы крови, попадают в желудочковую систему путем переноса и распределения большого количества переносимых кровью молекул (жирных кислот, аминокислот, гормонов, ионов металлов, лекарственных препаратов, глюкозы) [5]. Альбумин является основным транспортным белком крови и ликвора. Молекула сывороточного альбумина человека образована одной полипептидной цепью, состоящей из 585 аминокислотных остатков [6].
Альбумин связывает практически все биоактивные вещества, лекарственные препараты и токсические вещества [7]. Он определяет фармако- и токсикокинетику многих лекарственных препаратов и медизделий, в том числе и ТМО, транспортируя лекарства и токсины к тканям-мишеням или местам их биотрансформации. Поэтому альбумин используется при разработке и токсической оценке лекарств и медицинских изделий. Альбумин естественным образом накапливается в опухолях и очагах воспаления, что может быть усилено добавлением лигандов [8]. В молекуле альбумина происходят конформационные изменения после связывания ряда эндогенных соединений [9].
Все полимеры, в том числе и биополимеры, которые вступают в контакт с цельной кровью, плазмой или ликвором, покрываются альбумином и фибриногеном, а количество осажденного белка зависит от состава пленки, на которую осаждается альбумин [10]. При этом в застойных условиях развивается эффект Вромана – замещение мелких белков крупными. Отложение белка происходит в следующей последовательности: альбумин; глобулин; фибриноген; фибронектин; фактор XII и высокомолекулярный кининоген [11].
Такой же механизм возникает при пропитывании альбумином нативной БНЦ и композитов БНЦ с микрочастицами хитозана и наночастицами новохизоль™. В экспериментальных условиях при пропитывании альбумином наблюдалось сильное помутнение образцов БНЦ и менее интенсивное – композитов БНЦ. При этом их прозрачность полностью исчезает, что наблюдалось нами при пропитывании альбумина в эксперименте. Данный факт говорит о том, что происходят осаждение и связывание альбумина.
Ванкомицин является антибиотиком группы гликопептидов. Ванкомицин используется для лечения метициллин-резистентного золотистого стафилококка (MRSA) и при инфицировании другими грамположительными бета-лактамными бактериями. Ванкомицин и другие препараты с большой молекулярной массой и гидрофильностью имеют длительный период полувыведения из спинномозговой жидкости (СМЖ), что обеспечивает достижение терапевтической концентрации при однократном интратекальном введении в течение суток.
Загрузка антибиотиков в биополимерные наночастицы – способ альтернативного метода терапии в связи с большим доступом и накоплением антибиотика в месте инфекции, снижения токсичности и активности ванкомицина. Технологией для обхода низкой скорости транспортировки ванкомицина через ГЭБ является производство наночастиц, нагруженных ванкомицином, которые могут повысить эффективность антибиотика против резистентных штаммов и увеличить концентрацию ванкомицина в очаге инфекции за счет облегчения транспортировки через ГЭБ. Такими частицами меньше 100 нм является глобулярный новохизольТМ, полученный из хитозана. Данную эту тему хорошо раскрыли в статье T. Cerchiara и соавторы [12].
Существует гипотеза, что положительный заряд и размер меньше 100 нм [13] способствуют повышению антибактериальной активности ванкомицина против резистентных штаммов. Поэтому мы и создали 2 композита БНЦ с ванкомицином: ZV и NV.
Хитозан и производные хитозана, нейтрализуя отрицательные заряды на микробной поверхности, могут губительно действовать на бактерии. Положительные заряды аминогрупп хитозана электростатически взаимодействуют с отрицательно заряженными компонентами на микробной мембране, создавая антимикробные свойства.
Авторы согласны с A.M. Sokolniki, что снижение коэффициента диффузии ЧСА может быть связано, в первую очередь, с гидродинамической и энтропийной элиминацией, так как альбумин обладает большой молекулярной массой и гидродинамическим радиусом. По данным A.M. Sokolniki и соавторов, средний диаметр нановолокна – 30 нм, а пористость БНЦ составляла 94,1%. Пористость была определена с помощью сканирующей электронной микроскопии [14]. Диффузия альбумина в БНЦ происходит через поры БНЦ. Но в композитных материалах она затруднена, так как поры забиваются наночастицами и микрочастицами, поэтому элюция возможна только с поверхности материала, т.е. наночастиц Z и микрочастиц N. Учитывая наноразмеры при пропитывании, Z быстрее забивает и глубже проникает в БНЦ.
По данным L. Lin и соавторов, при включении хитозана в бактериальную наноцеллюлозу объем пор мембраны БНЦ уменьшен на 42,2%, а модуль Юнга увеличен в 22,2 раза, прочность на разрыв в мембране увеличилась до 88,9% [15]. Улучшение прочностных свойств при включении наночастиц также соответствует данным в ранее проведенных экспериментальных исследованиях [3].
Из проведенных экспериментальных исследований можно сделать вывод, что в течение первых 4 часов происходит высвобождение осажденного альбумина из 5 представленных материалов в различных дозировках, что можно увидеть на рисунках 1–4, а также в таблице 1. После 4 часов элюция альбумина из исследуемых материалов отсутствовала.
Наибольшее количество осажденного альбумина спустя 4 часа с момента проведения эксперимента остается в БНЦ – 22,015 мг/мл, что обусловлено задержкой альбумина в толще ее пор. Напротив, наименьшее его количество отмечено в композите бактериальная наноцеллюлоза – новохизольТМ (Z), по сравнению с другими используемыми материалами, – 2,575 мг/мл.
В композитах N, ZV и NV альбумина в конце эксперимента оставалось соответственно 11,25 мг/мл, 5,65 мг/мл и 17,8 мг/мл белка, что обусловлено закрытием пор наночастицами Z и микрочастицами N с ванкомицином, из-за чего происходит более медленное высвобождение альбумина из этих композитов.
Заключение
Показано, что элюция альбумина из имплантов происходила в течение 4 часов. С учетом высокой пористости материала и нанометровых волокон БНЦ, размеров наночастиц новохизольТМ и микрочастиц хитозана из 5 материалов наиболее антиадгезионным по отношению к ЧСА является композитный материал Z (БНЦ-новохизольТМ). Данный вид материала, используемый в работе авторов, обладает выраженным антиадгезивным свойством, что препятствует отложению белковых БНЦ-альбуминовых комплексов и утолщению материала после имплантации.
Финансирование: исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Благодарность. Выражаем особую благодарность сотрудникам Института экспериментальной ветеринарии Сибири и Дальнего Востока (ИЭВС и ДВ) за сотрудничество и выполнение экспериментальных исследований.
Список сокращений:
С – бактериальная наноцеллюлоза
Z+V – композит бактериальная наноцеллюлоза – новохизольTM+ванкомицин
N+V – композит бактериальная наноцеллюлоза – хитозан +ванкомицин
БНЦ – бактериальная наноцеллюлоза
Z – композит бактериальная наноцеллюлоза – новохизоль TM
N – композит бактериальная наноцеллюлоза – хитозан
ЧСА – человеческий сывороточный альбумин
ГЭБ – гематоэнцефалический барьер
ЦНС – центральная нервная система
МЕД – медиана – среднее значение ненормально распределенных показателей
СРЕД – среднее значение
СО – стандартное отклонение – характеристика разброса значений у нормально распределенных величин.
(МИН - МАКС) – (минимальное значения – максимальное значение)
ИКИ – интерквантильный интервал – интервал, в котором расположено 50% значений показателей. Характеризует разброс значений.
95% ДИ – 95%-ный доверительный интервал – интервал, в котором с 95% вероятности находится оцениваемое значение. Характеризует возможную ошибку, с которой найдено оцениваемое значение
СМЖ – спинномозговая жидкость
мкл – микролитры
нм – нанометры
мл – миллилитр
г/л – грамм на литр



