Введение
Инфекции нижних дыхательных путей (ИНДП) остаются распространенной причиной заболеваемости и смертности, особенно в детской возрастной группе, ежегодно становясь причиной около 1,9 миллиона детских смертей. Доля микоплазменной пневмонии (МП) в этой печальной статистике за последние годы значительно увеличилась и составляет 10–40% от всех выявленных случаев детской внебольничной пневмонии (ВП) в мире [1], в ряде источников уровень инфицированности детей старше 5 лет описывается как 50% от всех выявленных случаев [2, 3]. Таким образом, уровень распространения МП в детской популяции достаточно высок.
Имеются данные, свидетельствующие, что ВП микоплазменной этиологии обычно характеризуется легким течением и не требует госпитализации. Напротив, в раннем детском возрасте отмечается большая тяжесть заболевания с развитием выраженной интоксикации, дыхательной недостаточности, появлением внелегочных симптомов [4].
В ряде исследований отмечен эпидемический характер распространения микоплазмозов, в том числе ВП, вызванной Mycoplasmoides (M.) pneumoniae, ранее относимой к роду Mycoplasma [2, 4, 5]. Имеются указания на межвспышковые интервалы от 3 до 7 лет, пик заболеваемости в осенне-зимний период. Заболеваемость пневмонией микоплазменной этиологии обычно составляет 4–8% от общего числа ВП, во время эпидемических подъемов может увеличиваться до 20–40% [1, 5].
В октябре и ноябре 2023 г. больницы в крупных городах на севере Китая сообщили о всплеске числа случаев детской пневмонии, что привело к переполнению детских отделений неотложной помощи [6, 7]. Аналогичные вспышки наблюдались в США и Европе в конце 2022 г. [8]. Этот рост мог быть связан со снятием ограничений, вызванных пандемией новой коронавирусной инфекции.
Цель исследования: выявить особенности распространенности M. pneumoniae как этиологического фактора в когорте детей и подростков, перенесших инфекцию нижних дыхательных путей.
Материалы и методы исследования
Для ретроспективного анализа выявляемости M. pneumoniae в когорте детей, перенесших ИНДП, использовали статистические данные по заболеваемости ВП c декабря 2023 г. по июль 2024 г., предоставленные государственным бюджетным учреждением здравоохранения Республики Мордовия «Детская поликлиника № 4». Выявление заболевших МП проводилось с помощью инструментальных методов диагностики (компьютерной томографии (КТ) и рентгенографии органов грудной клетки) и лабораторных исследований – общеклинического и биохимического анализов крови с оценкой С-реактивного белка (СРБ), полимеразной цепной реакции (ПЦР).
Из 45 пациентов в возрасте от 0 до 18 лет с острой ИНДП 26 были мальчики, 19 – девочки. У 10 (22,2%) детей и подростков диагностировалась МП.
Анализ заболеваемости МП проводили с помощью аналитического и статистического методов (результаты обрабатывали в программе Microsoft Excel). Интересующими аспектами служили показатели сезонности заболеваемости, возрастные и гендерные особенности развития пневмоний, изменения лабораторных параметров, вызванные инфекционными агентами. Результаты представили в виде медианы (Ме), 5-го и 95-го перцентиля (‰). Различия показателей считали статистически значимыми при уровне значимости (р) ˂0,05.
Результаты исследования и их обсуждение
Все пациенты предъявляли сходные жалобы на повышение температуры до 37,8°С, кашель, в большинстве случаев продуктивный, продолжительностью до девяти дней и более. Указания на внелегочные проявления отсутствовали.
Наибольшее количество пневмоний регистрировалось в декабре 2023 г. – феврале 2024 г. При этом максимальное число случаев МП отмечено в декабре 2023 г. – 3 случая (30%). Расчет соотношения количества пневмоний микоплазменной и иной этиологии у детей и подростков (рис. 1) выявил значимый вклад микоплазм в поражение дыхательных путей.
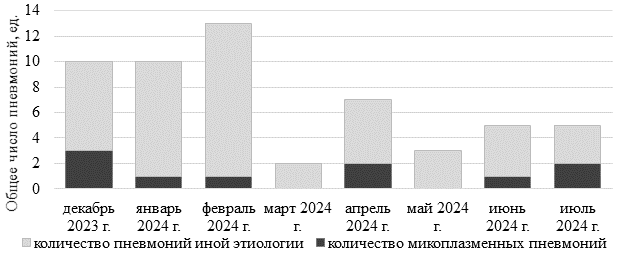
Рис. 1. Соотношение количества пневмоний микоплазменной и иной этиологии у детей и подростков в зависимости от месяца года
Интересен факт регистрации 2 случаев (40%) МП в июле 2024 г. на фоне высокой температуры и пониженной влажности атмосферного воздуха, что может свидетельствовать о хороших адаптационных способностях микоплазм.
Процент положительных результатов ПЦР на M. pneumoniae преобладал у мальчиков и составил 26,9%, что в 1,7 раза (р˂0,05) превышало результат среди девочек – 15,8% (рис. 2).
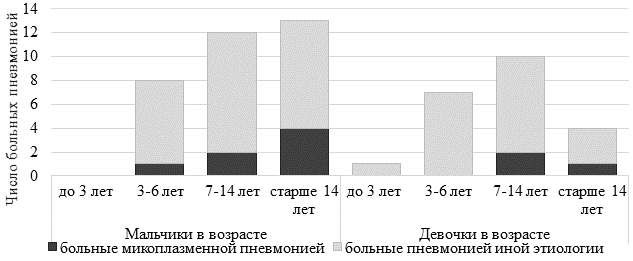
Рис. 2. Гендерно-возрастная характеристика больных пневмонией детей и подростков
Распределение детей и подростков, больных МП, по возрасту выявило, что наибольшее количество заболевших приходилось на возраст 7 лет и старше. Среди мальчиков максимум заболеваемости отмечался в возрастной группе старше 14 лет (4 случая), среди девочек – в когорте 7–14 лет (2 случая). Соотношение больных МП по полу в возрасте 7–14 лет было равным – 1:1, тогда как среди пациентов старше 14 лет наблюдалось четырехкратное превалирование мальчиков (р˂0,001).
Отмеченная тенденция может быть обусловлена иммуно-гормональными ассоциациями, способствующими эвазии патогенов, в частности микоплазм, от иммунного ответа. В ранее опубликованном обзоре представлены стратегии уклонения микоплазм от иммунного ответа, которые включают: 1) молекулярную мимикрию и изменчивость антигенного профиля бактерий; 2) преодоление атак иммунных эффекторных молекул за счет индукции ферментов для нейтрализации активных форм кислорода, экспрессии нуклеаз для деградации нейтрофильных внеклеточных ловушек, расщепления иммуноглобулинов для избегания гуморального иммунного ответа; 3) внедрение в клетку хозяина для предотвращения иммунного повреждения, формирование биопленок для персистенции; 4) модуляцию иммунного реагирования для снижения интенсивности иммунного ответа [9].
Диагноз ВП у пациентов был подтвержден данными инструментальных исследований – применялись КТ и рентгенографическое исследование органов грудной клетки, по результатам которых были установлены варианты поражения ткани легких (рис. 3).
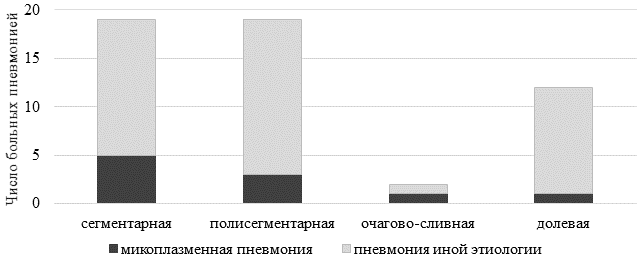
Рис. 3. Варианты поражения легочной ткани (по данным инструментальных исследований)
Согласно полученным результатам, у больных МП детей и подростков чаще регистрировались сегментарное поражение легких – в 5 случаях (50%) и полисегментарное поражение легочной ткани – в 3 случаях (30%), по 10% пришлось на очагово-сливную и долевую пневмонию. Однако в доступной литературе имеются указания на частое протекание МП в виде очаговой пневмонии, большую распространенность односторонних плевральных выпотов у детей [5]. Кроме того, ранее у пациентов с респираторным микоплазмозом с длительным кашлем на КТ органов грудной клетки обнаруживались утолщения стенки бронхов, увеличение внутригрудных лимфатических узлов [5, 10].
Из-за сложности обнаружения и идентификации инфекционного агента, в частности M. рneumoniae, в ряде случаев установление этиологического диагноза становится затруднительным. ПЦР представляется наиболее практичным методом для экспресс-диагностики M. pneumoniae в мазках из ротоглотки, особенно у детей младшего возраста. Чувствительность и специфичность ПЦР составляют примерно 70 и 80–100% соответственно [5].
Для определения роли M. pneumoniae в острых ИНДП в исследуемой когорте детей использовали ПЦР (рис. 4).
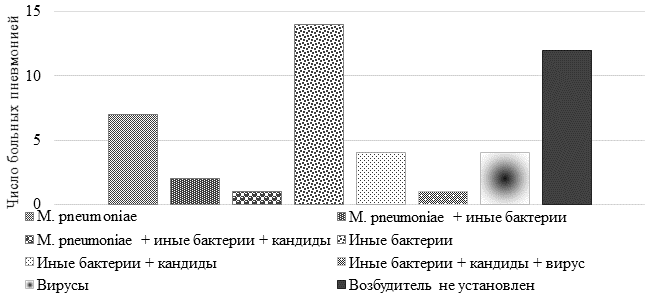
Рис. 4. Распределение внебольничных пневмоний по этиологии возбудителя
По результатам молекулярно-генетического исследования наибольшее количество ВП имело бактериальную этиологию – 23 случая (51,1%), в 12 случаях (26,7%) идентифицировать возбудителя не удалось. Среди бактерий чаще определялись Streptococcus (S.) viridans (15 случаев ВП), M. pneumoniae (10 случаев), Staphylococcus (St.) aureus (7 случаев), реже – Neisseria (N.) flava / N. mucosa – в 4 случаях; диморфные грибы Candida (C.) albicans были обнаружены в 6 случаях (13,3%). МП в 7 случаях (70%) протекала в виде моноинфекции, в 2 случаях (20%) регистрировалась диинфекция (M. pneumoniae + Klebsiella pneumoniae; M. pneumoniae + S. viridans), у 1 больного отмечалась квадриинфекция (M. pneumoniae + S. viridans + St. aureus + C. albicans).
Также интерес представляло сравнение параметров общеклинического и биохимического анализов крови у обследованных пациентов. При легкой степени тяжести ВП значимых лабораторных изменений не выявлялось, в отличие от пациентов со средней степенью тяжести и осложненным фиброателектазом течением заболевания, у которых наблюдались лейкоцитоз и ускорение скорости оседания эритроцитов (СОЭ). Различия гематологических параметров в зависимости от этиологии возбудителя ВП отражены в таблице.
Гематологические изменения у больных внебольничными пневмониями в зависимости от этиологии возбудителя, Ме [5; 95 ‰]
|
Показатель |
Лейкоц., ×109/л |
Нейтр., % |
Лимф., % |
Тромб., ×109/л |
СОЭ, мм/ч |
СРБ, мг/л |
|
|
Внебольничные пневмонии, вызванные |
М. pneumoniae |
9,1 [8,1; 10,1] |
56 [50; 69] |
46 [39; 51] |
263 [190; 340] |
10,5 [8; 13] |
3,4 [2; 4,1] |
|
М. pneumoniae и иными бактериями |
11 [10,5; 11,5] |
62 [61; 63] |
35,5 [27; 44] |
246 [220; 272] |
18,5 [12; 25] |
5,5 [2,1; 8,8] |
|
|
М. pneumoniae и иными бактериями, кандидами |
9,8 |
77 |
12 |
188 |
25 |
35 |
|
|
иными бактериями |
12 [5; 34] |
61 [32; 89] |
27 [4; 60] |
296 [156; 628] |
20 [7; 50] |
51 [1,3; 281] |
|
|
иными бактериями и кандидами |
6,1 [5; 7,3] |
56 [46; 65] |
34,5 [25; 42] |
227 [155; 300] |
11 [3; 22] |
6 [2,7; 10,7] |
|
|
иными бактериями, кандидами и вирусами |
6,25 |
24 |
58 |
385 |
34 |
41,3 |
|
|
вирусами |
9,4 [8,1; 10,4] |
36 [32; 43] |
67,5 [61; 73] |
322 [260; 360] |
15 [13; 17] |
3,5 [3; 4,1] |
|
|
не установленным инфектом |
8,2 [5,3; 10,1] |
57 [37; 77] |
34,5 [15; 53] |
289 [186; 384] |
17 [4; 35] |
16,9 [3; 27,5] |
|
Примечания: Лейкоц. – лейкоциты, Нейтр. – нейтрофилы, Лимф. – лимфоциты, Тромб. – тромбоциты
Полученные результаты демонстрируют наибольшее увеличение количества лейкоцитов за счет фракции нейтрофильных гранулоцитов, СОЭ, СРБ у больных ВП, вызванной иными бактериями (S. viridans, St. aureus, St. epidermidis, N. flava, Escherichia coli), что отражает адекватную реакцию клеточных и гуморальных механизмов врожденного иммунитета на бактериальную инфекцию. Напротив, у пациентов с ВП вирусной этиологии среди лабораторных параметров превалировало увеличение лимфоцитов при относительной нейтропении, что свидетельствовало об активации клеточного адаптивного иммунитета. В целом, наблюдаемые гематологические изменения указывают на отсутствие в исследуемой когорте детей и подростков признаков первичного иммунодефицитного состояния.
Анализ лабораторных данных пациентов, инфицированных М. pneumonia, выявил стремление большинства параметров к верхней границе дискриминационного уровня. При дополнительной контаминации иными бактериями развивалась тенденция к увеличению количества лейкоцитов (+20,9%, р≤0,05), нейтрофилов (+10,7%, р>0,05), снижалась численность лимфоцитов (–22,8%, р˂0,05), повышались СОЭ (+76,2%, р˂0,001) и уровень СРБ (+61,8%, р˂0,01). Данные изменения усугублялись при коинфицировании дрожжеподобными грибами рода Candida. По сравнению с моноинфекцией М. pneumonia у больных ВП, вызванной М. pneumoniae и иными бактериями, кандидами, повышались относительное количество нейтрофилов (+37,5%, р˂0,05), СОЭ (+138,1%, р˂0,001), СРБ (+929,4%, р˂0,001), уменьшалась численность лимфоцитов (–73,9%, р˂0,01) и тромбоцитов (–28,5%, р˂0,05).
Определенные у пациентов вариации значений лабораторных параметров поднимают вопрос об одномоментности коинфицирования бактериями и кандидами. Наблюдаемый прогрессирующий дисбаланс гематологических изменений в ряду: моноинфекция М. pneumoniae – диинфекция – квадриинфекция – можно оценить как косвенное указание на вторичный характер инфекции грибами рода Candida.
Определение коэффициента корреляции Пирсона (r) позволило оценить силу сопряженности изменений лабораторных параметров крови со степенью контаминации микоплазмами. Так, у больных МП были установлены положительные средней силы корреляционные связи инфицирования М. pneumoniae с количеством лейкоцитов (r=0,6834, р˂0,01), нейтрофилов (r=0,5522, р˂0,01), СРБ (r=0,5737, р˂0,01), сильная связь с СОЭ (r=0,7737, р˂0,01), обратная сильная взаимосвязь с численностью лимфоцитов (r= –0,7448, р˂0,01), умеренная – с содержанием тромбоцитов (r= –0,3719, р˂0,01).
Персонализированный подход к выбору тактики этиотропной терапии ВП основывался на детекции возбудителя, что способствовало санации организма и полному выздоровлению.
Заключение
Проведенный ретроспективный анализ по выявляемости M. pneumoniae в когорте детей и подростков с острой ИНДП подтвердил развитие МП в 22,2% случаев. Основными жалобами являлись субфебрилитет и длительный продуктивный кашель. Большее количество пневмоний регистрировалось в зимние месяцы. Отмечены гендерно-возрастные особенности МП в виде превалирования мальчиков среди больных. При инструментальном обследовании чаще наблюдалось сегментарное (50%) и полисегментарное поражение легочной ткани (30%). При молекулярно-генетическом исследовании M. pneumoniae определялись в 70% случаев в виде моноинфекции, в 20% случаев регистрировалась диинфекция, у 1 больного – квадриинфекция. Изменения гематологических данных были сопряжены с этиологическим фактором.
Смешанное инфицирование может изменить исход заболевания, привести к осложнениям. Для обеспечения идентификации инфекционного агента желательно применение комбинации молекулярно-генетических и иммунологических методов. Установление природы возбудителя с назначением или коррекцией этиотропной терапии будет способствовать санации организма от патобионта и полному выздоровлению.



