Болезнь Блаунта является одной из сложных патологий опорно-двигательного аппарата у детей [1]. Заболевание представляет собой асимметричное нарушение развития и роста проксимального (эпиметафизарного) отдела большеберцовой кости, приводящее к трехмерной деформации нижней конечности [2, 3]. Лечение консервативными методами в большинстве случаев неэффективно. При прогрессировании патологического процесса и деформации единственным вариантом выступает оперативное вмешательство. Этиологические факторы болезни не определены [4]. В современной литературе представлено ограниченное количество работ по изучению данной патологии. Моделирование болезни Блаунта на животных открывает новые возможности в исследовании этиопатогенетических механизмов рассматриваемого заболевания. В эксперименте на двуногом животном (курах) получены первые результаты по моделированию варусной деформации коленных суставов [5, 6]. Модель создана путем ингибирования экспрессии парного боксового гена 3 (РАХ3) малой интерферирующей рибонуклеиновой кислотой (siРНК) и основана на гипотезе о роли клеток нервного гребня в индуцировании болезни Блаунта. Дифференцировка и миграция клеток нервного гребня регулируются PAX3 геном [7]. К матричной РНК (мРНК) гена РАХ3 через нервную трубку куриного эмбриона вводили siРНК в сроке 53 часов эмбрионального развития на 16-й стадии по классификации Гамбургера и Гамильтона. У цыплят с ингибированием в эмбриогенезе экспрессии РАХ3 гена в постнатальном периоде рентгенологически диагностирована варусная деформация коленных суставов.
Формирование зачатков нижних конечностей у куриного эмбриона происходит на уровне 26–32 пар сомитов [8, 9]. Образование данных пар сомитов представляет собой процесс, протекающий не одномоментно, а происходящий на протяжении нескольких стадий эмбрионального развития и занимающий несколько часов. На 15-й стадии (около 50–55 часов) сформировано 24–27 пар сомитов, на 16-й стадии (приблизительно 51–56 часов) визуализируется 26–28 пар, и 17-я стадия (около 52–64 часов) соответствует 29–32 парам сомитов по классификации Гамбургера–Гамильтона [8]. Поскольку сегментация сомитов происходит от передней к задней части эмбриона и каждая вновь образованная пара сомитов влияет на миграцию клеток нервного гребня в своем окружении [10], ключевым является вопрос выбора времени введения интерферирующей siРНК, направленной к мРНК гена РАХ3. Для индуцирования ортопедической патологии коленного сустава у экспериментального животного важно определить время ингибирования гена РАХ3: siРНК вводить в нервную трубку на этапе начала формирования сомитов, из которых развиваются нижние конечности, или на этапе сформированных нескольких пар сомитов, дающих начало почкам нижних конечностей? В ранее проведенном пилотном эксперименте было выбрано время, соответствующее середине 16-й стадии. В планируемом исследовании представляются необходимыми сравнение нескольких временных параметров и определение оптимального периода для ингибирования экспрессии РАХ3 гена с целью формирования выраженной патологии коленного сустава.
Цель исследования: определить оптимальные временные параметры ингибирования экспрессии парного боксового гена 3 для моделирования болезни Блаунта в эксперименте.
Материал и методы исследования. Проведение экспериментального исследования одобрено Локальным этическим комитетом ФГБУ «ННИИТО им. Я.Л. Цивьяна» Минздрава России (выписка 023/21 из протокола № 009/21 от 06.12.2021 г.).
Эксперимент по моделированию болезни Блаунта у двуногого животного выполняли на яйцах кур породы Росс-308 (ROSS-308 – мясная порода бройлеров). Инкубацию яиц и манипуляции по введению siРНК к мРНК гена PAX3 в нервную трубку куриного эмбриона, закрытию отверстия эмпирического яйца проводили, как описано ранее [6]. Для ингибирования экспрессии гена РАХ3 использовали siРНК, подобранную для проведенного ранее пилотного исследования [6]. В пилотном исследовании было показано, что действие такой siРНК специфично: контрольная siРНК (siScr), не имеющая гомологии с геном PAX3, не оказывала влияния на его экспрессию. Для доставки siРНК в клетки-мишени на основе последовательности siРНК конструировали холестеринсодержащие конъюгаты с конечной концентрацией 50 мМ, хранящиеся при –20°C. Буфер для siРНК: 30 mM HEPES-KOH (pH 7.4), 100 mM ацетат калия, 2 mM ацетат магния.
Экспериментальное исследование включало 3 экспериментальные группы, 3 группы сравнения и контрольную группу. Каждая экспериментальная группа, группы сравнения и контроль состояли из 10 яиц. Количественный состав всего исследования – 70 оплодотворенных яиц. Экспериментальные группы различались временем введения siРНК к мРНК гена PAX3 стеклянным капилляром в нервную трубку куриного эмбриона. В первой экспериментальной группе время введения составило 51–52 часа, во второй – 53–54 часа, в третьей – 55–56 часов эмбрионального развития. Процесс введения осуществляли со стороны каудального отдела эмбриона, располагая стеклянный капилляр под минимально возможным углом к нервной трубке. В первую группу сравнения включены яйца с эмбрионами, которым в 51–52 часа эмбриогенеза был произведен укол стеклянным капилляром без введения вещества. Во второй группе сравнения укол в нервную трубку стеклянным капилляром был выполнен в 53–54 часа, и в третьей группе – в 55–56 часов эмбрионального развития. Процедура укола проводилась аналогично уколу с введением siРНК. Контрольную группу составили интактные яйца. Инкубацию яиц контролировали до конца эмбриогенеза. Для оценки выживаемости птенцов использовали статистический метод относительных показателей. Вылупившихся цыплят содержали в специальных условиях, соответствующих возрасту птицы, обеспечивающих сбалансированное питание на основе комбикормов, обогащенных белково-витаминными-минеральными комплексами и исключающими возможность развития ожирения. В 1 и 3,5 месяца постнатального развития животным из экспериментальных групп 1 и 2, контрольной группы, а также 1-й и 2-й групп сравнения проведена мультиспиральная компьютерная томография (МСКТ) коленных суставов на двухсрезовом компьютерном томографе GE Healthcare Brivo CT325 (США). В 4 месяца курам из тех же групп выполнено обследование нижних конечностей на цифровой рентгенографической системе GE Discovery XR656 (США). Для определения средних значений углов: угла медиального метафизарного «клюва» (MMB) и метафизарно-диафизарного угла (MDA) – использовали метод вычисления средней арифметической величины. При анализе результатов томографической и рентгенологической диагностики руководствовались терминологией, принятой для описательной анатомии опорно-двигательного аппарата птиц [11, с. 24].
Результаты исследования и их обсуждение. На первом этапе исследования была проведена оценка влияния эксперимента на выживаемость птенцов (рис. 1). Выживаемость определяли по способности к вылуплению, она соответствовала проценту вылупившихся из яйца цыплят на 21–22-е сутки инкубации. Оценивали воздействие укола стеклянным капилляром с введением или без введения вещества в нервную трубку куриного эмбриона. Укол осуществляли в разные временные периоды (51–52, 53–54, 55–56 часов) 16–17-й стадий эмбриогенеза по классификации Гамбургера–Гамильтона. Исследование показало, что укол капилляром в нервную трубку с целью введения интерферирующей siРНК (экспериментальная группа 1) или без введения веществ (сравнительная группа 1) на сроке 51–52 часа эмбрионального развития приводит к 80%-ной выживаемости цыплят (рис. 1). При уколе капилляром на сроке 53–54 часа эмбриогенеза из инкубационных яиц вылуплялось 60% и 50% цыплят в экспериментальной группе 2 и в группе сравнения 2 соответственно. Проведение манипуляций по введению вещества или простое физическое воздействие капилляром в период 55–56 часов эмбрионального развития приводили к гибели эмбрионов еще до вылупления в 80–90% случаев. Выживаемость птенцов в 3-й экспериментальной группе составила 10%, а в группе сравнения – 3–20%. Поскольку показатели выживаемости в экспериментальных группах по сравнению с группами сравнения с аналогичным временем укола достоверно не различаются, допустимо сделать вывод, что ключевую роль в выведении птенцов после эксперимента играет время проведения манипуляции, а не введенное вещество. Полученные результаты могут быть связаны с возможной травматизацией эмбриона на более поздних стадиях развития, которые являются критическими. Вероятно, происходит повреждение такого провизорного органа, как амнион. В 55–56 часов эмбрион соответствует 16-й (51–56 часов) – 17-й стадии (52–64 часа) эмбриогенеза [8, 9]. В этот период амнион простирается ниже уровня 18-го сомита и может быть разной длины. Визуально оценить границы амниона во время укола не представляется возможным, поэтому манипуляции стеклянным капилляром с каудальной части эмбриона могли привести к травмированию и гибели последнего.

Рис. 1. Оценка выживаемости цыплят после эксперимента: ЭГ1 – экспериментальная группа 1, ЭГ2 – экспериментальная группа 2, ЭГ3 – экспериментальная группа 3, ГС1 – группа сравнения 1, ГС2 – группа сравнения 2, ГС3 – группа сравнения 3, К – контрольная группа
Животные из экспериментальной группы 3 и из 3-й группы сравнения были исключены из следующего этапа исследования. Проведение эксперимента во временные промежутки 55–56 часов эмбрионального развития для моделирования ортопедической патологии представляется нецелесообразным в связи с низким процентом выживаемости птенцов.
На втором этапе эксперимента оценивали влияние интерферирующей siРНК, направленной к мРНК гена PAX3, на формирование ортопедической патологии коленных суставов у цыпленка в постнатальном периоде. В 1 и 3,5 месяца после вылупления животным из 2 экспериментальных, контрольной и 2 групп сравнения была проведена мультиспиральная компьютерная томография (МСКТ). Исследование показало отсутствие структурных нарушений нижних конечностей у цыплят из контрольной группы, вылупившихся из интактных яиц (рис. 2). Не диагностировано патологических изменений тазобедренных, коленных и голеноплюсневых суставов и у животных из 1-й и 2-й групп сравнения в 1 и 3,5 месяца постнатального развития после физического воздействия на этапе эмбриогенеза. Таким образом, укол стеклянным капилляром без введения вещества в нервную трубку развивающегося куриного эмбриона не приводит к нарушению нормального формирования скелета нижних конечностей.
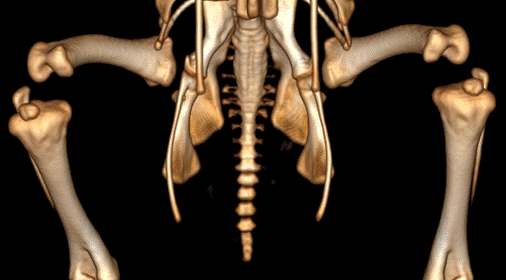
Рис. 2. Трехмерная реконструкция нижних конечностей цыпленка из группы контроля в 1 месяц постнатального развития. Вид спереди
Томографическое исследование нижних конечностей цыплят из экспериментальной группы 1 с введением в нервную трубку куриного эмбриона интерферирующей siРНК во временной промежуток 51–52 часа эмбриогенеза в 1 месяц постнатального развития не выявило структурных нарушений компонентов коленного сустава. Конфигурация бедренной и большеберцовой костей не изменена, контуры ровные и четкие. Малоберцовая кость полностью сформирована. Соотношение костей в коленном суставе правильное. У 50% цыплят данной группы детектирована задержка процесса оссификации большеберцовой кости обеих конечностей (рис. 3а, 3б).
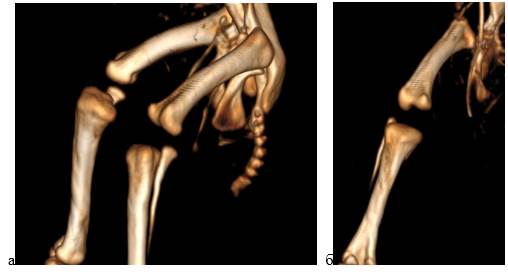
Рис. 3. Трехмерная реконструкция нижних конечностей цыпленка из экспериментальной группы 1 в 1 месяц постнатального развития.
Вид сбоку (а) и спереди (б)
На мультипланарных реконструкциях не визуализируется эпифизарный центр окостенения проксимального отдела большеберцовой кости, наблюдаемый в контроле и у остальных животных экспериментальной группы 1. Сканирование нижних конечностей животных из экспериментальной группы 2 с введением в нервную трубку куриного эмбриона интерферирующей siРНК во временной промежуток 53–54 часа эмбриогенеза не выявило структурных нарушений и задержки оссификации компонентов коленного сустава по сравнению с контролем.
МСКТ-исследование животных из экспериментальной группы 1 в возрасте 3,5 месяца показало, что на трехмерных моделях нижних конечностей отсутствует центр оссификации коленной чашечки правой и левой бедренных костей (рис. 4а). Выявленные изменения обнаружены у 50% цыплят с задержкой остеогенеза, установленной в 1 месяц постнатального развития. Надколенник у этих животных сформирован хрящевой тканью, не визуализирующейся при 3D-реконструкции. Известно, что окостенение рассматриваемого компонента коленного сустава в норме начинается на 12-й неделе после вылупления [11, с.58]. Томографическое исследование нижних конечностей остальных цыплят данной группы свидетельствует о том, что центр окостенения коленной чашечки детектируется и не отличается от аналогичного в группе контроля (рис. 4б). У животных из экспериментальной группы 2 в возрасте 3,5 месяца изображения коленных суставов в сагиттальной, фронтальной и аксиальной проекциях показали отсутствие изменений формы и размеров большеберцовой и бедренной костей по сравнению с контрольной группой. Контуры костей обеих конечностей ровные и четкие. Центр окостенения надколенника визуализируется.

Рис. 4. Трехмерная реконструкция нижних конечностей цыпленка из экспериментальной группы 1 (а) и группы контроля (б) в 3,5 месяца постнатального развития. Вид сбоку
Таким образом, томографическое исследование позволило выявить нарушения развития компонентов коленного сустава в первые месяцы онтогенеза цыпленка, когда рентгенологическое обследование нерезультативно в связи со значительной долей хрящевой ткани. По данным компьютерной томографии можно сделать вывод о замедлении процесса остеогенеза у 50% животных из экспериментальной группы 1. О нарушении нормального развития коленного сустава свидетельствуют задержка оссификации эпифиза проксимального отдела большеберцовой кости в 30 дней постнатального развития и отсутствие очагов окостенения коленной чашечки в возрасте 3,5 месяца. Выявленные изменения не детектированы у остальных цыплят из экспериментальной группы 1 и животных экспериментальной группы 2. Полученные результаты согласуются с данными гистологического исследования о нарушении нормального окостенения в проксимальном отделе большеберцовой кости у детей с болезнью Блаунта [12]. Методом томографии не диагностировано структурных нарушений тазобедренного и голеноплюсневого суставов во всех группах исследования.
Рентгенологическое исследование нижних конечностей цыплят из экспериментальных групп 1 и 2, групп сравнения и группы контроля показало, что в возрасте 4 месяцев постнатального развития все компоненты коленного сустава сформированы. Визуализируются ровные, четкие суставные поверхности бедренной и большеберцовой костей, малоберцовая кость и коленная чашечка. У животных из экспериментальных групп 1 и 2 в проксимальном отделе большеберцовой кости обеих конечностей выявлены расширение и смещение медиального метафиза с формированием выпуклости, похожей на клюв (рис. 5).
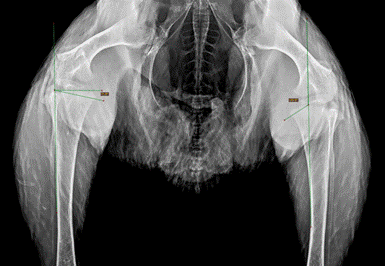
Рис. 5. Рентгенограмма нижних конечностей цыпленка с патологией коленных суставов, 125 дней онтогенеза. Угол MDA 11,8°, угол ММВ 122°
На переднезадних скрининговых рентгенограммах цыплят было произведено определение угла медиального метафизарного «клюва» (MMB) и метафизарно-диафизарного угла (MDA), играющих ключевую роль в диагностике болезни Блаунта [1, 2]. Измерение показало, что средняя величина угла MMB в экспериментальной группе 1 составляет 124° (рис. 5). Среднее значение угла MDA в данной группе равно 13°. Аналогичные результаты получены в экспериментальной группе 2: средний метафизарно-диафизарный угол соответствовал 15°, а величина угла медиального метафизарного клюва – 123°. В группе контроля и группах сравнения 1 и 2 средние значения измеряемых показателей составили: угол MMB 107°, угол MDA 8°. Таким образом, у животных в экспериментальных группах 1 и 2 диагностированы повышенные значения измеряемых углов MDA и MMB по сравнению с животными без введения siРНК в нервную трубку в эмбриональном периоде. Различия в величине углов между экспериментальными группами 1 и 2 отсутствуют.
Рентгенологические данные свидетельствуют о том, что у животных с введением на этапе эмбриогенеза интерферирующей siРНК к гену РАХ3 в постнатальном периоде диагностированы изменения медиальной части проксимального отдела большеберцовой кости, характерные для болезни Блаунта. Полученные результаты по средней величине углов MMB и MDA не отличаются от данных пилотного исследования [6]. Представленные рентгенологические показатели подтверждаются проведенными наблюдением и обследованием экспериментальных цыплят. В 1 месяц постнатального развития у животных в области коленных суставов пальпировались выступающие медиальные мыщелки, тактильно не определяемые у группы контроля. Анализ двигательной активности животных из экспериментальных групп 1 и 2 выявил быструю утомляемость при хождении, невозможность длительного нахождения в положении стоя и прохождения расстояния 1–2 м без остановок и отдыха. О нарушении походки свидетельствовало «переваливание» с ноги на ногу («утиная походка»). Обнаруженные отклонения наблюдались с месячного возраста и были наиболее выражены в 4 месяца. Переломов костей не диагностировано. Хромота и ограничение движений не зафиксированы.
Таким образом, в результате исследования получены данные, позволяющие определить оптимальные временные параметры ингибирования экспрессии РАХ3 гена для моделирования врожденной варусной деформации коленных суставов. Показано, что выживаемость цыплят максимальна после проведения эксперимента в начале 16-й стадии по классификации Гамбургера–Гамильтона, что соответствует 51–52 часам эмбриогенеза. Проведенное томографическое обследование животных в 1 и 3,5 месяца постнатального развития выявило нарушение процесса остеогенеза большеберцовой кости и коленной чашечки у 50% птенцов из экспериментальной группы 1. При рентгенологическом исследовании обнаружено увеличение углов MDA и MMB у цыплят в экспериментальных группах 1 и 2 по сравнению с контролем. Представленные результаты позволяют сделать вывод, что оптимальным временем для проведения эксперимента с целью индуцирования болезни Блаунта у куриц является период 51–52 часа эмбрионального развития (экспериментальная группа 1). Показатели выживаемости в 1-й экспериментальной группе наиболее приближены к контролю, а рентгенологические показатели не отличаются от таковых в экспериментальной группе 2.
Заключение. В рамках гипотезы о роли клеток нервного гребня в индуцировании болезни Блаунта проведено исследование с целью определения оптимальных временных параметров ингибирования экспрессии гена РАХ3 для моделирования врожденной варусной деформации коленных суставов в эксперименте. Полученные данные свидетельствуют о том, что выживаемость цыплят максимальна при введении интерферирующей siРНК в нервную трубку куриного эмбриона в начале 16-й стадии по классификации Гамбургера–Гамильтона. Томографическое исследование в первые месяцы постнатального развития цыпленка выявило нарушение процесса оссификации большеберцовой кости и коленной чашечки у 50% кур с индуцированной патологией коленного сустава. Рентгенологически у экспериментальных животных диагностированы изменения медиальной части проксимального отдела большеберцовой кости, характерные для болезни Блаунта. Исследование продолжается.



