Введение
Глиомы – это наиболее распространенные злокачественные опухоли центральной нервной системы, представляющие особую сложность для терапии из-за своего инвазивного роста и радиорезистентности. Несмотря на обширные исследования, биологические характеристики и молекулярные механизмы, обусловливающие развитие глиом, остаются до конца не выясненными [1]. Бор-нейтронозахватная терапия (БНЗТ) – один из наиболее перспективных методов, позволяющих повредить ДНК опухолевых клеток [2, 3]. Несмотря на успешное клиническое применение БНЗТ для лечения меланомы и рака головы и шеи и ее одобрение в Японии для лечения этих заболеваний [4], достижение полного излечения глиобластомы с помощью этой методики остается сложной задачей. Тем не менее, БНЗТ считается перспективным подходом к лечению глиомы благодаря использованию высокопоточного альфа-излучения, которое преодолевает радиорезистентность гипоксических опухолевых клеток к обычной кислородно-зависимой рентгеновской радиотерапии [5]. Несмотря на существующую литературу по использованию БНЗТ в экспериментальных и клинических условиях, все еще не хватает данных по детальному морфологическому анализу изменений органов на тканевом, клеточном и ультраструктурном уровнях.
Ранее авторы исследовали структурные реакции в миокарде и печени мышей CD-1 после введения BSH в дозах 100 и 1000 мг/кг массы тела животных, выявив значительные структурные изменения, которые сохранялись до 7 дней после терапии [6]. Было показано, что введение дозы 100мг/кг было относительно безвредным, в то время как более высокая доза 1000 мг/кг привела к серьезным побочным эффектам. Исследование показало необходимость тщательного управления дозой при БНЗТ для предотвращения возможного повреждения здоровых тканей при лечении злокачественных опухолей.
Молекулярные механизмы воздействия БНЗТ на биологические ткани до сих пор не изучены, что ограничивает возможность компетентной оценки воздействий и их последствий для опухолей, условно здоровых тканей и для организма в целом.
Для исследования была выбрана всесторонне изученная клеточная линия U-87 MG, широко используемая для моделирования и исследования невропатологических процессов [7]. Использование иммуногистохимического маркера Ki-67 для оценки пролиферативного потенциала опухолевых клеток считается золотым стандартом диагностики и играет важнейшую роль в прогнозе и планировании терапии. Этот маркер позволяет точно оценить патологически измененные участки ткани или выявить сдвиги в центрах пролиферации после терапевтических вмешательств [8]. Иммуногистохимическое определение фосфорилированного H2A-гистон X (H2AX, γH2AX) дает возможность анализировать двухцепочечные разрывы ДНК и их репарацию, что важно для оценки динамики терапевтических процедур. γH2AX анализируется не только как маркер опухолевой прогрессии, но и как прогностический критерий результатов лечения [9].
С учетом этих данных целью настоящего исследования было изучить индекс пролиферативной активности по уровню экспрессии Ki-67 и уровень экспрессии фосфорилированного гистона γH2AX в ксенотрансплантатах U-87 MG для оценки радиочувствительности опухоли при различных режимах БНЗТ с использованием ускорителя-тандема в ИЯФ СО РАН.
Материалы и методы исследования. Эксперименты проводились в соответствии с принципами гуманного обращения с животными согласно директиве Европейского сообщества (86/609/EEC). Протокол исследования животных был одобрен Комитетом по биоэтике Института цитологии и генетики СО РАН (протокол №161 от 18.12.2023 г.). В эксперименте использовали 60 иммунодефицитных мышей линии SCID, массой тела 23–25 г без разделения по полу. Мыши были получены из ЦКП «SPF-виварий» ФИЦ ИЦиГ СО РАН, где содержались в стандартных условиях [7]. В возрасте 6 недель животным подкожно инокулировали 100 мкл суспензии клеток глиобластомы человека U-87 MG (ATCC® HTB-14™), которые готовили по описанной ранее методике [10]. Клетки глиобластомы были получены из коллекции ЦКП«SPF-виварий».
Через 2 недели после инокуляции опухолевых клеток мыши были разделены на 5 групп по 12 животных в каждой. Животные 1-й группы получали 0,9%-ный р-р NaCl; 2-й – 0,9%-ный р-р NaCl и облучение; 3-й – однократное введение боро-каптата натрия (BSH) (100 мг/кг) + облучение; 4-й – L-p-борофенилаланина (BPA) (700 мг/кг) и облучение; 5-й – BSH (100 мг/кг) + BPA (700 мг/кг) + облучение. В исследовании были использованы терапевтические дозы борсодержащих веществ: L-p-борофенилаланина (BPA) (Interpharma Praha A.s., Чехия), на фруктозе (Sigma-Aldrich, США), который готовили и вводили по стандартной методике [3, 10, 11], и боро-каптат натрия (BSH) (Katchem Ltd, Чехия) – на 0,9%-ном растворе NaCl (Renewal, Россия). Облучение проводилось в терапевтических дозах [10] в течение 120 минут пучком со следующими параметрами ускорителя: энергия протонов – 2,05 МэВ, ток – 2 мА, интеграл тока – 2,6 мАч. Забор опухолевого узла проводили на 7-е и 14-е сутки после БНЗТ.
Из эксперимента животных выводили декапитацией, опухолевый узел с подкожной клетчаткой вырезали, измеряли и взвешивали, рассекали пополам и фиксировали в 10%-ном нейтральном формалине (Thermo Scientific, Германия). Проводку осуществляли в аппарате STP-120 (Microm GmbH, Германия). Срезы толщиной 2–3 мкм получали на ротационном микротоме НМ 325 (Thermo Fisher Scientific, Великобритания). После стандартной процедуры депарафинации и дегидратации окрашивали гематоксилином и эозином.
Иммуногистохимически на парафиновых срезах оценивали пролиферативную активность клеток опухолевого узла с использованием ядерного маркера пролиферации Ki-67. Для оценки чувствительности опухоли к БНЗТ проводили исследование γH2AX, являющегося маркером двухцепочечных разрывов ДНК и активатором репарации этого дефекта. После стандартной процедуры депарафинации срезы подвергали тепловому демаскированию в цитратном буфере (pH 6,0) с последующим блокированием эндогенной пероксидазы и белка. Для исследования были использованы первичные поликлональные антитела фирмы Elabscienc (Китай) в разведении 1:100 и универсальная двухстадийная система детекции Prime Vision (ООО «ПраймБиоМед», Россия), применяемая с соблюдением рекомендаций производителя. После проведения реакции срезы докрашивали гематоксилином Гарриса. Результаты иммуногистохимического анализа оценивали путем подсчета количества Ki-67 и γH2AX-позитивных ядер в неопластической ткани. В каждом случае анализировали не менее 1000 клеток, используя компьютерную программу визуализации изображений QuPath v0.4.3. Индекс пролиферативной активности (PAI) определяли по экспрессии Ki-67, а количественный показатель уровня разрывов ДНК – по экспрессии γH2AX, оба показателя выражали в процентах. Сканы для анализа были получены с помощью сканера MagScanner KF-PRO-005-EX (Yuyao Technology Innovation Center, Китай).
Исследования проведены с использованием универсального микроскопа Leica DM 4000B, микрофото получены с помощью цифровой фотокамеры Leica DFC 230 и компьютерной программы Leica QWin3 (Leica Microsystem, Великобритания).
Статистический анализ полученных результатов проводили с помощью программы Statistica 7.0 (StatSoft, Inc., США). Данные представлены в виде средних значений и их стандартных отклонений. Сравнение средних величин проводили с помощью t-теста Стьюдента, а р-значения проверяли с помощью одностороннего дисперсионного анализа (ANOVA), при этом р<0,05 считали показателем статистической значимости.
Результаты исследования и их обсуждение
Концентрация бора в опухоли через 30 минут после внутрибрюшинного введения варьировала в зависимости от соединения и составила 17,6 мкг/г для BSH, 13,7 мкг/г для BPA и 24,7 мкг/г для комбинации BPA и BSH. Общая поглощенная доза в опухоли после БНЗТ составила 7,6 Гр для BSH, 8,3 Гр для BPA и 10,6 Гр при совместном применении обоих борсодержащих соединений (BSH+BPA). К концу периода наблюдения ни одно животное не погибло от облучения, и не было отмечено значительных изменений массы тела. Увеличение как массы, так и объема опухоли наблюдалось во всех группах после БНЗТ вплоть до 14-го дня наблюдения (табл. 1).
Через 14 дней после начала эксперимента масса опухоли увеличилась во всех группах по сравнению с массой на 7-й день. В контрольной группе рост опухоли привел к увеличению массы на 44,4%. В группе, где проводилось только облучение, наблюдалось наиболее быстрое увеличение массы опухоли на 150,0%, при этом масса опухоли была больше по сравнению с контрольной группой (р=0,002). В группе BSH БНЗТ разница между 7-м и 14-м днем составила 93,7%, и эти значения не отличались от контроля (р>0,05), в то время как в группах BPA БНЗТ и комбинированной БНЗТ масса опухоли увеличилась на 58,4% и 45,2% соответственно, и разница с контрольной группой была статистически значимой (р=0,005 и р<0,001 соответственно). Что касается эффекта БНЗТ, то комбинация BSH и BPA приводила к максимальному контролю за ростом опухоли на 14-й день по сравнению со всеми остальными группами (р<0,001).
В течение первой недели эксперимента при сравнении массы опухоли относительно массы тела мышей наблюдалось значительное снижение массы опухоли у всех облученных мышей по сравнению с контролем (р≤0,023), что совпадает с прямым сравнением. Через 14 дней после начала эксперимента относительная масса опухоли увеличилась во всех группах по сравнению со значениями, полученными на 7-й день. В контрольной группе наблюдалось увеличение на 38,2%. В группах только облучения, BSH БНЗТ, BPA БНЗТ и комбинации борсодержащих соединений БНЗТ относительная масса опухоли увеличилась на 76,2%, 67,2%, 35,2% и 34,2% к 14-му дню эксперимента соответственно. Разница между группами только облучения, BSH БНЗТ и контрольной группой была незначительной (р>0,05), в то время как значения в группах BPA БНЗТ и комбинированной лекарственной БНЗТ были значительно ниже по сравнению с группами только облучения и контрольной группой (р≤0,038).
Анализ объема опухоли в указанные временные точки показал, что в течение первой недели эксперимента объем опухоли увеличивался во всех группах по сравнению с измерениями, проведенными в день 0 (р<0,01). Значительное ускорение увеличения объема опухоли в течение второй недели также наблюдалось во всех группах, как облученных с соединениями бора, так и без них, по сравнению с их состоянием на 7-й день после облучения или после начала эксперимента (р<0,01).
Пролиферацию опухолевых клеток анализировали в тех же временных точках (7 и 14 дней от облучения). Через неделю после начала эксперимента индекс пролиферации Ki-67 составил 43,04±4,60% в контрольной группе, 19,98±1,80% в группе облучения без соединений бора, 32,97±2,90% в группе БНЗТ с BSH, 52,72±2,60% в группе БНЗТ с BPA, и 57,10±4,60% в группе БНЗТ с BPA и BSH. Значительное снижение (р<0,01) индекса пролиферации Ki-67 наблюдалось через две недели после БНЗТ с BPA и БНЗТ с BPA и BSH по сравнению с аналогичными группами через неделю после БНЗТ.
Через две недели наблюдения наблюдалось увеличение индекса пролиферации Ki-67 в контрольной группе, группе только облучения и группе БНЗТ с BSH по сравнению с аналогичными группами через неделю после начала эксперимента. Так, к 14-му дню наблюдалось увеличение пролиферативной активности клеток, которое составило 30,8% в необлученной контрольной группе и 71,6% в группе, облученной нейтронным пучком без соединений бора, по сравнению с показателями 7-го дня. Индекс Ki-67 в группе, облученной нейтронным пучком без соединений бора, увеличился на 50,5% на 14-й день по сравнению с измерениями на 7-й день после облучения.
Анализ экспрессии γH2AX показал значительное увеличение (р<0,01) количества двунитевых разрывов ДНК, наблюдавшееся как в группе облучения без соединений бора, так и в группе БНЗТ по сравнению с необлученной контрольной группой как через одну, так и через две недели эксперимента (табл. 1).
Таблица 1
Изменения в росте опухоли после БНЗТ (M±m)
|
Параметры |
Группы |
|||||||||
|
Группа 1 Контроль |
Группа 2 Облучение |
Группа 3 BSH БНЗТ |
Группа 4 BPA БНЗТ |
Группа 5 BSH+BPA БНЗТ |
||||||
|
Время после введения соединения бора, дни |
||||||||||
|
7 |
14 |
7 |
14 |
7 |
14 |
7 |
14 |
7 |
14 |
|
|
Масса тела, г |
25,72±0,93 |
25,75±1,19 |
24,02±1,78 |
24,90±1,30 |
24,32±1,59 |
26,47±1,26 |
24,33±0,93 |
26,30±0,84 |
23,43±1,4 |
25,85±1,36 |
|
Исходный объем опухоли, мм3 |
484,08±87,80 |
447,20±41,81 |
326,20±91,70 |
682,00±94,40 |
386,30±67,46 |
501,00±39,50 |
425,10±113,30 |
456,30±65,97 |
437,70±81,5 |
569,20±92,5 |
|
Конечный объем опухоли, мм3 |
1112,20±181,2& |
1647,70±290,81&,% |
689,30±148,80& |
1307,40±135,3&,% |
808,00±123,1& |
1820,80±151,5&,% |
908,00±122,7& |
1699,90±199,03&,% |
755,60±120,9& |
1629,10±333,5&,% |
|
Масса опухоли, г |
0,90±0,01 |
1,30±0,18 |
0,60±0,14 |
1,50±0,07# |
0,63±0,12 |
1,22±0,12 |
0,77±0,08 |
1,12±0,09@ |
0,62±0,09 |
0,90±0,15* |
|
Относительная масса опухоли, мг/г массы тела. |
36,55±5,49 |
50,51±6,60 |
26,57±6,36** |
46,81±3,77 |
27,63±5,73** |
46,19±4,23 |
31,83±3,81** |
43,04±4,58## |
26,38±4,06** |
35,41±6,83@@ |
|
Ki-67, % |
43,04±4,60 |
62,20±21,20 |
19,98±1,80 |
70,52±9,80 |
32,97±2,90 |
41,87±4,20 |
52,72±2,60 |
46,99±4,12&& |
57,10±4,60 |
47,13±7,90&& |
|
Экспрессия γH2AX, % |
56,76±14,95 |
32,83±14,56 |
91,29±1,70%% |
84,02±10,94%% |
84,24±10,94%% |
83,90±5,66%% |
78,37±7,70%% |
85,15±5,25%% |
84,86±9,83%% |
74,68±11,16%% |
Символами обозначены статистически значимые отличия:
* – по сравнению со значениями в контрольной группе на 14-й день, р<0,001.
# – по сравнению со значениями в контрольной группе на 14-й день, р=0,002.
@ – по сравнению со значениями в контрольной группе на 14-й день, р=0,005.
** – по сравнению со значениями в контрольной группе на 7-й день, р≤0,023.
## – по сравнению со значениями в группах 1 и 2 на 14-й день, р≤0,038.
@@ - по сравнению со значениями в группах 1 и 2 на 14-й день, р≤0,038.
& – по сравнению со значениями для этой группы на день 0 (исходный объем опухоли), р<0,01.
% – по сравнению со значениями для этой группы на день 7, р<0,01.
&& – по сравнению со значениями для этой группы на день 7, р<0,01.
%% – по сравнению со значениями в контрольной группе, р<0,01.
В образцах контрольной группы мышей на 7-й и 14-й день была обнаружена ядерная экспрессия Ki-67 (рис. 1).
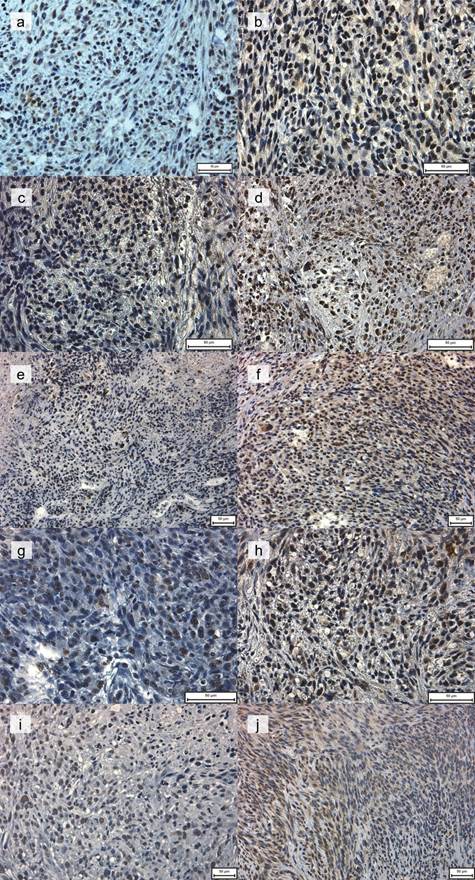
Рис. 1. Экспрессия Ki-67 на 7-е (a, c, e, g, i) и 14-е (b, d, f, h, j) дни после начала эксперимента
Пояснения. Группа 1 (контроль): Ki-67-положительные ядра, диффузно расположенные по всему срезу (a); повышенное количество диффузно расположенных Ki-67-положительных ядер (b). Увеличение: х400. Группа 2 (только облучение): умеренное количество Ki-67-положительных ядер, расположенных преимущественно на периферии опухолевого узла (c); выраженная смешанная экспрессия Ki-67, клетки диффузно расположены по всему срезу (d). Увеличение: х400. Группа 3 (облучение после введения 100 мг/кг BSH): умеренная экспрессия Ki-67 в ядрах и цитоплазме, иногда смешанная, наблюдается в опухолевых клетках, диффузно расположенных по всему образцу (e); более выраженная экспрессия Ki-67 в ядрах и цитоплазме, иногда смешанная, диффузно расположенная по всему срезу (f). Увеличение: х200. Группа 4 (облучение после инъекции 700 мг/кг BPA): ядерная экспрессия Ki-67 наблюдается в опухолевых клетках, диффузно расположенных по всему образцу (g); преимущественно цитоплазматическая экспрессия Ki-67, диффузно расположенная по всему образцу (h). Увеличение: х400. Группа 5 (облучение после совместного введения BSH и BPA): выраженная экспрессия Ki-67 в ядрах и цитоплазме наблюдается в опухолевых клетках с фокальным расположением вдоль образца (i); выраженная экспрессия Ki-67 в ядрах и/или цитоплазме, организованных в группы (j). Увеличение: х400.
В группе 1 (контроль) ядерная экспрессия Ki-67 с диффузным распределением по образцу наблюдалась в обеих временных точках (рис. 1a и 1b), с более высокой экспрессией на 14-й день (рис. 1b).
В группе 2 (только облучение), как и в контрольной группе, исключительно ядерная экспрессия Ki-67 наблюдалась на 7-й день с Ki-67-положительными ядрами, преимущественно расположенными на периферии опухоли (рис. 1c). Индекс пролиферативной активности был ниже на 46,4% (р<0,001) по сравнению с группой 1. К 14-му дню наблюдалось быстрое увеличение пролиферативной активности, примерно в 2,5 раза больше, чем на 7-й день в той же группе (р<0,001, рис. 1d), и на 13,4% больше, чем в группе 1 в ту же временную точку. Ki-67 уже был выражен как в ядрах, так и в цитоплазме опухолевых клеток, что, вероятно, было связано с реакцией клеток на быстрые нейтроны и гамма-компоненты излучения пучка. Кроме того, реакция значительно различалась у разных животных в пределах группы, вероятно, под влиянием естественной изменчивости; эта гипотеза подтверждается достаточно высокой стандартной ошибкой.
Через 7 дней после BNCT с BSH (группа 3) индекс пролиферативной активности был на 23,3% ниже по сравнению с группой 1 (контроль) в ту же временную точку и на 32,7% ниже на 14-й день эксперимента. В группе 3 индекс Ki-67 увеличился на 27,0% на 14-й день по сравнению с 7-м днем. Подобная динамика наблюдалась в первых двух группах (контроль и только облучение), что указывает на частичный и краткосрочный ответ опухоли на терапию. Независимо от времени исследования опухолевые клетки после введения BSH с облучением демонстрировали ядерный, цитоплазматический и иногда смешанный (ядерный и цитоплазматический) типы экспрессии Ki-67 (рис. 1e и 1f), что может быть обусловлено патоморфозом, связанным с терапией.
В группе 4, которая получила 700 мг/кг BPA с последующим нейтронным облучением, наблюдались более высокий уровень экспрессии Ki-67 на 7-й день (на 22,4%; р<0,001) и его выраженное снижение на 14-й день (на 24,5%; p<0,05), оба по сравнению с контролем. Пролиферативная активность снизилась на 10,9% в группе через две недели. На 7-й день наблюдалась ядерная экспрессия (рис. 1g), тогда как на 14-й день преобладала цитоплазматическая экспрессия, и менее интенсивное ядерное окрашивание наблюдалось только в редких случаях (рис. 1h).
В группе 5, которая получила комбинацию BSH и BPA с последующим нейтронным облучением, на 7-й день после терапии наблюдался неожиданно высокий уровень экспрессии Ki-67 на 32,7% по сравнению с группой 1 (р<0,001). На 14-й день экспрессия Ki-67 достоверно снизилась на 24,2% по сравнению с группой 1 (р<0,05). Внутригрупповое сравнение показало снижение этого показателя на 17% к 14-му дню по сравнению с 7-м днем, что обусловило соответствующую динамику роста опухоли. Характерной особенностью экспрессии Ki-67 на 7-й день в группе 5 было исключительно ядерное окрашивание и их расположение в образце небольшими группами (рис. 1i). При этом интенсивность окрашивания ядер сильно различалась. К 14-му дню сохранялся очаговый характер экспрессии Ki-67, и, помимо ядерного типа экспрессии, часто появлялись клетки с цитоплазматическим и смешанным типами экспрессии (рис. 1j).
Экспрессия γH2AX в гистологических образцах экспериментальных групп, полученных на 7-й и 14-й дни, представлена на рисунке 2.
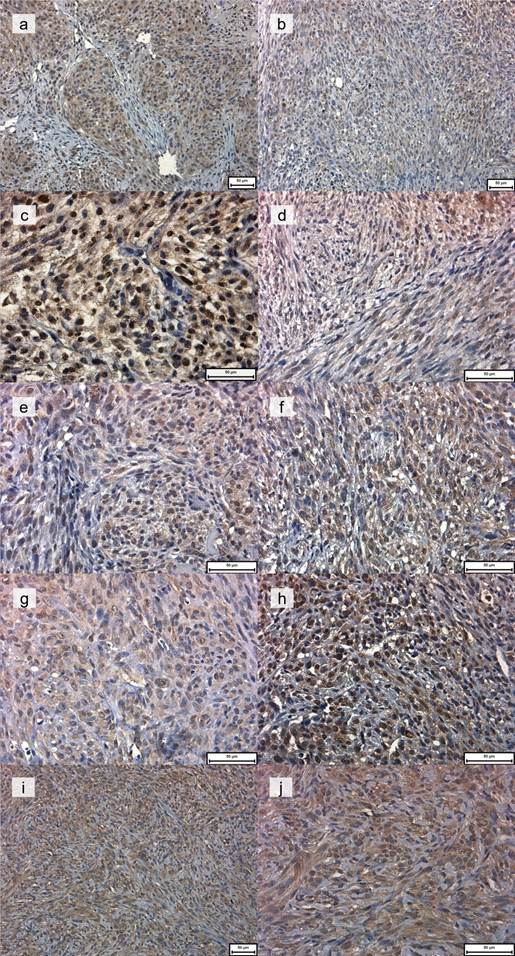
Рис. 2. Экспрессия γH2AX на 7-й (a, c, e, g, i) и 14-й (b, d, f, h, j) день после начала эксперимента
Пояснения. Группа 1 (контроль): ядерная, цитоплазматическая или смешанная экспрессия на 7-й день (a); к 14-му дню экспрессия γH2AX снижается (b). Увеличение: х200. Группа 2 (только облучение): значительная ядерная, цитоплазматическая и смешанная экспрессия γH2AX на 7-й день (c); снижение экспрессии к 14-му дню (d). Увеличение: х400. Группа 3 (облучение после введения 100 мг/кг BSH): на 7-й день умеренная экспрессия наблюдается как в ядрах, так и в цитоплазме (e); на 14-й день экспрессия также наблюдается как в ядрах, так и в цитоплазме, при этом опухолевые клетки диффузно распределены по всему образцу (f). Увеличение: х400. Группа 4 (облучение после инъекции 700 мг/кг BPA): ядерная, цитоплазматическая и смешанная экспрессия в обеих временных точках (g, h). Увеличение: х400. Группа 5 (облучение после совместного введения BSH и BPA): цитоплазматическая и ядерная экспрессия γH2AX. Увеличение: х200 (a) и х400 (b).
Уровень экспрессии γH2AX в опухолевой ткани в группе 1 (контроль) составил 56,76±14,95% к 7-му дню эксперимента. К 14-му дню он снизился до 32,83±14,56%, что составляет снижение на 42,2%. При детальном морфологическом исследовании были выявлены следующие характеристики воздействия БНЗТ: структура опухолевого узла и его гетерогенность сохранялись как на 7-е, так и на 14-е сутки эксперимента, с ядерной, цитоплазматической и/или смешанной экспрессией γH2AX (рис. 2a и 2b).
В группе 2 (только облучение, рис. 2c и 2d) ядерная экспрессия фосфорилированного гистона γH2AX составила 91,3±1,7% на 7-е сутки и 84,0±10,9% на 14-е сутки после облучения. Эти значения были значительно выше, чем в группе 1, на 60,8% и 156,1% соответственно (р<0,001).
После БНЗТ с BSH (100 мг/кг, группа 3) уровни экспрессии γH2AX достигли 84,2±10,9% на 7-й день и 83,90±5,66% на 14-й день, показав увеличение на 48,4% и примерно в 1,5 раза соответственно (рис. 2e и 2f) по сравнению с группой 1. Никаких существенных изменений не наблюдалось между 7-м и 14-м днями (0,4%, р>0,05).
В группе 4 (облучение BPA в дозе 700 мг/кг) анализ экспрессии γH2AX выявил более высокие уровни этого маркера по сравнению с контролем как на 7-й день (78,37±7,70%), так и на 14-й день (85,15±5,25%), зафиксировав увеличение на 38,1% и 159,4% (оба р<0,001) соответственно. Экспрессия γH2AX увеличилась к 14-му дню в той же группе, и это была единственная группа, где наблюдался такой эффект. Более того, важным открытием было наблюдение ядерной, цитоплазматической и смешанной экспрессии на 7-й день (рис. 2g), в то время как ядерная экспрессия стала более выраженной на более поздней стадии, несмотря на наличие всех типов локализации экспрессии (рис. 2h).
В группе 5 наблюдалось увеличение экспрессии γH2AX на 49,5% на 7-й день (84,86±9,83%) и на 127,5% (р<0,001) на 14-й день (74,68±11,16%) по сравнению с контролем. В группе наблюдалось 12%-ное снижение ядерной экспрессии с 7-й по 14-й день. Локализация экспрессии γH2AX была преимущественно цитоплазматической, в меньшей степени ядерной и редко смешанной (рис. 2i и j).
В частности, на 7-й день уровень экспрессии γH2AX составил 84,24±10,94% в группе 3, 78,37±7,70% в группе 4 и 84,86±9,83% в группе 5. По сравнению с контрольной группой увеличение экспрессии γH2AX в группе 3 составило 48,2% на 7-й день и 155,8% на 14-й день; в группе 4 увеличение составило 38% на 7-й день и 159,8% на 14-й день; а в группе 5 увеличение составило 49,5% на 7-й день и 127,7% на 14-й день.
В настоящем исследовании выявлена тенденция к более медленному увеличению массы опухоли после БНЗТ по сравнению с изменением массы опухолей контрольных животных, что отражает эффективность БНЗТ в лечении глиобластомы человека, видимую уже на 7-й день после терапии. В конце первой недели масса опухоли во всех группах облученных мышей была статистически значимо (р<0,001) ниже, чем в контрольной группе. Однако масса опухолевого узла в группах БНЗТ статистически не отличались от таковой в группе только облучения (р>0,05). Через 2 недели после применения БНЗТ с BSH была неэффективна в снижении роста опухолевой массы, тогда как опухолевая масса в группах BPA БНЗТ и комбинированной BSH + BPA БНЗТ была значительно меньше, чем в контрольной группе и группе только облучения (р<0,005). Наилучший эффект сдерживания роста опухолевой массы был достигнут при использовании комбинации BPA и BSH с нейтронным облучением, что свидетельствует о возможности использования комбинации этих соединений в клинической практике в качестве метода повышения эффективности БНЗТ, а также подтверждается публикациями других исследователей [12, 13, 14].
Наблюдалось статистически значимое снижение (р<0,01) внутригрупповых значений индекса Ki-67 к 14-му дню в группе BPA БНЗТ на 10,9%, а в группе БНЗТ с комбинацией BPA и BSH – на 17,5%, по сравнению с 7-м днем после терапии. Это, вероятно, связано с селективностью BPA и его способностью проникать и накапливаться в опухолевых клетках благодаря метаболизму аланина в его составе. В группе BSH БНЗТ индекс пролиферативной активности Ki-67 увеличился на 27,0% на 14-й день по сравнению с 7-м днем, что, по-видимому, связано с отсутствием селективного накопления бора в опухоли и его отложением в межклеточном пространстве.
Повышенная экспрессия фосфорилированного гистона γH2AX в опухолевых клетках облученных мышей свидетельствовала, прежде всего, об активации репаративных процессов, направленных на устранение повреждений [15]. Увеличение экспрессии γH2AX в облученных группах характерно для воздействия ионизирующего излучения и может косвенно указывать на наличие соответствующих компонентов в использованном пучке нейтронов.
Заключение. Таким образом, анализируя изменения индекса пролиферативной активности опухолевой ткани через 7 и 14 дней после БНЗТ с разными носителями бора, важно отметить, что само облучение эпитепловым нейтронным пучком может вызывать существенное, но транзиторное торможение роста опухолевого узла, что может быть связано с неоднородностью применяемого пучка. Наблюдаемое статистически значимое снижение количества двунитевых разрывов ДНК в контрольной (р=0,005) и облученной (р=0,034) группах говорит о вероятности успешной репарации ДНК после БНЗТ с разными носителями бора. Во всех группах БНЗТ наблюдались незначительные изменения экспрессии γH2AX с течением времени (р>0,05), что свидетельствует о продолжении процессов репарации ДНК и их потенциальной недостаточности, приводящей к контролю роста опухоли.
Авторы выражают благодарность И.А.Разумову за помощь в наработке опухолевых клеток, а также Е.С.Прохоровой за помощь при эвтаназии мышей. Авторы признательны группе физиков из лаборатории БНЗТ Института ядерной физики имени Г.И.Будкера СО РАН за генерацию нейтронного пучка и помощь в подготовке и проведении процедур облучения животных, а также Т.С.Сычевой за расчет доз облучения.
Авторы заявляют об отсутствии конфликта интересов.



