Введение
Пресакральные кисты (ПК) – это группа редких врожденных заболеваний, характеризующихся возникновением кистозных новообразований в пресакральной (ретроректальной) области с частотой встречаемости 1:40000 [1, 2, 3]. При этом соотношение женщин и мужчин характеризуется преобладанием женщин и составляет 3:1 [1]. Золотым стандартом предоперационной диагностики пресакральных кист является магнитно-резонансная томография органов малого таза с внутривенным контрастированием (МРТ ОМТ), поскольку позволяет оценить размеры, локализацию, структуру новообразования и определить его отношение к окружающим органам и тканям [2, 3]. В то же время единственным радикальным методом лечения ПК является хирургический в объеме удаления кисты в пределах неизмененных тканей [4, 5]. Несмотря на проведенные ранее исследования, в связи с редкостью заболевания в мировой литературе до сих пор отсутствует унифицированный подход к выбору оптимального и безопасного оперативного доступа при удалении ПК [6, 7]. Существует несколько диагностических критериев, позволяющих выбрать хирургический доступ для иссечения ПК [6, 8, 9]. Наибольшее распространение получил подход, при котором в качестве границы хирургических возможностей трансабдоминального и промежностного доступа при удалении ПК является S4 крестцовый позвонок [10, 11, 12]. Таким образом, новообразования, располагающиеся ниже S4, следует удалять через промежностный (парасакральный или транссакральный доступ), однако при таком подходе результаты хирургического лечения характеризуются высокой частотой рецидива заболевания (27,1%) [13]. Также авторы сообщают, что в двух наблюдениях отмечалось неконтролируемое кровотечение во время операций, выполненных через промежностный доступ [13]. Повреждение стенки прямой кишки встречалось в 17% наблюдений [11]. Кроме того, сообщается об одном случае невозможности радикального удаления опухоли, локализующейся на уровне нижнего края S4, из-за недостаточной экспозиции операционного поля [14]. Подход к хирургическому лечению пациентов с ПК, за исключением внедрения в клиническую практику использования лапароскопической ассистенции, принципиально не изменился [1, 2, 8]. Новой вехой в проблеме выбора хирургического доступа низко расположенных кист стало исследование T. Bardol и соавт. (MiaRT study), основанное на ретроспективном анализе 23 пролеченных пациентов [6]. В качестве альтернативной границы лапароскопического и промежностного доступов авторы предлагают уровень S5: новообразования, расположенные на уровне или выше S5, следует иссекать лапароскопически, кисты, локализованные ниже этого уровня, – трансанально либо через промежностный доступ [6]. Авторы сообщают об отсутствии рецидивов заболевания за весь период наблюдения [6]. К недостаткам опубликованных исследований относятся: небольшое число наблюдений, а также отсутствие групп сравнений с другими подходами, использующими в качестве критериев выбора доступа не только высоту локализации кист, но и другие характеристики. Выбор оптимального хирургического доступа для удаления ПК все еще остается дискутабельным вопросом.
Цель исследования
Валидировать дифференциальный подход к хирургическому лечению пациентов с пресакральными кистами.
Материал и методы исследования
Дизайн исследования
Было проведено проспективное сплошное клиническое исследование, в которое был включен 81 пациент с ПК. Исследование проводилось на базе Клиники колопроктологии и малоинвазивной хирургии Университетской клинической больницы № 2 Сеченовского Университета с 2013 по 2023 гг. Критериями включения являлись: клинический диагноз «пресакральная киста», возраст от 18 лет, наличие информированного добровольного согласия на участие в исследовании. Критерием исключения являлись: патоморфологический диагноз «пресакральная солидная опухоль», отказ пациента от продолжения участия в исследовании.
Первичной конечной точкой стала интраоперационная травма стенки прямой кишки. В качестве вторичных конечных точек оценивались: вскрытие просвета кисты во время операции, формирование превентивной колостомы, объем кровопотери, длительность операции, частота и характер послеоперационных осложнений, установка дренажа в область операции, срок удаления дренажа, длительность послеоперационного койко-дня, рецидив заболевания.
Диагностика и выбор хирургического доступа
Основным методом дооперационной диагностики была МРТ ОМТ с в/в контрастированием. Все пациенты были оперированы с использованием одного из четырех хирургических доступов: трансабдоминальный лапароскопический, промежностный, комбинированный, трансабдоминальный роботический.
Авторами были разработаны критерии выбора хирургического доступа.
1. Трансабдоминальный лапароскопический доступ применялся при локализации верхнего полюса кисты на уровне S1–S5 крестцовых позвонков, а нижнего полюса – на уровне не ниже верхушки копчика без распространения кист до уровня прямокишечной шеи.
2. Промежностный доступ использовался при локализации верхнего полюса кисты не выше уровня Со1 копчикового позвонка.
3. Комбинированный лапароскопически-ассистированный абдомино-перинеальный доступ применялся для удаления протяженных кист, верхний полюс которых располагался на уровне S1–S5 крестцовых позвонков, а нижний полюс – дистальнее последнего копчикового позвонка с распространением до уровня прямокишечной шеи.
4. Роботический доступ применялся в качестве альтернативы комбинированному.
В качестве дополнительных критериев дооперационной диагностики использовались следующие выбранные авторами параметры:
1) объем кисты в см3, который рассчитывался по стандартной формуле: Vсм3 = 0,523 * длина в см * ширина в см * высота в см, где 0,523 – постоянный коэффициент;
2) ACL (+) (anococcygeal ligament) – наличие точки фиксации кисты к анокопчиковой связке;
3) IS (+) (intersphincteric space) – наличие распространения камер кисты либо отдельных мелких кист в интерсфинктерное пространство;
4) LEV (+) (levators) – наличие точки фиксации кисты к мышцам, поднимающим задний проход;
5) CRF (+) (cyst-rectum fat) – наличие клетчаточной прослойки между стенкой прямой кишки и пресакральной кистой в точке ее наибольшего прилежания;
6) CRD (cyst-rectum distance) – расстояние от края ануса до точки наибольшего прилежания кисты к прямой кишке, мм;
7) PPD (promontorium-pubis distance) – расстояние от мыса крестца до лобкового симфиза, мм;
8) CMD (cyst-median distance) – расстояние от точки наибольшего прилежания кисты к прямой кишке до середины PPD, мм;
9) PUD (promontorium-upper pole distance) – расстояние от мыса крестца до верхнего полюса кисты, мм;
10) PCD (promontorium-coccyx distance) – расстояние от мыса крестца до верхушки копчика, мм.
Хирургическое вмешательство
Трансабдоминальный лапароскопический и роботический доступы характеризовались расстановкой троакаров, как для осуществления операции низкой передней резекции прямой кишки. Проводились диссекция в пресакральном пространстве и мобилизация задней стенки прямой кишки с сохранением элементов вегетативной нервной системы таза. Мобилизация пресакральной кисты выполнялась с помощью ультразвукового диссектора. С целью обеспечения оптимальной экспозиции операционного поля и предотвращения интраоперационной травмы стенки прямой кишки во время мобилизации кисты ассистент осуществлял пальцевое ректальное исследование или вводил в задний проход пушер. В случае наличия точки фиксации кисты к пластинке мышц, поднимающих задний проход, или к анокопчиковой связке выполнялась их резекция. Для извлечения препарата использовался расширенный троакарный разрез.
При проведении операции через промежностный доступ пациент укладывался в прон-позицию по типу «перочинного ножа». Разрез длиной 4–7 см осуществляли между верхушкой копчика и задним проходом, не доходя до последнего 2–3 см. С целью обеспечения адекватной визуализации операционного поля при необходимости выполнялась резекция копчика. Мобилизация кисты проводилась под контролем пальца оперирующего хирурга, введенного в задний проход, для предотвращения травмы прямой кишки.
Комбинированный абдомино-перинеальный доступ осуществлялся в 2 этапа: первым этапом проводилась лапароскопическая мобилизация верхнего полюса кисты трансабдоминально, затем пациент переворачивался в прон-позицию для мобилизации нижнего полюса кисты и ее извлечения через промежностный доступ.
Послеоперационное наблюдение
Всем пациентам рекомендовалось контрольное обследование в объеме МРТ ОМТ / ультразвукового исследования органов малого таза (УЗИ ОМТ) с последующей очной либо дистанционной консультацией лечащим врачом.
Статистическая обработка
Результаты были подвергнуты статистической обработке с использованием программы IBM SPSS Statistics v.26 (разработчик – IBM Corporation). Статистическая гипотеза считалось значимой при значении p<0,05. Количественные показатели в исследовании имели распределение, отличное от нормального, поэтому описывались при помощи значений медианы и межквартильного размаха. Для сравнения двух независимых совокупностей использовали U-критерий Манна–Уитни. При сравнении трех и более выборок количественных данных применяли критерий Краскела–Уоллиса. Категориальные данные описывали с указанием абсолютных значений и процентных долей, их сравнение проводили при помощи построения таблиц сопряженности, также оценивали критерий χ2Пирсона, рассчитывали точный критерий Фишера. Был проведен однофакторный и многофакторный анализ с использованием пошаговой логистической регрессии методом исключения.
Результаты исследования и их обсуждение
С 2013 по 2023 гг. были пролечены 102 пациента с клиническим диагнозом «пресакральная киста». После хирургического лечения, по результатам патоморфологического исследования удаленных препаратов, из исследования был исключен 21 пациент с диагнозом «пресакральная солидная опухоль» (рис. 1).
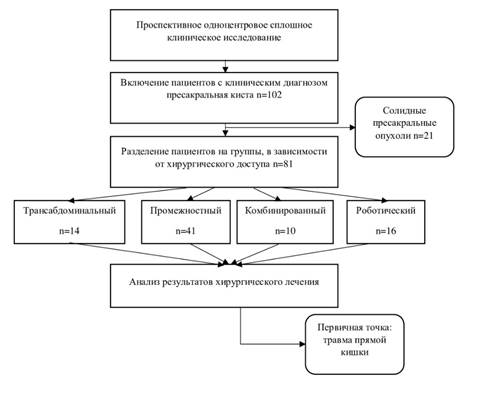
Рис.1. Дизайн исследования
Дооперационные характеристики пациентов, распределенных в зависимости от использованного хирургического доступа, представлены в таблице 1.
Таблица 1
Характеристика пациентов, включенных в исследование
|
Сравниваемые данные |
Распределение в зависимости от хирургического доступа |
p |
|||
|
1. Лапароскопи-ческий n=14 |
2. Промежност-ный n=41 |
3. Комбинирован-ный n=10 |
4. Роботический n=16 |
||
|
Женский пол абс., (%) |
13,0 (92,9) |
33,0 (80,5) |
7,0 (70,0) |
16,0 (100,0) |
0,08 |
|
Возраст, полных лет Me, [IQR] |
33 [28,0–39,0] |
38,0 [30,0–54,0] |
37,0 [21,0–40,0] |
32,0 [28,0–34,0] |
0,11 |
|
ИМТ, кг/м2 Me, [IQR] |
22,17 [20,45–25,10] |
23,59 [21,04–27,60] |
22,17 [20,45–25,10] |
21,58 [19,70–23,47] |
0,23 |
|
Длительность анамнеза, месяцев Me, [IQR] |
14,0 [5,0–25,0] |
12,0 [5,0–35,0] |
16,0 [6,0–24,0] |
9,5 [3,0–30,0] |
0,71 |
|
Рецидивная киста абс., (%) |
1,0 (7,1) |
3,0 (7,3) |
2,0 (20,0) |
2,0 (12,5) |
0,59 |
|
Нагноение кисты абс., (%) |
1,0 (7,1) |
9,0 (22,0) |
2,0 (20,0) |
3,0 (18,8) |
0,72 |
|
Достижимость верхнего полюса при пальпации абс., (%) |
3 (21,4) |
31 (75,6) |
2,0 (20,0) |
3,0 (18,8) |
<0,001* p1–2=0,001* p2–3=0,002* p2–4=0,001* |
|
Объем кисты, см3 Me, [IQR] |
14,48 [6,52–47,70] |
9,04 [4,80–17,55] |
73,25 [38,25–147,00] |
15,59 [8,89–75,56] |
0,01* p2–3=0,02* |
|
CRF (-) абс., (%) n=53 |
3,0 (37,5) |
11,0 (45,8) |
5,0 (71,4) |
6,0 (42,9) |
0,59 |
|
CRD, мм Me, [IQR] n=53 |
94,0 [64,0–109,5] |
65,0 [60,0–77,5] |
66,0 [62,5–74,5] |
73,5 [49,0–80,0] |
0,22 |
|
PPD, мм Me, [IQR] n=53 |
117,0 [115,5–122,0] |
122,5 [115,0–128,5] |
123,0 [111,0–131,0] |
126,0 [120,0–132,0] |
0,47 |
|
CMD, мм Me, [IQR] n=53 |
60,5 [49,5–72,5] |
66,0 [56,5–77,0] |
38,0 [21,5–41,5] |
59,0 [49,0–61,0] |
<0,001* p1–3=0,03* p2–3<0,001* p3–4=0,09 |
|
PUD, мм Me, [IQR] n=53 |
81,0 [71,0–97,0] |
109,5 [88,5–117,5] |
70,0 [53,5–78,5] |
88,0 [66,0–98,0] |
p=0,001* p2–3=0,003* p2–4=0,05 |
|
PCD, мм Me, [IQR] n=53 |
127,0 [114,5–136,0] |
120,5 [107,5–135,5] |
122,0 [105,5–132,0] |
117,5 [106,0–128,0] |
0,77 |
|
ACL (+) абс., (%) n=53 |
3,0 (37,5) |
22,0 (91,7) |
6 (85,7) |
12 (85,7) |
0,01* p1–2=0,008* |
|
IS (+) абс., (%) n=53 |
0,0 (0,0) |
14,0 (58,3) |
4,0 (57,1) |
6,0 (42,9) |
0,02* |
|
LEV (+) абс., (%) n=53 |
2,0 (25,0) |
10,0 (41,7) |
7,0 (100,0) |
11,0 (78,6) |
0,003* p1–4=0,04* p2–4=0,04* |
Примечание. * – различия показателей статистически значимы (p<0,05)
Большинство пролеченных пациентов составляли молодые женщины. У 8 пациентов (9,9%) на основании данных анамнеза был установлен диагноз «рецидивная пресакральная киста». В 15 наблюдениях (18,5%) определялось нагноение кисты (по типу парапроктита либо с формированием свищевого хода). Достичь верхнего полюса кисты при проведении пальцевого ректального исследования чаще удавалось в группе промежностного доступа. Объем кисты был достоверно больше в группе комбинированного доступа. Расстояние CMD было достоверно меньше у пациентов из группы комбинированного доступа, в то время как расстояние PUD было больше в группе промежностного доступа по сравнению с группами комбинированного и роботического доступов. При сравнении групп по частоте ACL (+) было выявлено, что в группе промежностного доступа параметр статистически значимо встречался чаще, чем в группе трансабдоминального доступа. Пациенты из группы роботического доступа достоверно чаще имели параметр LEV (+) по сравнению с группами трансабдоминального и промежностного доступов.
Сравнение результатов хирургического лечения пациентов в зависимости от использованного хирургического доступа представлено в таблице 2.
Таблица 2
Сравнение результатов хирургического лечения пациентов в зависимости от хирургического доступа
|
Сравниваемые данные |
Распределение в зависимости от хирургического доступа |
p |
||||
|
1. Лапароскопи-ческий n=14 |
2. Промежност-ный n=41 |
3. Комбиниро-ванный n=10 |
4. Роботический n=16 |
|||
|
Травма прямой кишки абс., (%) |
1,0 (7,1) |
3,0 (7,3) |
2,0 (20,0) |
4,0 (25,0) |
0,19 |
|
|
Формирование превентивной колостомы абс., (%) |
0,0 (0,0) |
2,0 (4,9) |
2,0 (20,0) |
4,0 (25,0) |
0,09 |
|
|
Вскрытие капсулы кисты абс., (%) |
11,0 (78,6) |
14,0 (34,1) |
7,0 (70,0) |
5,0 (31,3) |
0,01* p1–2=0,02* p1–4=0,03* |
|
|
Длительность операции, мин Me, [IQR] |
195,0 [120,0–240,0] |
75,0 [60,0–120,0] |
240,0 [180,0–300,0] |
180,0 [152,5–240,0] |
<0,001* p1–2=0,001* p2–3<0,001* p2–4<0,001* |
|
|
Объем кровопотери, мл Me, [IQR] |
20,0 [3,0–50,0] |
10,0 [5,0–15,0] |
50,0 [20,0–200,0] |
35,0 [7,5–100,0] |
0,01* p2–3=0,009* p2–4=0,08* |
|
|
Резекция копчика абс., (%) |
0,0 (0,0) |
25,0 (61,0) |
9,0 (90,0) |
2,0 (12,5) |
<0,001* p2–4=0,001* p3–4<0,001* |
|
|
Установка дренажа абс., (%) |
13,0 (92,9) |
38,0 (92,7) |
10,0 (100,0) |
14,0 (87,5) |
0,86 |
|
|
Удаление дренажа, дней Me, [IQR] |
5,0 [4,0–5,0] |
6,0 [4,0–6,0] |
4,5 [4,0–6,0] |
5,0 [5,0–6,0] |
0,49 |
|
|
Длительность госпитализации, дней Me, [IQR] |
7,0 [7,0–7,0] |
11,0 [8,0–14,0] |
12,5 [8,0–21,0] |
7,5 [6,0–10,0] |
0,01* p1–2=0,09 p1–3=0,06 p3–4=0,07 |
|
|
Осложнения, класс по Clavien-Dindo абс., (%) |
I |
1 (7,1) |
7 (17,1) |
1 (10,0) |
1 (6,3) |
>0,90 |
|
IIIB |
1 (7,1) |
2 (4,9) |
1 (10,0) |
1 (6,3) |
||
|
Хирургическая раневая инфекция абс., (%) |
0 (0,0) |
5 (12,2) |
0 (0,0) |
0 (0,0) |
0,33 |
|
|
Рецидив абс., (%) |
1 (7,7) |
2 (5,4) |
0 (0,0) |
0 (0,0) |
0,83 |
|
Примечание. * – различия показателей статистически значимы (p<0,05)
При оценке результатов хирургического лечения пациентов было установлено, что использованный авторами дифференциальный подход к выбору хирургического доступа позволяет минимизировать частоту интраоперационной травмы стенки прямой кишки. Стоит отметить, что в 4 наблюдениях из 10 случаев повреждения прямой кишки не была сформирована превентивная колостома, что привело к несостоятельности кишечных швов в раннем послеоперационном периоде и потребовало выполнения реоперации, выведения петлевой колостомы. Еще в 4 наблюдениях была сформирована превентивная колостома без травмы стенки прямой кишки, поскольку этим пациентам выполнялись симультанные хирургические вмешательства (по поводу колоректального рака). Вскрытие капсулы кисты во время операции статистически значимо чаще встречалось в группе трансабдоминального лапароскопического доступа. Длительность операции была меньше в группе промежностного доступа. Объем кровопотери был достоверно больше у пациентов, прооперированных через комбинированный (Ме=50 мл) и роботический (Ме=35 мл) доступы, чем у пациентов из промежностного доступа (Ме=10 мл). При сравнении продолжительности послеоперационного койко-дня были получены статистически значимые различия, характеризовавшиеся меньшей продолжительностью в группе трансабдоминального доступа по сравнению с промежностным и комбинированным, и большей продолжительностью в группе комбинированного доступа по сравнению с группой роботического доступа. Частота послеоперационных осложнений по группам не различалась. Однако важно подчеркнуть, что все случаи инфекции области хирургического вмешательства (n=5) были зарегистрированы у пациентов из группы промежностного доступа. Из наблюдения выпали 8 пациентов (9,9%). Медиана послеоперационного наблюдения составила 27 месяцев. За этот период было зарегистрировано 3 (3,7%) рецидива заболевания.
С целью выявления факторов риска интраоперационной травмы стенки прямой кишки были проведены однофакторный и многофакторный анализы (табл. 3).
По результатам однофакторного анализа было установлено, что наличие клетчаточной прослойки между капсулой кисты и прямой кишкой снижает риск ее интраоперационной травмы, в то время как увеличение срока анамнеза заболевания и вскрытие просвета кисты во время операции увеличивают риск интраоперационной травмы стенки прямой кишки. По результатам проведенного многофакторного анализа было выявлено, что на увеличение риска достоверно влияет только вскрытие просвета кисты. Стоит отметить, что выявлена тенденция снижения риска травмы прямой кишки при увеличении расстояния CRD.
Таблица 3
Однофакторный и многофакторный анализ факторов риска интраоперационной травмы прямой кишки
|
Факторы риска |
Однофакторный анализ |
Многофакторный анализ |
||
|
ОШ; 95% ДИ |
p |
СОШ; 95% ДИ |
p |
|
|
Длительность анамнеза, месяцев Me, [IQR] |
1,01; 1,00–1,02 |
0,03* |
0,99; 0,94–1,04 |
0,78 |
|
Рецидивная киста |
5,66; 1,12–28,86 |
0,06 |
– |
>0,90 |
|
Объем кисты, см3 Me, [IQR] |
1,004; 0,999–1,010 |
0,13 |
1,01; 0,99–1,02 |
0,15 |
|
CRF (+) абс., (%) n=53 |
0,72; 0,56–0,92 |
0,003* |
– |
>0,90 |
|
CRD, мм Me, [IQR] n=53 |
0,96; 0,91–1,01 |
0,08 |
0,94; 0,87–1,00 |
0,05 |
|
Объем кровопотери, мл Me, [IQR] |
1,005; 1,000–1,010 |
0,05 |
0,98; 0,93–1,03 |
0,38 |
|
Вскрытие просвета кисты абс., (%) |
1,35; 1,12–1,64 |
<0,001* |
18,33; 1,59–212,10 |
0,02* |
* – различия показателей статистически значимы (p<0,05)
Разработанные авторами критерии выбора хирургического доступа позволяют выбрать оптимальный и безопасный оперативный доступ для удаления ПК, поскольку дают возможность минимизировать частоту интраоперационной травмы прямой кишки и частоту послеоперационных осложнений. Частота интраоперационной травмы стенки прямой кишки в нашем исследовании составила 12% по сравнению с 17% в мировой литературе и не зависела от выбранного оперативного доступа [11]. Помимо этого, частота рецидива заболевания в нашем исследовании составила 3,7%, что является меньшим показателем по сравнению с другими исследованиями с сопоставимым объемом выборки [13, 14, 15]. Также стоит отметить, что медиана объема кровопотери, составившая 10 мл, по результатам проведенного авторами исследования также оказалась меньше по сравнению с объемами кровопотери в других работах [11].
На сегодняшний день радикальное удаление кисты в пределах здоровых тканей является золотым стандартом лечения пациентов с пресакральными кистами [4, 5, 7]. Выбор хирургического доступа для иссечения кисты осуществляется на основании данных предоперационной диагностики: учитываются локализация новообразования, его размеры, взаимоотношения с близлежащими анатомическими структурами [5, 6]. Однако на данный момент в мировой литературе отсутствует консенсус относительно критериев выбора оперативного доступа [6].
Наиболее часто используемым хирургическим доступом для удаления пресакральных кист является парасакральный (промежностный) [6, 7, 8]. А.М. Коплатадзе в качестве достоинств этого доступа обозначал: отсутствие необходимости вскрытия брюшной полости, относительно малую травматичность по сравнению с лапаротомным доступом, снижение рисков повреждения прямой кишки, магистральных сосудов и элементов вегетативной нервной системы таза [8]. Однако промежностный доступ имеет ряд недостатков, основным из которых является более высокая частота послеоперационных осложнений [11]. В своей работе A. Sakr и соавт. сообщают о 72,7% пациентов с инфекцией области хирургического вмешательства (ИОХВ) в группе промежностного доступа [11]. По результатам проведенного авторами исследования также отмечается преобладание ИОХВ у пациентов, прооперированных через промежностный доступ (12,2%).
В связи с развитием медицинских технологий все большую популярность набирают малоинвазивные методики хирургического лечения [4, 9]. В литературе описаны отдельные клинические случаи, серии наблюдений и ретроспективные исследования, описывающие успешные случаи хирургического лечения пациентов с ПК с использованием лапароскопического трансабдоминального доступа [1, 9, 10]. Операции по поводу ПК с применением лапароскопических технологий характеризуются малоинвазивностью, оптимальной визуализацией операционного поля и важных анатомических структур, что позволяет избежать их повреждения [4, 9]. Кроме того, лапароскопический доступ характеризуется меньшими объемами кровопотери, продолжительностью госпитализации и более быстрым периодом восстановления и возвращения пациента к труду [1, 9]. Тем не менее, применение лапароскопического доступа затруднительно при низкой локализации пресакральных кист [9, 11].
Помимо лапароскопических технологий, для удаления ПК все чаще используются и робот-ассистированные хирургические системы [12]. Роботический доступ характеризуется всеми преимуществами лапароскопического, однако, помимо этого, позволяет удалять низко локализованные кисты, а также производить диссекцию в анатомически узком тазу и у больных с ожирением [12]. Важно отметить, что у пациентов, оперированных с использованием роботического доступа, продолжительность послеоперационного койко-дня была достоверно ниже, чем у пациентов в группе комбинированного доступа.
Наиболее часто используемым критерием выбора хирургического доступа является скелетотопия пресакральной кисты по отношению к S4 крестцовому позвонку: если киста локализуется выше S4, используется трансабдоминальный доступ, если киста находится на уровне или ниже S4, применяется промежностный доступ, в случае распространения кисты краниально выше S4, а каудально ниже S4 прибегают к комбинированному доступу [13]. X.H. Gao и соавт. в своей работе предлагают оптимизировать этот критерий, проведя воображаемую линию от нижнего края S3 до нижнего края лобковой кости на сагиттальном срезе снимка МРТ ОМТ; кисты, локализованные выше этой линии, следует удалять лапароскопически, кисты ниже линии – через промежностный доступ [14]. Изолированное использование костных ориентиров имеет ряд недостатков, в том числе: отсутствие объективности при различных вариантах анатомии малого таза и его костных структур, многокамерной структуре кисты, интимном прилежании кисты к стенке прямой кишки.
T. Bardol и соавт. также подчеркивают существующую проблему выбора оперативного доступа [6]. В качестве критерия выбора доступа авторы предлагают уровень S5: если киста расположена выше этого уровня, то следует использовать лапароскопический трансабдоминальный доступ, если же киста локализована ниже S5, предлагаются паракокцигеальный (промежностный) доступ либо изолированное трансанальное иссечение [6].
Заключение
Разработанный авторами дифференцированный подход к хирургическому лечению пациентов с пресакральными кистами позволяет выбрать оптимальный и безопасный хирургической доступ в каждом конкретном случае, поскольку дает возможность минимизировать интраоперационные травмы прямой кишки, частоту рецидива заболевания, частоту послеоперационных осложнений и не приводит к клинически значимому увеличению объема кровопотери. Достоверным фактором риска травмы стенки прямой кишки является вскрытие просвета кисты во время операции. Стоит отметить, что роботический доступ может рассматриваться как альтернатива комбинированному, поскольку характеризуется меньшей операционной травмой и более быстрым сроком восстановления пациентов после операции.



