Введение
Недержание мочи при напряжении у женщин требует продолжения поиска методов патогенетического воздействия на само заболевание и на сопряженные с ним осложнения [1–3]. Среди этих осложнений, возможно, наибольшую опасность в прогностическом плане таит в себе хронический психоэмоциональный стресс, индуцируемый негативными эмоциональными переживаниями пациенток [2, 3]. Обсервационные работы показывают связь недержания мочи при напряжении и стресс-ассоциированных патологий (в частности, тревоги и депрессии) [1]. Более того, предполагается и наличие противоположно направленного эффекта – усугубления ряда патогенетических механизмов недержания стрессом. Медиаторы стресса, выделяемые гиперактивированными стресс-реализующими системами (в частности, кортизол, продуцируемый гипоталамо-гипофизарно-надпочечниковой системой (ГГНС)), оказывают губительное влияние едва ли не на все системы организма, резко потенцируя патогенные механизмы сердечно-сосудистых, эндокринных, желудочно-кишечных и прочих заболеваний. Среди мишеней этих гормонов находятся также нервные центры, проводящие пути и исполнительные органы, обеспечивающие мочеиспускание. Работа всех данных структур нарушается при длительном воздействии медиаторов стресса [2, 3].
Таким образом, стресс-лимитирующие компоненты должны быть включены в комплексное лечение недержания мочи при напряжении (что, впрочем, актуально и для других типов недержания мочи). Данные мероприятия потенциально могут преследовать две цели: благоприятное воздействие на патогенез собственно недержания и снижение негативного бремени стресса на остальные системы организма (что потенциально должно улучшить долгосрочные прогнозы пациенток).
В предшествующих работах было показано, что транскраниальная электростимуляция (ТЭС-терапия) обладает антистрессорным потенциалом, так как активирует эндогенную выработку бета-эндорфина, дофамина, серотонина [4–6]. С этим, как считается, связаны разнообразные плейотропные эффекты данного метода. Важно, что среди них есть и те, что потенциально могут повлиять на механизмы собственно недержания (в дополнение к антистрессорному эффекту), а именно: ингибирование висцеральной гиперчувствительности исполнительных органов мочеполовой системы, ингибирование воспаления, модуляция работы центров мочеиспускания и др. [2]. Таким образом, добавление ТЭС-терапии к стандартному лечению недержания мочи при напряжении может быть изучено в двух взаимосвязанных аспектах – оценки выраженности стресс-лимитирующего эффекта и клинических проявлений собственно заболевания.
Цель исследования – оценить выраженность гиперактивации гипоталамо-гипофизарно-надпочечниковой системы путем измерения концентрации кортизола крови и воздействие транскраниальной электростимуляции на данную концентрацию и клиническую динамику проявлений заболевания, негативно влияющих на качество жизни у пациенток с недержанием мочи при напряжении.
Материалы и методы исследования
Работа выполнялась в Кубанском государственном медицинском университете и городской поликлинике № 12 г. Краснодара в апреле и мае 2024 г.
Пациентки (n = 20) в возрасте от 40 до 50 лет с недержанием мочи при напряжении, давшие добровольное информированное согласие, были включены в исследование. Не включались пациентки с органическими тазовыми аномалиями, тяжелыми кардиологическими и эндокринными нозологиями и показаниями к оперативному вмешательству для лечения недержания. Также в работе добровольно и информированно участвовали женщины-добровольцы (n = 5) того же возраста без недержания мочи при напряжении, тяжелых кардиологических и эндокринных нозологий.
Были сформированы 2 группы пациенток: первая из них (n = 10) получала только стандартную медикаментозную терапию заболевания – это группа сравнения. Другая группа (n = 10) помимо аналогичного стандартного лечения получала транскраниальную электростимуляцию – это группа ТЭС-терапии. Параметры этой терапии описаны в таблице.
Параметры транскраниальной стимуляции
|
Параметр |
Описание |
|
Длительность терапии |
30 суток |
|
Общее количество сеансов |
60 сеансов |
|
Частота сеансов |
2 сеанса в сутки |
|
Длительность одного сеанса |
Для 1-го сеанса: 15 минут; для остальных сеансов: 45 минут |
|
Положение электродов |
Фронто-мастоидальное |
|
Режим |
Биполярный импульсный |
|
Длительность импульса |
3,75 ± 0,25 мс |
|
Сила тока |
До 3мА |
Оценка активации ГГНС производилась посредством измерения концентрации кортизола крови у всех пациенток в одно время суток. Динамика этого показателя оценивалась в двух временных точках: до начала лечения и на 30 день лечения. У здоровых добровольцев производилась однократная оценка в то же время суток. Концентрация кортизола оценивалась при помощи хемилюминесцентного иммуноферментного анализа.
Оценка выраженности клинических проявлений, оказывающих влияние на качество жизни пациенток, производилась посредством анкеты IIQ-7 (Incontinence Impact Questionnaire).
Динамика данного показателя также оценивалась дважды в тех же временных точках.
Для анализа данных статистическим методом применялись среда R (R Foundation for Statistical Computing, Vienna, Austria, версия 4.3.2) и ресурс SRPlot (https://www.bioinformatics.com.cn/srplot) [7]. Приводимые ниже данные описаны как медиана, 25-й и 75-й квартили (Me(Q1–Q3)). Метод Бруннера – Мюнцеля применялся для сравнения групп. Дельта Клиффа с 95 % доверительным интервалом (ДИ) применялась для выражения размера эффекта [8]. Отличия принимались в качестве значимых статистически, если p было равно или не превышало 0,05.
Независимый этический комитет при Кубанском государственном медицинском университете одобрил протокол исследования (протокол № 66 от 28.09.2018).
Результаты исследования и их обсуждение
Показатели до лечения представлены на рис. 1. Как можно видеть, концентрация кортизола до начала лечения в обеих группах была сопоставима: 600,25 (574,4–651,5) нмоль/л в группе сравнения и 592,65 (579,1–688,4) нмоль/л в группе ТЭС-терапии (p = 0,89, дельта Клиффа составила -0.04 (95 % ДИ от -0,49 до 0,43)). В обеих группах уровень кортизола почти в 6 раз превышал показатель здоровых добровольцев (100,5 (81,2–153,6) нмоль/л). Это свидетельствует о чрезмерной активации ГГНС – одной из ключевых стресс-реализующих систем. Данная находка не является неожиданной, ведь недержание мочи (любого типа) представляет собой мощный и длительно действующий стрессор, модифицирующий качество жизни пациенток. Хронический психоэмоциональный стресс негативно воздействует на самые разные органы и системы и является фактором риска смертельно опасных заболеваний (в первую очередь сердечно-сосудистых). Кроме того, накапливаются данные о патогенетической взаимосвязи стресса и недержания мочи (разных типов). Медиаторы стресса воздействуют на нервную систему (включая центры регуляции мочеиспускания) и на периферические исполнительные органы [2, 3]. Таким образом, хронический психоэмоциональный стресс, во-первых, грозит развитием опасных заболеваний и, во-вторых, модифицирует патогенез недержания мочи.
Количество баллов по анкете IIQ-7 (рис. 1) составило 20 (18–21) как в группе сравнения, так и в группе ТЭС-терапии (p = 0,88, дельта Клиффа: -0,04 (95 % ДИ от -0,51 до 0,45)). Таким образом, клинически проявления заболевания до лечения были выражены и негативно влияли на качество жизни пациенток.
После 30 дней лечения концентрация кортизола в группе сравнения составила 337,4 (300,7–401,5) нмоль/л, снизившись, таким образом, на 43,8 % от исходного уровня. Данная концентрация была все еще значительно выше, чем у здоровых добровольцев. Таким образом, на фоне стандартного лечения наблюдается положительная динамика активации гипоталамо-гипофизарно-надпочечниковой оси, однако следует дополнять стандартное лечение стресс-лимитирующими мероприятиями. В группе ТЭС-терапии данная концентрация составила 283,7 (232,5–319,4) нмоль/л, снизившись на 52,1 % от исходного уровня, однако не достигала уровня здоровых добровольцев.
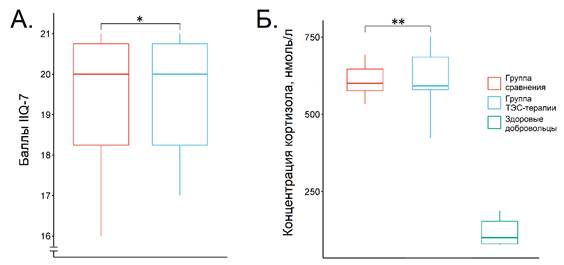
Рис. 1. Изучаемые показатели до начала лечения. А – баллы по анкете IIQ-7; Б – концентрация кортизола. * – p = 0,88, ** – p = 0,89
На рис. 2 представлены изучавшиеся показатели в обеих группах на 30 день лечения. Как можно видеть, ТЭС-терапия обеспечивала более выраженную, чем в группе сравнения, нормализацию концентрации кортизола (на 15,9 % (p = 0,003, дельта Клиффа составила 0,66 (95 % ДИ от 0,16 до 0,89))). Это показывает дополнительный стресс-лимитирующий эффект, которым обладает транскраниальная электростимуляция. Стресс-лимитирующий и смежные с ним плейотропные эффекты ТЭС-терапии были изучены в животном эксперименте и в клинических работах, посвященных другим медико-биологическим проблемам [5, 9, 10]. Данный эффект предположительно связан с активацией антиноцицептивных и антистрессорных регионов мозга. Среди них опиоидергическая система (активация синтеза бета-эндорфина в мозге и, возможно, усиление внемозговой продукции данного пептида), серотонинергическая, дофаминергическая [4, 6]. Следует отметить, что названные системы и медиаторы, в первую очередь бета-эндорфин, обладают системными эффектами, выходящими за рамки классических функций нейротрансмиттеров. Так, бета-эндорфин обладает многочисленными дистантными, гормоноподобными эффектами, связанными с его способностью регулировать метаболизм и иммунную систему. Эти же эффекты характерны для ТЭС-терапии, чем отчасти можно объяснить влияние метода на клинические параметры, о которых будет идти речь далее [11, 12].
Количество баллов по анкете IIQ-7 в группе сравнения на 30 день (рис. 2) составило 10 (9–11), то есть полноценной коррекции в указанном временном промежутке достигнуть не удавалось. В группе ТЭС-терапии снижение данного показателя было более заметным (4 (3–4)) в сравнении с другой группой (p < 0,001, дельта Клиффа: 1 (95 % ДИ от 0,97 до 1).
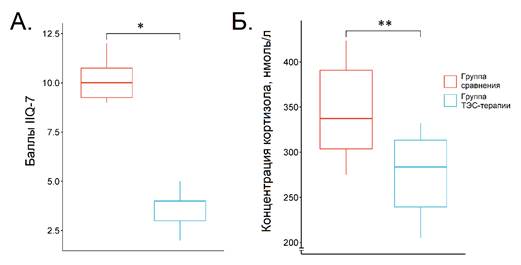
Рис. 2. Изучаемые показатели после 30-дневного лечения. А – баллы по анкете IIQ-7; Б – концентрация кортизола. * – p < 0,001, ** – p = 0,003
По мнению авторов, описанное здесь стресс-лимитирующее воздействие патогенетически связано с нормализацией функций регуляторных и исполнительных структур, участвующих в мочеиспускании. Стресс-реализующие центры нервной системы структурно и функционально тесно связаны с центрами мочеиспускания. Например, нейроны в ядре Баррингтона способны производить (как и гипоталамические центры стресса) кортикотропный рилизинг-гормон (КТРГ) и экспрессируют рецепторы данного гормона, активно стимулируемые при гиперактивации ГГНС [2, 3]. Негативное влияние стресса на мочеиспускание показано в животных экспериментах. Например, ежедневного воздействия аверсивных неизбегаемых стимулов (прерывистый электрический импульс) в течение 15 минут в день на протяжении 7 дней достаточно для формирования висцемоторной дисфункции и гиперчувствительности мочевого пузыря [3]. Негативное влияние оказывает и психоэмоциональный стресс, например стресс социального поражения. Введение урокортина (агониста КТРГ-рецептора 2 типа) оказывает аналогичный эффект [2, 3]. Напротив, фармакологическая блокада рецепторов кортикотропного рилизинг-гормона смягчает данные последствия [3]. Подобные результаты согласуются с выводами обсервационных исследований, например, обнаруживающих, ассоциацию между посттравматическим стрессовым расстройством и возникновением недержания [13]. Эти явления объясняются не только воздействием хронического стресса на головной мозг, но также на спинномозговые центры, периферические нервы и исполнительные структуры. Так, например, стресс-индуцируемая гиперсенситизация висцеральных нервов может быть опосредована усилением экспрессии каналов с транзиторным рецепторным потенциалом (TRP), которые рассматриваются в качестве потенциальных мишеней фармакотерапии недержания мочи [3]. Помимо нейронов длительному воздействию гормонов стресса подвергаются эпителиоциты, миоциты, фибробласты, миофибробласты, что ведет к модификации их профиля экспрессии, метаболическим перестройкам и в конечном итоге к дисфункциональному ремоделированию органов [14].
Отдельную важную роль в патогенезе заболевания играет воспаление, связанное со стрессом и гиперсенситизацией многочисленными положительными обратными связями. У животных, подвергнутых комбинированному стрессу в течение 7 дней, обнаруживаются провоспалительные биохимические (усиление продукции цитокинов, фактора роста нервов, нейропептидов, гистамина, миелопероксидазы и т.д.) и гистопатологические изменения стенки мочевого пузыря (стаз, лейкоцитарная инфильтрация, повышение числа и активности тучных клеток, усиление ангиогенеза) [3]. В свою очередь, воспаление стимулирует гипоталамо-гипофизарно-надпочечниковую систему, замыкая петлю обратной связи. Еще одним важным элементом многокомпонентного патогенеза недержания является дисфункция уробиома, состав и функция которого модифицируются психоэмоциональным стрессом и воспалением. Эти взаимосвязи, в частности, изучены в контексте гиперактивного мочевого пузыря [15].
Таким образом, хронический психоэмоциональный стресс оказывает многообразное негативное воздействие на органы и системы. Это явление нельзя считать исключительно последствием недержания, напротив, стресс сам становится важным звеном патогенеза заболевания, замыкая петлю положительной обратной связи и препятствуя полноценному лечению.
Заключение
У пациенток с недержанием мочи при напряжении наблюдалась гиперактивация стресс-реализующей гипоталамо-гипофизарно-надпочечниковой системы, что отражалось в почти шестикратном увеличении концентрации кортизола крови по сравнению с добровольцами – здоровыми женщинами. Транскраниальная электростимуляция в комбинации со стандартным лечением более выраженно, чем только стандартная терапия, воздействовала на концентрацию кортизола крови и на клинические параметры, оказывающие влияние на качество жизни у пациенток с недержанием мочи при напряжении. Этот результат свидетельствует, во-первых, о целесообразности включения стресс-лимитирующих мероприятий (например, психотерапии и фармакотерапии) в стратегию лечения данного заболевания и, во-вторых, о возможности дальнейшего изучения ТЭС-терапии в данном контексте.



