Введение
Предполагаемая роль синдрома выброса цитокинов в развитии тяжелых поражений легких и других органов при новой коронавирусной инфекции (COVID-19) послужила основой для исследования эффективности различных антицитокиновых средств, включая ингибиторы интерлейкина-6 (IL-6) (Тоцилизумаб, Сарилумаб, Олокизумаб), интерлейкина-1 (IL-1) (Канакинумаб, Анакинра) и янус-киназ (Тофацитиниб, Барицитиниб) [1, 2]. Несмотря на то что ни один из указанных препаратов не получил официальной регистрации для лечения COVID-19, во многих странах ингибиторы IL-6 применяются в клинической практике у пациентов с тяжелыми формами заболевания [3, 4]. В связи с этим представляет научный интерес анализ уровней провоспалительных (IL-6, фактор некроза опухоли-α (TNF-α)) и противовоспалительных (интерлейкин-10 (IL-10)) цитокинов в сыворотке крови пациентов с пневмонией, связанной с новой коронавирусной инфекцией, при поступлении в стационар, а также их изменения в динамике в зависимости от применяемого антицитокинового препарата.
Цель исследования: провести изучение динамики содержания цитокинов IL-6, IL-10, TNF-α в сыворотке крови у пациентов с пневмонией, ассоциированной с новой коронавирусной инфекцией, на фоне применения трех антицитокиновых препаратов.
Материалы и методы исследования
Все пациенты проходили лечение в инфекционном стационаре на базе ГБУЗ АО «АМОКБ» (г. Астрахань) в период январь – август 2021 г. Критериями включения в исследование являлись: подписанное информированное согласие; возраст старше 18 лет; идентификация возбудителя новой коронавирусной инфекции (положительный результат мазков со слизистой поверхности носовой и ротовой полости на наличие вирусной РНК SARS-CoV-2 методом полимеразной цепной реакции (ПЦР)); использование одного из ингибиторов/блокаторов интерлейкина-6 (Тоцилизумаб, Сарилумаб, Олокизумаб) в составе терапии новой коронавирусной инфекции.
Пациенты, включенные в исследование, с упреждающей целью (купирование цитокинового шторма) получали один из ингибиторов/блокаторов интерлейкина-6: Тоцилизумаб (Актемра®, F.Hoffmann-La Roche, Ltd., Швейцария), Сарилумаб (Кевзара®, Sanofi, Франция), Олокизумаб (Артлегиа®, Р-Фарм АО, Россия). Препараты были назначены пациентам на 2–4-е сутки от момента госпитализации, в соответствии с действующими на момент проведения исследования Временными методическими рекомендациями по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19) [5, 6]. Критерии исключения: отсутствие подписанного информированного согласия; отрицательный результат на наличие вирусной РНК SARS-CoV-2 методом ПЦР; наличие противопоказаний к назначению одного из ингибиторов/блокаторов интерлейкина-6 (Тоцилизумаб, Сарилумаб, Олокизумаб) в составе терапии новой коронавирусной инфекции; беременные, роженицы.
В соответствии с полученным препаратом были сформированы 3 группы: группа № 1 (Тоцилизумаб) – 65 пациентов, группа № 2 (Сарилумаб) – 26 пациентов, группа № 3 (Олокизумаб) – 56 пациентов. Группы были сопоставимы по возрасту, полу и клинико-лабораторным характеристикам. Забор крови для определения уровня цитокинов в динамике производился при поступлении в стационар, на 1-е сутки после введения препарата и на 10-й день пребывания пациента в стационаре. Изучение содержания уровня цитокинов в сыворотке крови проводили с помощью наборов для количественного определения IL-6, IL-10, TNF-α методом иммуноферментного анализа (ИФА).
Статистическая обработка данных была выполнена с использованием программы IBM SPSS Statistics 22 (Chicago, USA). Для проверки нормальности распределения количественных переменных применялись частотные гистограммы, а также критерии Шапиро–Уилка и Колмогорова–Смирнова. При нормальном распределении переменные представляются в виде среднего значения и среднеквадратичного отклонения; в случае ненормального распределения – в виде медианы (Ме) и межквартильного интервала (Q25-Q75). Сравнение групп по количественным признакам проводили с использованием критерия Манна–Уитни. Различия считались статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
У пациентов с пневмонией, ассоциированной с COVID-19, при госпитализации в стационар медианное значение IL-6 составило 68,3 [42,5; 85,2] пг/мл, для IL-10 – 53,3 [37,2; 74,7] пг/мл и для TNF-α – 21,3 [18,7; 24,5] пг/мл соответственно.
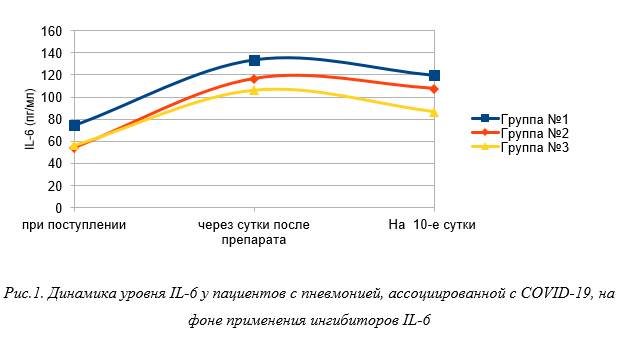
Как видно из рисунка 1, уровень IL-6 при поступлении в группе № 1 был равен 74,5 [54,3; 94,6] пг/мл, с последующим увеличением до 133,6 [99,8; 167,3] пг/мл через сутки после введения препарата. На 10-й день после применения антицитокинового препарата отмечено снижение уровня IL-6 до 119,6 пг/мл [90,7; 148,4] (p<0,05). В группе № 2 уровень IL-6 при поступлении составлял 54,4 [38,9; 69,8] пг/мл, с последующим статистически значимым увеличением до 116,7 [77,8; 125,5] пг/мл через сутки после введения ингибитора IL-6. На 10-й день после применения антицитокинового препарата отмечено снижение уровня IL-6 до 107,7 пг/мл [81,7; 118,3] (p>0,05). В группе № 3 уровень IL-6 при поступлении был равен 56,5 [41,9; 71] пг/мл, с последующим увеличением до 106,1 [74,6; 137,5] пг/мл через сутки после введения препарата. На 10-й день после применения ингибитора IL-6 зафиксировано снижение уровня IL-6 до 86,8 пг/мл [63,5; 124,7] (p<0,05).
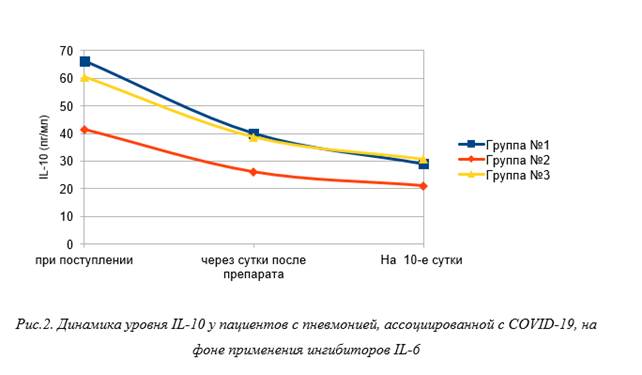
Как следует из рисунка 2, уровень IL-10 при поступлении в группе № 1 был равен 66,3 [55,4; 77,1] пг/мл, с последующим снижением до 40,1 [28,5; 51,6] пг/мл через 1 сутки после введения препарата. На 10-й день наблюдения отмечено продолжение снижение уровня IL-10 до 29,1 [21,4; 36,7] пг/мл (p<0,05). В группе № 2 уровень IL-10 при поступлении был равен 41,5 [26,8; 56,1] пг/мл, с последующим статистически значимым снижением до 26,1 [14,8; 37,3] пг/мл через сутки после введения препарата. На 10-й день наблюдения сохранялось продолжение снижения уровня IL-10 до 21,1 [13,5; 28,6] пг/мл (p<0,05). Уровень IL-10 при поступлении у пациентов группы № 3 был равен 60,4 [46,5; 74,2] пг/мл с последующим снижением до 38,7 [29,1; 48,2] пг/мл через сутки после введения препарата. На 10-й день наблюдения отмечено продолжение снижения уровня IL-10 до 30,7 [23,7; 37,6] пг/мл (p<0,05).
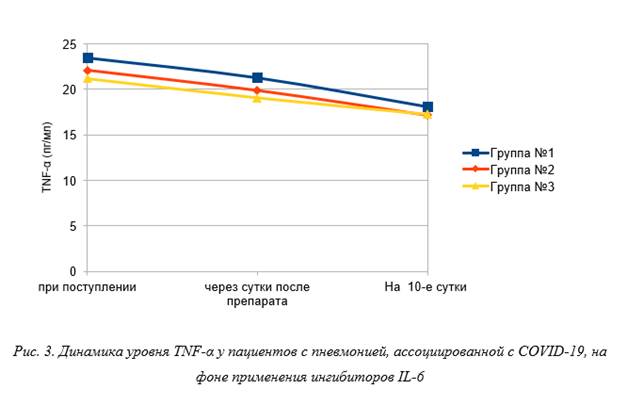
Как показано на рисунке 3, уровень TNF-α у пациентов из группы № 1 при поступлении был равен 23,5 [21,7; 25] пг/мл. Через сутки после введения препарата наблюдалось статистически значимое снижение уровня TNF-α до 21,3 [19,5; 23,0] пг/мл. На 10-й день наблюдения также отмечено продолжение снижения уровня TNF-α до 18,1 [16,6; 19,3] пг/мл (p<0,05). В группе № 2 уровень TNF-α при поступлении составлял 22,1 [19,8; 24,1] пг/мл. Через 1 сутки после введения ингибитора IL-6 зафиксировано статистически значимое снижение уровня TNF-α до 19,9 [18,1; 21,6] пг/мл. На 10-й день наблюдения также отмечено статистически значимое продолжение снижения уровня TNF-α до 17,2 [15,9; 18,2] пг/мл (p<0,05). В группе № 3 уровень TNF-α при поступлении был равен 21,2 [18,7; 23,6] пг/мл. Через 1 сутки после введения антицитокинового препарата зафиксировано статистически значимое снижение уровня TNF-α до 19,1 [17,6; 20,5] пг/мл. На 10-й день наблюдения также отмечено продолжение снижения уровня TNF-α до 17,3 [16,4; 18,1] пг/мл, но без достоверного подтверждения (p=0,07).
Цитокины представляют собой ключевые иммуномодулирующие медиаторы, участвующие в различных аутокринных, паракринных и эндокринных сигнальных механизмах, которые определяют характер и интенсивность воспалительных и иммунных реакций в организме. IL-6 относится к провоспалительным цитокинам и вырабатывается различными клетками, включая Т-лимфоциты, моноциты и эндотелиальные клетки. Он активирует синтез острофазовых белков, таких как гаптоглобин и С-реактивный белок, которые, в свою очередь, способствуют усилению воспалительного процесса, регулируют иммунный ответ и способствуют активации лимфоцитов, инициирующих выработку необходимых на данный момент иммуноглобулинов и антител. TNF-α является одним из основных многофункциональных провоспалительных цитокинов, который преимущественно синтезируется макрофагами. В нормальных физиологических условиях он регулирует широкий спектр процессов, включая обмен липидов, свертывание крови, деление, созревание и апоптоз клеток. Уровень TNF-α может увеличиваться при различных аутоиммунных, ревматологических и инфекционных заболеваниях, а также при наличии злокачественных опухолей. IL-10 обладает выраженными противовоспалительными свойствами и играет значительную роль в контроле воспалительного процесса, предотвращая тем самым чрезмерное повреждение тканей. Его действие снижает синтез других воспалительных цитокинов. Дисрегуляция IL-10 ассоциируется с развитием аутоиммунных и инфекционных заболеваний, а также с воспалением эндотелия сосудов, что может ухудшать течение сахарного диабета, сердечно-сосудистой патологии и др. Для обеспечения нормальной жизнедеятельности организму необходимо поддержание гомеостатического баланса уровней оппозиционных цитокиновых пулов, поскольку нарушение гомеостаза цитокинов может нанести значительный вред организму [7, 8, 9]. Во время пандемии было установлено, что при COVID-19 отмечается сбой иммунной регуляции, который в некоторых случаях может приводить к развитию опасного для жизни состояния, вызванного неконтролируемой секрецией провоспалительных цитокинов в больших количествах, – цитокиновому шторму. В ряде проведенных исследований было установлено, что IL‐1, IL‐6, IL‐8, TNF-α, GM‐CSF и IFN‐γ являются наиболее важными провоспалительными цитокинами, которые в избыточном количестве выделяются у пациентов при тяжелом течении заболевания [10, 11]. Учитывая важную роль IL-6 как ключевого фактора, влияющего на воспалительный статус при COVID-19, в терапии тяжелых форм стали широко использовать ингибиторы IL-6 в виде моноклональных антител, нацеленных на IL-6 или на соответствующий рецептор к нему [3, 4].
При изучении особенностей динамики про- и противовоспалительных цитокинов (TNF-α, IL-10 и IL-6) у пациентов с пневмонией, ассоциированной с COVID-19, авторами было обнаружено, что все три рассматриваемых цитокина имеют схожие профили изменения своего содержания в сыворотке крови независимо от использованного препарата (Тоцилизумаб, Сарилумаб, Олокизумаб). Через 1 сутки после введения одного из антицитокиновых препаратов отмечалось увеличение уровня IL-6, в то время как у IL-10 и TNF-α было зафиксировано снижение уровней. На 10-й день наблюдения все три показателя демонстрировали тенденцию к снижению.
Таким образом, изучая изменения показателей цитокинов на фоне применения антицитокиновых препаратов, авторы наблюдают временное, первоначальное повышение уровня IL-6, что может быть обусловлено тем фактом, что данные препараты блокируют как растворимые, так и мембранные рецепторы к IL-6 (Тоцилизумаб, Сарилумаб), а также непосредственно сам IL-6 (Олокизумаб), препятствуя его дальнейшему метаболизму, и, как следствие, приводят к увеличению уровня IL-6 в сыворотке крови. Наблюдение авторов согласуется с наблюдениями других отечественных исследователей, где также было продемонстрировано схожее проявление дисбаланса цитокинов на фоне применения антицитокинового препарата [12, 13]. Также нужно отметить, что по результатам некоторых работ было показано, что повышенное содержание IL-6 может наблюдаться в течение длительного времени после введения антицитокинового препарата [14].
Выводы
1. IL-6, IL-10, TNF-α имеют схожие профили изменения концентрации независимо от использованного ингибитора IL-6 (Тоцилизумаба, Сарилумаба, Олокизумаба).
2. При тяжелых формах COVID-19 отмечается дисбаланс оппозиционных цитокиновых пулов, при этом Тоцилизумаб, Сарилумаб и Олокизумаб оказывают аналогичное влияние на цитокиновый профиль, что позволяет с одинаковой эффективностью применять эти препараты у пациентов с пневмонией, ассоциированной с COVID-19.



