Хронический эндометрит (ХЭ) – воспаление эндометрия, вызываемое различными группами микроорганизмов: Enterobacteriaceae, Enterococcus, Streptococcus, Staphylococcus, Mycoplasma и Ureaplasma, Clamidia trachomatis, изредка – вирусом простого герпеса, цитомегаловирусом, вирусом папилломы человека, Actinomyces israelii – у женщин, длительно применяющих внутриматочные механические средства, в последнем случае возможно развитие изменений в эндометрии по типу необычной реакции на инородное тело [1, 2]. В эндометрии при ХЭ развивается комплекс морфофункциональных изменений, имеет место нарушение нормальной циклической трансформации ткани эндометрия и его рецептивности, что играет особенно важную роль в период «окна имплантации».
Морфологическая диагностика ХЭ в настоящее время остается актуальной проблемой, этот диагноз часто встречается в группе женщин репродуктивного возраста [1]. Распространенность ХЭ составляет 2,8–56,8% у женщин с бесплодием, 14–67,5% – при привычном невынашивании при имплантации, 9,3–67,6% – при привычном невынашивании беременности [3]. ХЭ нередко остается недиагностированным, а гистологическое и иммуногистохимическое исследования эндометрия служат надежными методами его выявления. В настоящее время золотым стандартом является иммуногистохимическое исследование эндометрия с верификацией СD138+ плазматических клеток (синдекана-1) [4, 5, 6]. К сожалению, этот метод не всегда является специфическим, поскольку СD138- позитивные плазматические клетки в эндометрии могут встречаться и в норме, при наличии подслизистой лейомиомы матки или полипов эндометрия, а мнения о количестве плазмоцитов в эндометрии, позволяющих верифицировать диагноз ХЭ, разделились [7, 8, 9]. Эффекты синдекана-1 у больных ХЭ недостаточно изучены, международные критерии для его диагностики отсутствуют, количество плазматических клеток, необходимое для постановки диагноза, до сих пор не определено, имеющиеся данные остаются ограниченными, а проблема диагностики ХЭ заслуживает дальнейшего изучения в большой когорте [5].
При типичной форме ХЭ выявляется ряд гистологических изменений в эндометрии: инфильтрация лимфоцитами, плазмоцитами и гранулоцитами, склеротические изменения сосудов, нарушение пролиферации железистого эпителия, появление лимфоидных фолликулов в поверхностном отделе эндометрия. В стромальном компартменте эндометрия выявляются отек и фибробластоподобные клетки, которые создают картину типа «водоворота» вокруг маточных желез [2].
Несмотря на имеющиеся противоречия в критериях диагностики, в настоящее время иммуногистохимическое исследование эндометрия при ХЭ является необходимым этапом диагностики [5]. Причинно-следственная связь между ХЭ и репродукцией человека в настоящее время остается неопределенной, а создание универсальных диагностических критериев, объединяющих гистопатологию, гистероскопию, анализ микробиома, является актуальной задачей [6].
Цель исследования – изучение особенностей экспрессии иммуногистохимических маркеров CD3 и CD79-альфа, характерных для Т-клеток и популяции B-клеток и плазмоцитов, в различных структурных компонентах эндометрия пайпель-биоптатов для верификации ХЭ.
Материал и методы исследования. Изученная выборка включала образцы ткани эндометрия, полученные с помощью пайпель-биопсии у 50 пациентов женского пола Калининградской области за период 2016–2021 гг., направленные для диагностики медицинскими учреждениями г. Калининграда. Показания к пайпель-биопсии определялись врачами-гинекологами направивших учреждений, выполнявшими забор материала эндометрия для исследования. Ретроспективное исследование выполнено в лаборатории иммуногистохимической и патологоанатомической диагностики БФУ им. И. Канта.
Оценивали возрастную структуру исследованной выборки, данные акушерско-гинекологического анамнеза, наличие генитальных и экстрагенитальных патологий, присутствие гистологических признаков ХЭ, наличие клеточных инфильтратов в эндометрии, выявляемых с помощью гистологического и иммуногистохимического исследования.
Характеристики исследованной выборки: 1) средний возраст женщин – 33 года (max – 43 года, min – 23 года), продолжительность менструального цикла (МЦ) – 28,7±1,93 дня (max – 34, min – 24), длительность менструации – 4,9 дня ±1,02 (max – 8 дней, min – 3 дня); 2) наличие гинекологических заболеваний – полипы эндометрия (10%), инфекционно-воспалительные заболевания – сальпингоофорит, уреаплазмоз (10%), эрозия шейки матки (6%), дермоидная киста яичника (6%), лейомиома матки (4%), синдром поликистозных яичников (2%); 3) экстрагенитальная патология: болезни щитовидной железы – тиреоидит, зоб, узлы щитовидной железы (14%), молочных желез – фиброаденомы, фиброзно-кистозные изменения, кисты (12%), эндокринная патология – адреногенитальный синдром, гиперпролактинемия (8%), патология иммунной системы – системная красная волчанка, антифосфолипидный синдром (8%), другие заболевания – гастрит, гепатит С (10%).
Критерии включения в исследование: патологоанатомический диагноз – хронический эндометрит, клинические диагнозы при направлении на исследование – бесплодие, патология I триместра беременности – аборты, раннее невынашивание беременности, попытки ЭКО без эффекта. Критерии исключения из исследования: злокачественные новообразования и предопухолевая патология женской репродуктивной системы.
Пайпель-биоптаты были получены в направивших медицинских учреждениях преимущественно на 9–10-е дни МЦ, помещены в раствор забуференного нейтрального формалина и доставлены в лабораторию. После автоматической проводки с использованием раствора для гистологической проводки на основе изопропилового спирта (Изопреп, Биовитрум[C1]) в гистопроцессоре Leica ASP200 (Leica Microsystems Nussloch GmbH, ФРГ) проводили заливку в парафин и изготавливали срезы толщиной 3–4 мкм, которые окрашивали гематоксилином и эозином. Иммуногистохимическое окрашивание выполнено с использованием автоматического аппарата для иммуногистохимии (ИГХ) «Бонд-макс» (Bond-MaX, Leica Mikrosystems Vertrieb GmbH, ФРГ) в соответствии с рекомендациями производителя антител к антигенам CD3(LN 10) и CD79-альфа(11E3) Bond RTU Primary производства Leica Biosystems. Согласно Nordic Quality immunohistochemiсal Control (NordiQC), белок CD3 – это пан-Т-клеточный маркер, который, за исключением слабой экспрессии в клетках Пуркинье и активированных NK-клетках, обнаруживается только в Т-клетках, преимущественно на их поверхности. Антиген CD79-aльфа специфичен для B-клеток, появляется до стадии пре-B-клеток, присутствует и в плазматических клетках, в подавляющем большинстве В-клеточных новообразований. При ИГХ с антителами к CD79-aльфа в клетках мантийной зоны, зародышевых центров лимфоидных узелков миндалин, толстой кишки выявляется мембранное окрашивание, а в плазмоцитах и активированных В-клетках – и сильное цитоплазматическое окрашивание.
В материале пайпель-биоптатов оценивали состояние железистого и стромального компонентов эндометрия, наличие клеточных инфильтратов в люминальном эпителии, субэпителиально, в строме и перигландулярно с учетом их объема и клеточного состава – присутствие CD3-позитивных Т-клеток и CD79-альфа – положительных В-лимфоцитов и плазматических клеток, а также наличие признаков фиброза в ткани, формирование картины типа «водоворота» вокруг маточных желез, состояние сосудов эндометрия. Препараты исследовали с помощью микроскопа Leica DM 3000 с цифровой камерой (ув. х100, х200, х400). Результаты обрабатывали статистически с помощью программы IBM SPSS Statistics 23 с использованием описательных параметрических и непараметрических статистических методов.
Результаты исследования и их обсуждение. У большинства женщин исследованной группы имел место осложненный акушерско-гинекологический анамнез: невынашивание беременности, выкидыши, аборты, неразвивающиеся беременности, неудачные попытки ЭКО. 24 женщины (48%) принимали комбинированные пероральные контрацептивы и гормональные препараты, у 60% женщин в анамнезе имелись гинекологические заболевания и экстрагенитальная патология.
При гистологическом исследовании пайпель-биоптатов эндометрия, полученных в пролиферативную фазу МЦ, преимущественно на 9,8±2,35 дни (max – 20, min – 5), выявили: 1) 37 (82%) из 50 образцов соответствовали средней стадии пролиферации (рис. 1), в 36 случаях (72%) железы имели округлую форму, в 14 (28%) наблюдениях отдельные железы приобретали извитость; 2) фиброз стромы диагностирован в большинстве наблюдений (рис. 2) – в 45 случаях (90%); 3) в 46 случаях (92%) выявлен отек стромы; 4) в 31 наблюдении (62%) диагностированы различные виды кровоизлияний. При исследовании наличия лимфоидных клеточных инфильтратов в эндометрии с локализацией в люминальном эпителии, субэпителиально, в строме и перигландулярно диагностировали: 1) во всех наблюдениях (50 случаев, 100%) присутствовала стромальная лимфоидная инфильтрация; 2) интраэпителиальные лимфоцитарные инфильтраты выявлены в 16 наблюдениях (35,5%); 3) в 15 случаях (33,3%) присутствовала субэпителиальная инфильтрация; 4) в 7 наблюдениях (15,5%) выявлены перигландулярные инфильтраты.
При ИГХ-исследовании пайпель-биоптатов установили (рис. 3–6): 1) во всех 50 наблюдениях (100%) в эндометрии присутствовали CD3-позитивные Т-лимфоциты, тогда как CD79-альфа-положительная популяция В-клеток и плазматических клеток выявлена только у 24 пациенток (53,3%); 2) стромальная инфильтрация CD3-позитивными Т-лимфоцитами различной степени выраженности выявлена у всех 50 пациенток (в 100% случаев), интраэпителиальная – в 17 наблюдениях (34%), субэпителиальная – в 18 случаях (36%), перигландулярная – в 10 наблюдениях (20%); 3) CD3-положительные Т-лимфоциты встречались как в виде одиночных, рассеянных в эндометрии клеток, так и в виде мелких и средних групп клеток, а также в виде достаточно крупных лимфоидных скоплений; CD79-альфа-позитивные В-клетки и плазмоциты чаще всего были единичными, иногда встречались в виде малочисленных групп, редко – в виде относительно крупных скоплений.
Ранее для иммуногистохимической диагностики ХЭ применялись различные панели ИГХ-маркеров, включающие антитела к следующим субпопуляциям лимфоцитов и структурам эндометрия: CD4 (зрелым Т-лимфоцитам-хелперам), CD8 (зрелым Т-лимфоцитам-эффекторам), CD10 (фолликулярным Т-хелперам, В-
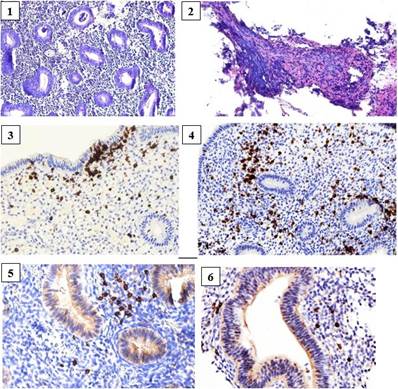
Гистологические и иммуногистохимические особенности эндометрия при хроническом эндометрите
1 – Пациент женского пола, 38 лет, хронический эндометрит, гистологическое строение эндометрия на 10-й день менструального цикла, окраска гематоксилином и эозином, увеличение х100;
2 – Пациент женского пола, 40 лет, хронический эндометрит, фиброз стромы эндометрия; окраска гематоксилином и эозином, увеличение х100;
3 – Пациент женского пола, 31 год, хронический эндометрит, интра- и субэпителиальная инфильтрация CD3-позитивными Т-лимфоцитами, увеличение х200;
4 – Пациент женского пола, 31 год, хронический эндометрит, стромальная и перигландулярная инфильтрация CD3-позитивными Т-лимфоцитами, увеличение х200;
5 – Пациент женского пола, 38 лет, хронический эндометрит, инфильтрация CD79-альфа-положительными В-лимфоцитами и плазматическими клетками, увеличение х400;
6 – Пациент женского пола, 39 лет, хронический эндометрит, инфильтрация CD79-альфа-положительными В-лимфоцитами и плазматическими клетками, увеличение х400 лимфоцитам герминативного центра, нейтрофильным гранулоцитам), CD20 (наивным неактивированным В-лимфоцитам), CD56 (NK-клеткам), CD68 (моноцитам, гистиоцитам, CD68 – пангистиоцитарный маркер), CD138 (плазматическим клеткам), LIF (LIF – лейкозингибирующий фактор, полифункциональный цитокин, необходимый для имплантации бластоцисты) и некоторые другие. В качестве многообещающего маркера для плазматических клеток эндометрия рассматривается онкоген множественной миеломы (MUM)-1, фактор транскрипции, экспрессируемый на поздних стадиях дифференцировки В-клеток [10]. Плазматические клетки накапливаются фокально в строме эндометрия, а не распределяются равномерно, и могут быть пропущены в небольших образцах биопсии эндометрия, тогда как комбинация CD138 и MUM-1 потенциально может компенсировать недостатки каждого молекулярного маркера при обнаружении плазмоцитов [11]. Результаты настоящего исследования указывают на возможность иммуногистохимической диагностики ХЭ с применением антител CD3(LN 10) и CD79-альфа(11E3) для выявления СD3, являющегося пан-Т-клеточным маркером, и CD79-альфа – наиболее универсального из В-клеточных маркеров, включающего и CD138-позитивные плазматические клетки. Полученные данные свидетельствуют об эффективности верификации CD3-позитивных Т-лимфоцитов в различных структурах эндометрия, в то время как CD79-альфа положительная популяция В-клеток и плазматических клеток выявляется значительно реже, чаще всего в виде единичных клеток или малочисленных групп.
Полученные данные и описанные в литературы факты указывают на справедливость утверждения K. Klimaszyk et al. (2023) о том, что многие аспекты этиопатогенеза хронического эндометрита до настоящего времени изучены недостаточно, а стандарты морфологической диагностики не в полной мере отвечают современным требованиям, в связи с этим «очень важно достичь консенсуса по диагностике ХЭ, необходимо расширение международного сотрудничества и создание хорошо продуманных мультицентровых исследований» для изучения ХЭ [12].
Заключение. Полученные результаты подчеркивают актуальность проблемы морфологической диагностики хронического эндометрита, об этом свидетельствует высокая частота данной патологии у женщин репродуктивного возраста, ассоциированной с развитием бесплодия, ранним невынашиванием беременности. В ограниченном объеме материала пайпель-биоптатов при ХЭ выявлены наиболее часто встречающиеся патологические изменения в эндометрии: фиброз стромы, лимфоидная инфильтрация CD3- позитивными Т-лимфоцитами; CD79-альфа-положительные инфильтраты, состоящие из В-клеток и плазмоцитов, выявлялись значительно реже. При диагностике ХЭ можно рекомендовать учитывать выраженность и различную локализацию клеточных инфильтратов – стромальную, интраэпителиальную, субэпителиальную и перигландулярную. Иммуногистохимическое исследование с применением антител к антигенам CD3(LN 10) и CD79-альфа(11E3) является информативным методом для верификации в эндометрии Т-лимфоцитов, В-клеток и плазмоцитов, соответственно, для оценки степени активности воспалительного процесса при ХЭ.



