Рак является серьезной проблемой общественного здравоохранения во всем мире и второй по значимости причиной смерти, уступая лишь сердечно-сосудистым заболеваниям [1]. Рак желудка – одно из наиболее распространенных злокачественных новообразований пищеварительного тракта, занимающее пятое место по заболеваемости и четвертое по смертности среди всех онкопатологий (рис. 1).
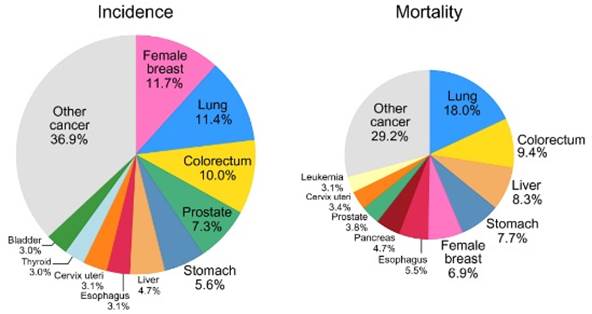
Рис. 1. Глобальная статистика рака (заболеваемость и смертность за 2020 г. среди обоих полов) в мире [2]
Согласно статистике, за 2020 год было выявлено более 1 млн новых случаев заболевания и более 700 тыс. смертей (7,7% всех случаев смерти от рака) [2]. В большинстве регионов общая 5-летняя относительная выживаемость при раке желудка составляет около 20% [3].
В мире заболеваемость и смертность от рака желудка коррелируют с увеличением возраста и относительно редко встречаются у лиц обоих полов моложе 45 лет. Частота встречаемости данного заболевания у мужчин примерно в два раза выше, чем у женщин. В 2020 году в семи странах Азии (Афганистане, Бутане, Иране, Кыргызстане, Таджикистане, Туркменистане, Узбекистане) рак желудка среди мужчин был наиболее часто диагностируемымзаболеванием и основной причиной смерти от рака в десяти странах (Афганистане, Иране, Таджикистане, Бутане и Кыргызстане в Азии, Мали и Кабо-Верде в Африке, Коста-Рике в Центральной Америке, Колумбии и Перу в Южной Америке). Среди женщин рак желудка был основной причиной смерти от рака в трех странах (Бутане, Перу, Таджикистане). Несмотря на снижение заболеваемости и смертности в некоторых странах за последние десятилетия, рак желудка остается одной из основных проблем здравоохранения во всем мире [4].
На данный момент химиотерапия служит одним из основных методов лечения онкологических пациентов, в том числе больных раком желудка [5, 6]. Существует большой арсенал химиопрепаратов, который включает более 100 противоопухолевых субстанций, применяемых в клинической практике. Однако большинство из них обладают невысокой эффективностью и низкой избирательностью, что приводит к тяжелым токсическим реакциям [7]. Также, учитывая химиорезистентность опухолей, развивающуюся в процессе лечения пациентов, актуальной проблемой на сегодняшний день остаются разработка и тестирование новых противоопухолевых средств, обладающих высокой цитотоксической активностью и минимальными побочными эффектами.
Трополоны, или алкалоиды трополонового ряда, представляют собой семичленные небензолоидные ароматические соединения со склонностью к связыванию металлов; они обладают разнообразной биологической активностью, включая противовоспалительные, антиоксидантные, антибактериальные и другие свойства. Некоторые из них являются мощными ингибиторами роста опухолевых клеток человека [8, 9], а также проявляют выраженную антимиграционную активность, что позволяет рассматривать их в качестве перспективных кандидатов для разработки антиметастатических препаратов [10]. Поэтому начиная с конца прошлого столетия природные соединения трополона и его синтетические производные привлекают к себе все большее внимание ученых и онкологов. После тщательных исследований по изучению их эффективности, механизмов действия и безопасности они могли бы использоваться в качестве противоопухолевых средств.
Целью работы стало исследование цитотоксического действия 2-(1,1-диметил-1h-бензо[e]индолин-2-ил)-5,6,7-трихлор-1,3-трополона (JO-122 (2)) на клеточной линии человеческой аденокарциномы желудка AGS.
Материал и методы исследования
Исследуемое соединение
В работе был исследован трополон JO-122 (2), который представляет собой порошок желтого цвета. Получение исследуемого вещества происходит с помощью реакции расширения о-хинонового цикла, которая протекает при кипячении в диоксане между 1,1,2-триметил-1H-бензо[е]индолином и 3,4,5,6-тетрахлор-1,2-бензохиноном. Синтез включает в себя следующие стадии: альдольная конденсация с образованием интермедиата, циклизация интермедиата в норкарадиеновое производное, перегруппировка последнего в дигидротрополон и его дегидрохлорирование.
Клеточная культура
Эксперимент проведен на клеточной линии человеческой аденокарциномы желудка AGS (#C0023004; «AddexBio», США). Опухолевые клетки культивировали в СО2-инкубаторе («Thermo Fisher Scientific», США) в стандартных условиях (температура 37°C, 5% CO2, влажность 95%) в питательной среде DMEM (Gibco, США), содержащей 10%-ную эмбриональную бычью сыворотку («БиолоТ», Россия) и 1% пенициллина/стрептомицина («БиолоТ», Россия). Пересев культуры AGS осуществляли 3 раза в неделю.
МТТ-тест
Оценку цитотоксичности трополона JO-122 (2) проводили при помощи МТТ-колориметрического теста. Опухолевые клетки человеческой аденокарциномы желудка, достигшие логарифмической фазы роста, пересевали в 96-луночные планшеты в концентрации 5 × 103 клеток на лунку и преинкубировали перед добавлением тестируемого препарата в стандартных условиях, указанных выше. После 24 часов преинкубации к культуре клеток AGS методом раститровки добавляли различные концентрации тестируемого трополона (5, 2,5, 1,25, 0,625, 0,3125, 0,1563, 0,0781, 0,0391, 0,0195, 0,0098 мкг/мл). В контрольные лунки был добавлен растворитель диметилсульфоксид («БиолоТ», Россия) в концентрации 1%. Планшеты с внесенными соединениями инкубировали в тех же условиях в течение 24, 48 и 72 ч в СО2-инкубаторе. После этого к ним добавляли по 20 мкл рабочего раствора МТТ. Через 2 часа инкубации в каждой лунке заменяли среду на раствор диметилсульфоксида для растворения образовавшихся кристаллов формазана. При помощи ридера для микропланшетов Stat Fax 2100 («Awareness Technology», США) измеряли оптическую плотность (средняя длина волны 540 нм).
Для сравнения был выполнен МТТ-тест с фторурацилом (5-FU) (ООО «ЛЭНС-Фарм», Россия) в следующих концентрациях: 100, 50, 25, 12,5, 6,25, 3,125, 1,5625, 0,7813, 0,3906, 0,1953 мкг/мл.
Статистическая обработка
Сравнительный анализ проводили с использованием U-критерия Манна–Уитни. Различия считали статистически значимыми при р<0,05. Значение концентрации, вызывающее 50%-ное ингибирование роста популяции опухолевых клеток (IC50) в течение 48 ч инкубации, было рассчитано с построением кривых «доза – эффект».
Результаты исследования и их обсуждение
Чтобы изучить терапевтические возможности трополона JO-122 (2) при раке желудка, был проведен МTT-анализ. Цитотоксическая активность нового соединения в отношении опухолевой линии клеток человека AGS показана на рисунке 2.
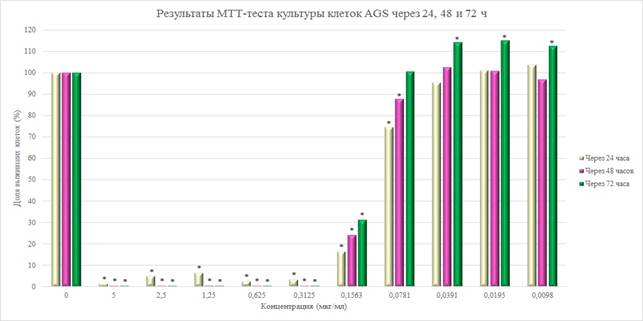
Рис. 2. Результаты МТТ-теста культуры клеток AGS через 24, 48 и 72 ч после добавления трополона JO-122 (2)
Примечание: * – отличия статистически значимы при p<0,05 по сравнению с контролем
Ингибирование роста клеток культуры AGS при времени инкубации после добавления JO-122 (2) 24 и 48 часов происходило при концентрации 0,0781 мкг/мл, а при времени инкубации 72 часа – 0,1563 мкг/мл, и увеличивалось по мере увеличения дозы. Не наблюдалось значительногоингибирования роста клетокпри дозах 0,0391 мкг/мл и выше при времени инкубации 24 и 48 ч.
Согласно кривым «доза – эффект», построенным по результатам МТТ-теста через 48 часов экспозиции с диметилсульфоксидом, значение IC50 для культуры аденокарциномы человека составило около 0,1211 мкг/мл (рис. 3).
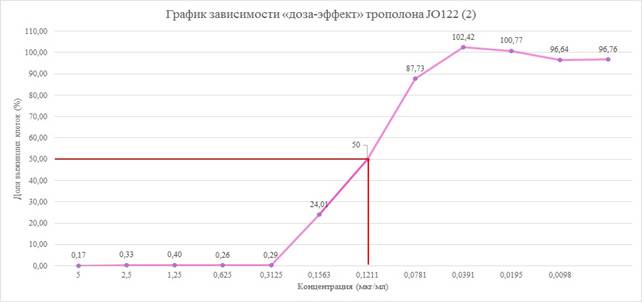
Рис. 3. График зависимости «доза – эффект» трополона JO-122 (2)
Для сравнения был проведен МТТ-тест в отношении опухолевой линии клеток человека AGS с использованием 5-FU (рис. 4).
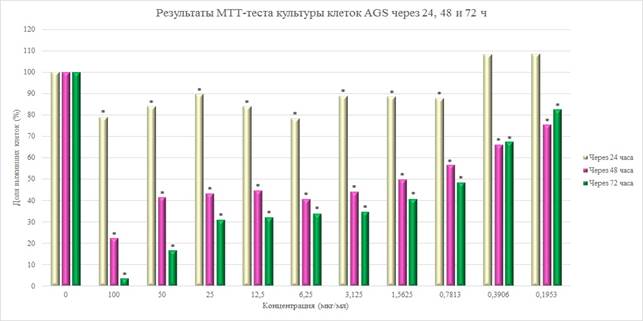
Рис. 4. Результаты МТТ-теста культуры клеток AGS через 24, 48 и 72 часа после добавления 5-FU
Примечание: * – отличия статистически значимы при p<0,05 по сравнению с контролем
Для 5-FU ингибирование роста культуры клеток при времени инкубации 48 и 72 часа происходило уже при концентрации 0,1953 мкг/мл, а при 24 часах минимальная концентрация препарата составила 0,7813 мкг/мл. Согласно кривым «доза – эффект», построенным по результатам МТТ-теста через 48 часов экспозиции с 5-FU, значение IC50 составило около 1,5625 мкг/мл (рис. 5).
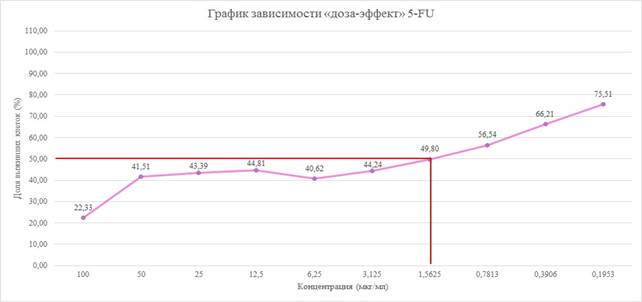
Рис. 5. График зависимости «доза – эффект» 5-FU
Таким образом,несмотря на то, что концентрация исследуемого трополона была в несколько раз ниже концентрации препарата сравнения, JO-122 (2) продемонстрировал цитотоксическую активность в отношении культуры аденокарциномы человека AGS.
В ряде исследований зарубежных ученых также была продемонстрирована высокая противоопухолевая эффективность трополонов. Например, в работе Q.G. Ma с соавт. (2020) была проведена оценка цитотоксического действия 23 трополонов в различных концентрациях (0,3125, 0,625, 1,25, 2,5, 5, 10, 20, 40 мкМ), 5 из которых проявляли умеренную антипролиферативнуюактивность на следующие линии опухолевых клеток человека: HGC-27 (рак желудка), MDA-MB-231 (рак молочной железы), A-549 (рак легких), HCT-116 (рак толстой кишки) и A2780 (рак яичников). ЗначениеIC50находилось в диапазоне от 0,5±0,2 до 15,5±2,7 мкМ [11]. В другой работе (S.C. Yang с соавт., 2022) был использован β-туяплицин (хиноктиол) – одно из наиболее известных природных биоактивных производных трополона, выделенный из Chamaecyparis obtusa и Thuja plicata, который демонстрирует многообещающий потенциал с точки зрения антиоксидантных и противовоспалительных свойств. Данные показали, что хиноктиол подавлял жизнеспособность опухолевых клеток остеосаркомы (U-2OS и MG-63) в концентрации от 10 до 80 мкМ после обработки в течение 48 часов и индуцировал остановку S-фазы клеточного цикла. Полумаксимальная ингибирующая концентрация через 48 часов для клеток U-2OS составляла 25 мкМ, а для клеток MG-63 – 36 мкМ [12].
Заключение
Таким образом, трополон JO-122 (2) на опухолевой культуре человеческой аденокарциномы желудка AGS при проведении МТТ-теста показал свою способность к ингибированию роста опухолевых клеток.



