Муковисцидоз – наследственное аутосомно-рецессивное заболевание, ассоциированное со структурными изменениями и нарушением функции белка трансмембранного регулятора проводимости муковисцидоза, что приводит к нарушению работы хлорных каналов, расположенных на апикальной поверхности экзокринных желез [1, 2]. Трансформация муковисцидоза из педиатрической проблемы в терапевтическую стала возможной благодаря совершенствованию терапевтических подходов, внедрению неонатального скрининга, расширению информационного поля для врачей и пациентов. Принципиально новым перспективным направлением в отношении как продолжительности, так и качества жизни для больных кистофиброзом поджелудочной железы является введение патогенетической (таргетной) терапии [3, 4]. К модуляторам CFTR, получившим нормативное одобрение, относят группы корректоров и потенциаторов, действие которых направлено как на трансформацию структуры порочно сформированного белка, так и нормализацию работы уже сформированного хлорного канала [1, 3, 5]. Известны 4 патогенетические формулы, рекомендованные в терапии больных муковисцидозом в зависимости от генетического диагноза. Выбор препарата для пациента осуществляется исходя из варианта нарушения генетической последовательности и с учетом возрастного ценза. Однако существует определенная когорта пациентов, которой согласно генетическому диагнозу не может быть рекомендован какой-либо из известных на сегодняшний день таргетных препаратов. В то же время научные исследования способны расширить спектр мутаций, возможных для проведения патогенетической терапии. Для решения данного вопроса был разработан лабораторный тест, позволяющий оценить эффективность таргетных препаратов для лечения конкретных пациентов, в том числе с редкими и единичными генетическими вариантами CFTR. В этих целях были разработаны биологические 3D-модельные системы in vitro длительного культивирования, схожие по структуре, выполняемым функциям и клеточному составу с разными органами: органоиды [6, 7]. Метод кишечных органоидов предназначен для персонализированной оценки влияния таргетных препаратов на работу канала CFTR у больных муковисцидозом. В настоящее время органоиды являются уникальной моделью для подбора персонализированной терапии и изучения фундаментальных процессов и генетических заболеваний. Культуры кишечных органоидов используют в качестве чувствительной тест-системы для оценки функциональной активности канала CFTR, диагностики муковисцидоза и назначения индивидуальной схемы лечения при этом заболевании [6, 7]. В целях демонстрации использования данного метода у больного муковисцидозом для подбора таргетного препарата приводим следующий клинический случай.
Целью нашей работы явилась демонстрация использования пробы на кишечных органоидах для решения вопроса о возможной эффективности известных таргетных препаратов у пациента, больного муковисцидозом, с генетическим диагнозом, не удовлетворяющим критериям назначения модуляторов CFTR.
Клинический случай
В пульмонологическом отделении ГБУЗ АО ОДКБ им. Н.Н. Силищевой г. Астрахани наблюдается ребенок (девочка) В., 2006 года рождения, с клиническим диагнозом: E84.8 Муковисцидоз, смешанная форма (муковисцидоз с панкреатической недостаточностью), тяжелое течение, Е84.8, генотип F508del/F508del. Хронический гнойный обструктивный бронхит. Цилиндрические бронхоэктазы. Хроническая дыхательная недостаточность I (первой) степени. Хроническая панкреатическая недостаточность тяжелой степени. Мутации гена CFTR L467F;F508del]/c.3532_3535dup. Микробиологический статус: хронический высев P. Aeruginosae. Осложнения: Цирроз печени без портальной гипертензии. Полипоз носа. Отставание в физическом развитии.
При осмотре отмечается, что масса тела 54 кг при росте 163 см, ИМТ равен 20,37. Состояние средней степени тяжести. Обращает на себя внимание выраженная деформация концевых фаланг по типу «барабанных палочек», ногтевых пластин по типу «часовых стекол». В легких отмечается жесткое дыхание, одинаково проводится по всем полям, хрипы влажные разнокалиберные, не обильные с обеих сторон с частотой дыхательных движений (ЧДД) 18 в минуту, Sp O2 98%. При этом тоны сердца громкие, ритмичные, при частоте сердечных сокращений (ЧСС) 82 в минуту и уровне артериального давления (АД) 95/56 мм рт. ст.
Согласно данным анамнеза, ребенок рожден от первой беременности, первых срочных родов с весом с весом 3450 г, ростом 53 см. Брак не являлся кровнородственным. Учитывая, что программа неонатального скрининга в регионе стартовала в 2007 году, ребенку диагностика на 5 наследственных заболеваний, в том числе и муковисцидоз, при рождении проведена не была. В клинической картине с первых месяцев жизни наблюдались проявления полифекалии с видимой стеатореей, отставание в физическом развитии, многократные эпизоды бронхитов, длительно сохраняющийся кашель. По совокупности клинических симптомов (проявления респираторного и кишечного синдромов) в 2008 году, в возрасте 2,5 лет, был заподозрен диагноз «муковисцидоз», ребенок был направлен на обследование и лечение в пульмонологическое отделение Государственного бюджетного учреждения здравоохранения Астраханской области «Областная детская клиническая больница им. Н.Н. Силищевой». Учитывая положительные результаты потовых проб (первая потовая проба методом проводимости на аппарате «Макродакт- Свит-чек) – 86 ммоль/л, вторая проба методом проводимости на аппарате «Макродакт- Свит-чек» – 89 ммоль/л), проявления тяжелой панкреатической недостаточности (уровень эластазы 1 менее 15 мкг/г), данные анамнеза и клинического осмотра, в 2008 году пациентке был выставлен диагноз: «Муковисцидоз. Легочно-кишечная форма. Тяжелое течение». Назначена базисная терапия согласно действующим стандартам оказания медицинской помощи: муколитические препараты (дорназа-альфа ингаляционно и ацетилцистеин в форме саше) в сочетании с комплексом кинезиотерапии, микросферические ферменты для коррекции панкреатической недостаточности, урсодезоксихолевая кислота и витаминотерапия. С 2014 года, согласно изменениям в тактике муколитической терапии для больных муковисцидозом, в комплекс лечения введены ингаляции гипертоническим раствором, а с 2022 года проведена ротация на ингаляционную форму маннитола в связи с лучшей эффективностью ингаляций и большой компетентностью пациента к терапии маннитолом.
Микробиологический статус пациентки с 2010 года характеризовался персистирующим, а впоследствии – хроническим высевом P. Aeruginosae с чувствительностью к цефалоспоринам III–IV поколения, аминогликозидам, фторхинолонам. Обострения бронхолегочного процесса, требующие госпитализации, отмечались 1–2 раза в год, проводились с использованием курса внутривенной антибактериальной терапии с учетом данных микробиологического мониторинга. Учитывая хронический высев синегнойной палочки, девочка получала курсы ингаляционных антибиотиков, однако компетентность к проведению ингаляционной антибактериальной терапии была сомнительной.
При постоянном воспалительном процессе при муковисцидозе, обусловленном как влиянием мутации гена CFTR, так и высокоагрессивной респираторной грамотрицательной флорой, по мере взросления у больной произошли необратимые изменения легочной паренхимы. Согласно данным компьютерной томографии органов грудной клетки, определены расширенные просветы бронхов до субсегментарных, с выраженным уплотнением и утолщением стенок (цилиндрическая бронхоэктазия), в S2 левого легкого, S10 правого легкого субплеврально ретенционные кисты. Отмечены интерстициальное усиление легочного рисунка, утолщения междольковых перегородок, участки линейного фиброза.
У ребенка диагностирован ряд наиболее частых осложнений муковисцидоза в виде полипоза носа и цирроза печени, о чем свидетельствуют данные инструментального обследования. Согласно данным компьютерной томограммы придаточных пазух носа, верхнечелюстные пазухи с двух сторон заполнены мягкотканным содержимым (с плотностью 68HU, полипозного характера), однородной структуры, с распространением через соустье полости носа. Слева соустье расширено. Носовые ходы, больше средний носовой ход, сужены, заполнены полипозным разрастанием, с истончением носовых раковин. Ячейки решетчатой кости нормально контурируются с неизмеренными костными стенками, пневматизация снижена. Учитывая отсутствие эффективности проводимой консервативной терапии полипоза носа (дорназы-альфа эндоназально и ингаляции топических глюкокортикостероидов), ребенок был направлен для оперативного лечения в ФГБУ «Национальный исследовательский центр отоларингологии Федерального медико-биологического агентства» г. Москвы, где пациентка была успешно прооперирована, однако, учитывая патогенетические аспекты заболевания, возможно развитие рецидивов.
Цирроз печени диагностирован ребенку с 8-летнего возраста. В связи с установленным диагнозом был скорректирован объем терапии с включением аденометионина и повышением дозы урсодезоксихолевой кислоты до 30 мг/кг, согласно действующим клиническим рекомендациям. На фоне гепатопротективной терапии прогрессирование цирроза печени носит контролируемый характер. Согласно проведенной в 2023 году эзофагогастродуоденоскопии, варикозного расширения вен не наблюдается. Желудок без изменений, при этом складки продольные, утолщены, содержимое мутное, с большим количеством желчи, слизистая гиперемирована, отечная. Пилорический жом зияет, оправляется заброс желчи. На ультразвуковом исследовании органов брюшной полости выявлены признаки диффузных изменений печени и поджелудочной железы следующего характера: печень не увеличена, структура грубо диффузно-однородная, эхогенность неравномерно повышена, сосудистый рисунок без особенностей. В воротах печени лоцируются 2 лимфоузла размерами 2,3х1,1 см и 1,5х0,9 см однородной структуры, нормальной эхогенности. Воротная вена 0,7 см. Желчный пузырь правильной формы, стенки не утолщены, содержимое гомогенное. Поджелудочная железа неоднородной структуры, значительно повышенной эхогенности, увеличена. Селезенка не увеличена, структура однородная, эхогенность значительно повышена.
Отметим, что в 2021 году, учитывая возможность включения в терапию таргетных препаратов, определен полный генетический диагноз пациентки методом полиэкзомного секвенирования в ФГБНУ «Медико-генетический научный центр имени академика Н.П.Бочкова». Выявлен патогенный вариант c.1521_1523delCTT (F508del;) в гетерозиготном состоянии с c.3532_3535dup. Методом количественного MLPA анализа определено носительство варианта L467F гена CFTR (NM_000492.3: c.1399C> T; NP_000483.3:p.(Leu467Phe)) в составе комплексного аллеля с мутацией F508del.
Учитывая результаты генетического исследования (обнаружение комплексного аллеля L467F и варианта генетической последовательности, не удовлетворяющего спектру мутаций, на которые оказывают влияние 4 известные патогенетические формулы, рекомендованные в терапии больных муковисцидозом), документы были направлены в ФГБНУ Медико-генетический научный центр (Российский центр диагностики и лечения муковисцидоза) для проведения консилиума о возможности проведения пробы на кишечных органоидах для решения вопроса об изучении возможной эффективности известных таргетных препаратов для данной пациентки. Исследование было одобрено и проведено на базе научно-клинического отдела муковисцидоза ФГБНУ «МГНЦ» 29.08.2024 года.
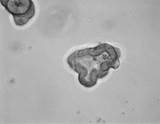
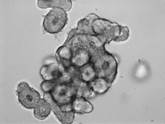
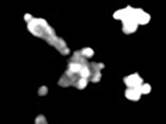
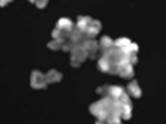
Исследование проведено в 6 этапов со следующими результатами (рис. 1 и 2).
1-й этап. Получена культура кишечных органоидов с люменом (внутренней полостью) незначительного размера.
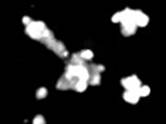
2-й этап. Кишечные органоиды при воздействии форсколина (5 мкМ, 1 ч). Результат: не отвечают набуханием.
3-й этап. При совместном действии ивакафтора (VX-770, «Калидеко») и форсколина (5 мкМ, 1 ч) Результат: не наблюдается изменение объема кишечных органоидов по сравнению с влиянием только форсколина.
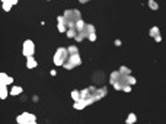
4-й этап. При совместном действии лумакафтора/ивакафтора (VX-809+VX-770, «Оркамби») и форсколина (5 мкМ, 1 ч). Результат: не наблюдается изменение объема кишечных органоидов по сравнению с влиянием только форсколина.
5-й этап. При совместном действии тезакафтора/ивакафтора (VX-661+VX-770, «Симдеко») и форсколина (5 мкМ, 1 ч). Результат: не наблюдается изменение объема кишечных органоидов по сравнению с влиянием только форсколина.
6-й этап. При совместном действии элексакафтора, тезакафтора, ивакафтора (VX-445+VX661+VX-770, «Трикафта») и форсколина (5 мкМ, 1 ч) Результат: наблюдается слабое изменение объема кишечных органоидов по сравнению с влиянием только форсколина.
|
1-й этап |
2-й этап |
3-й этап |
|
Морфологические особенности (в проходящем свете) |
Действие форсколина (5 мкМ) |
Действие ивакафтора (VX-770, «Калидеко») и форсколина (5 мкМ) |
|
2 суток
|
До действия
|
До действия
|
|
5 суток
|
После действия
|
После действия
|
Рис. 1. Проведение первых 3 этапов пробы на кишечных органоидах (морфологические особенности, действие форсколина и ивакафтора)
|
4-й этап |
5-й этап |
6-й этап |
|
Действие ивакафтора, лумакафтора (VX- 770+VX-809, «Оркамби») и форсколина (5 мкМ) |
Действие ивакафтора, тезакафтора (VX- 770+VX-661, «Симдеко») и форсколина (5 мкМ) |
Действие ивакафтора, тезакафтора, элексакафтора (VX- 770+VX-661+VX-445, «Трикафта») и форсколина (5 мкМ) |
|
До действия
|
До действия
|
До действия
|
|
После действия
|
После действия
|
После действия
|
Рис. 2. Проведение первых 4–6 этапов пробы на кишечных органоидах (действие ивакафтора/лумакафтора, действие ивакафтора/тезакафтора, действие ивакафтора/тезакафтора, элексакафтора)
Таким образом, в ходе исследования было показано, что пациентке В. терапия протестированными модуляторами CFTR не может быть рекомендована, поскольку в модели кишечных органоидов не наблюдается восстановление активности канала CFTR. Таким образом, в настоящее время известными генно-инженерными препаратами целевая патогенетическая терапия проведена быть не может. Ребенку рекомендовано продолжение базисной терапии в прежнем объеме.
Исследование кишечных органоидов проводилось как у здоровых людей, так и у больных муковисцидозом, демонстрируя их перспективность в целях персонифицированного подбора модуляторов CFTR. В ходе исследования, проведенного коллективом авторов во главе с Е.И. Кондратьевой, было доказано, что морфология полученных культур кишечных органоидов отражает функцию CFTR. Для доказательства работы и надежности форсколинового теста использовали культуру F508del/F508del (c.[1521_1523delCTT];[1521_15 23delCTT]). Было показано, что совместное применение корректора VX-809 и потенциатора VX-770 белка CFTR восстанавливает его синтез и проводимость в эпителиальных клетках кишечных органоидов. Таким образом, опыт применения методов оценки функциональности анионного канала CFTR у пациентов с установленным и предполагаемым диагнозом муковисцидоза показал их перспективность для персонифицированного подбора модуляторов CFTR [8].
Заключение
Применение методов оценки функциональности анионного канала CFTR у пациентов с установленным диагнозом «муковисцидоз» открывает широкие перспективы возможного расширения показаний перед больными с несоответствием генетического диагноза, заявленному производителем, для использования тех или иных таргетных препаратов, рекомендуемых для патогенетической терапии кистофиброза поджелудочной железы.