Сегодня рак легких является распространенной патологией, которая занимает вторую позицию среди онкологических заболеваний [1, 2]. Рак легкого – это заболевание различных морфологических форм, объединенное в одну нозологическую группу только по органной принадлежности [3, 4]. Знание морфологического строения новообразования позволяет выбрать правильную тактику лечения, что особенно важно в век таргетных препаратов [5]. Трепан-биопсия, позволяющая получить полноценную ткань новообразования для гистологического исследования и иммуноферментного анализа, является самым точным методом диагностики [6]. В настоящее время она проводится чаще всего под контролем компьютерной томографии (КТ) методом «свободной руки», когда и пациент, и врач-интервенционалист, несмотря на различные виды защиты, получают высокую радиационную нагрузку [7]. По нашему мнению, выходом из сложившейся ситуации является замена метода «свободных рук» методом робот-ассистированных вмешательств.
Цель исследования: расширение арсенала методик трепан-биопсии новообразований легких с целью сокращения продолжительности манипуляции, снижения частоты осложнений и лучевой нагрузки на пациента и персонал.
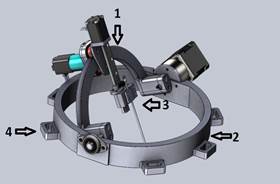
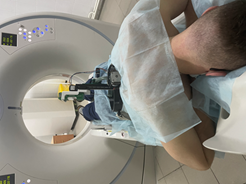
Материал и методы исследования. На кафедре госпитальной хирургии предложена методика робот-ассистированной пункции с помощью разработанного роботизированного устройства для трепан-биопсии паренхиматозных органов, на которое получен патент РФ № 190455, МПК A61B17/00; приор.1.08.2021. [8]. Устройство представляет собой кронштейн в виде дуги (1), закрепленной на раме (2), который может вращаться вместе с имеющимся на нем зажимом для крепления биопсийной иглы (3). Устройство снабжено электроприводом обеспечения движения всей системы в различных направлениях. Радиус рамы держателя соответствует среднему радиусу корпуса пациента. На внешней окружности рамы имеются скобы (4) для крепления ремней и фиксации к корпусу пациента (рис. 1а). Описанная система позволяет надежно закреплять все устройство на корпусе пациента и обеспечивает быстрое и точное попадание иглы в зону интереса, сокращая и время проведения манипуляции по сравнению с методикой «свободных рук» (рис. 1б).
а б
Рис. 1. Стереотаксический держатель иглы для биопсии паренхиматозных органов: а – общий вид: 1 – кронштейн, 2 – рама, 3 – зажим для крепления биопсийной иглы, 4 – скобы для крепления ремней и фиксации к корпусу пациента; б – использование в клинике: устройство закреплено на грудной клетке пациента, находящегося в пропозиции для биопсии новообразования легкого прямым задним доступом
В процессе работы использовалась КТ-система Aquilion Lightning (TSX-036A), производитель Canon Medical Systems Corporation, Япония. В систему входил комплект для проведения интервенционных вмешательств с контролем в реальном времени, включающий модуль управления в помещении для оператора, жидкокристаллический монитор, программное обеспечение для отображения диагностических изображений, модуль для расширения промежутка между гентри и столом, модуль модернизации скорости вращения гентри (до 0,5 сек). Система имеет программное приложение для анализа плотности легочной ткани и узелковых образований легких, включая функцию их автоматизированного поиска.
В период 2019–2022 гг. в исследование были включены 40 пациентов с периферическими новообразованиями легких. Рандомизированные группы по 20 пациентов в каждой были созданы методом конвертов. Основная и контрольная группы пациентов достоверно не различались по полу, возрасту, массе тела. В основной группе мужчин было 12, женщин – 8, в контрольной – мужчин 13, женщин 7. Средний возраст пациентов основной группы составил 57,1±5,6 года, контрольной группы – 61,3±6,1 года (р=0,06). Средняя масса тела пациентов основной группы составила 78,7±8,4 кг, контрольной группы – 82,4±7,9 кг (р=0,07).
В основной группе биопсия проводилась с помощью разработанного авторами роботизированного устройства, в контрольной группе – методом «свободной руки». Исследование было одобрено локальным этическим комитетом медицинского института БелГУ 03.12.2019 г., протокол № 25. Всеми пациентами было подписано информированное согласие.
Методика выполнения робот-ассистированной биопсии заключалась в следующем. После предварительного сканирования оценивалось положение пациента на столе, визуализировалось место интереса и планировалась траектория пункции. После сборки устройство закреплялось на теле пациента в заранее спланированном месте. Производились обработка антисептиком места пункции, инфильтрационная анестезия мягких тканей в области пункции и насечение кожи. Биопсийная игла крепилась в фиксаторе устройства. Кончик иглы совмещался с кожным надрезом, держатель фиксировался ремнями в нужном положении. По КТ-сканам оценивалось положение иглы. Дистанционно, из пультовой, производилась коррекция угла направления иглы, затем, при задержке дыхания пациента, дистанционно погружали иглу на заданную глубину в ткани. По достижении концом иглы точки интереса производились взятие образцов ткани и удаление иглы. При обеих методиках для проведения биопсии в зависимости от длины трека использовались коаксиальные иглы 10–15 см стандартных размеров G14 – G17. После окончания процедуры биопсии сразу производилась контрольная КТ для исключения возможных осложнений.
Полученные образцы ткани фиксировали в 10%-ном формалине, обезвоживали в спирте и заключали в парафин. Микротомные срезы окрашивали гематоксилин-эозином, заключали в полистироль и исследовали под микроскопом.
В качестве критериев информативности биопсии обоими методами определяли чувствительность, специфичность и точность, исходя из получения истинно положительных, истинно отрицательных, ложноположительных и ложноотрицательных результатов. Как и другие авторы, авторы данной работы считали положительный результат (включая подозрительное злокачественное новообразование) истинно положительным, если имелось хирургически доказанное подтверждение, если гистологические результаты образца совпадали с результатами первичного злокачественного новообразования при метастазировании, если последующее клиническое течение соответствовало злокачественному, если были выявлены и доказаны другие метастазы. Истинно отрицательными считались результаты, если имелось хирургическое подтверждение его отсутствия или если оно впоследствии исчезло или уменьшилось в размерах либо оставалось стабильным при последующих КТ в течение года и больше. Ложноположительными считались результаты, если при хирургической резекции не было признаков злокачественности или если при последующей КТ при отсутствии лечения наблюдался регресс новообразования. Отрицательный результат считался ложноотрицательным, если было хирургическое подтверждение злокачественности, роста очага поражения или других доказанных метастазов [9, 10].
Статистическая обработка результатов исследования производилась с использованием прикладного пакета статистического анализа данных Statistica 13. В качестве показателя вариативности анализируемых признаков использовался диапазон (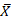 ± σ), где среднее значение
± σ), где среднее значение 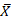 и стандартное отклонение σ определялись с учетом количества данных n в группе. Статистическая значимость результатов с учетом малых размеров выборок и невозможности доказать нормальность эмпирических распределений оценивалась непараметрическими методами. При оценке различия количественных показателей в группах проводилось парное сравнение по критерию Манна–Уитни, являющемуся непараметрическим аналогом t-критерия Стьюдента для несвязанных групп. Различия считались статистически значимыми при р<0,05.
и стандартное отклонение σ определялись с учетом количества данных n в группе. Статистическая значимость результатов с учетом малых размеров выборок и невозможности доказать нормальность эмпирических распределений оценивалась непараметрическими методами. При оценке различия количественных показателей в группах проводилось парное сравнение по критерию Манна–Уитни, являющемуся непараметрическим аналогом t-критерия Стьюдента для несвязанных групп. Различия считались статистически значимыми при р<0,05.
Результаты исследования и их обсуждение. Пациенты как основной, так и контрольной группы статистически не различались по объему пунктируемых новообразований, их локализации, расстоянию до плевры, характеру доступа. Средняя продолжительность манипуляции в основной группе составила 19,4±5,3 мин, в контрольной – 27,1±6,9 мин (p<0,001). Все перечисленные характеристики представлены в таблице 1.
Таблица 1
Характеристика особенностей поражения легких и процедуры биопсии в основной и контрольной группах пациентов
|
Оцениваемые характеристики |
Данные |
Уровень статистической значимости различия параметров в группах, р |
|
|
Основная группа n=20 |
Контрольная группа n=20 |
||
|
Размер новообразования (мм) <10 11–15 16–20 21–30 >30 Расстояние от плевры до новообразования (мм): 0 1–20 >21 Расположение новообразования: верхняя доля справа средняя доля справа нижняя доля справа верхняя доля слева нижняя доля слева Положение пациента: на спине на животе на боку Средняя продолжительность процедуры (мин) Количество плевральных проколов Эмфизема на КТ Гематома по КТ |
2 4 5 5 4
5 6 9
4 3 4 4 5
9 6 5
19,4±5,3 24 4 (20%) 3 (15%) |
3 3 4 5 5
4 8 8
2 4 4 5 5
8 8 4
27,1±6,9 26 7 (35%) 5 (25%)
|
0,15
0,2
– – – – –
– – –
<0,001 – <0,001 <0,001 |
P рассчитан на основании критерия Манна–Уитни.
Как видно из таблицы 1, самым частым осложнением этой манипуляции в обеих группах был пневмоторакс, который отмечен у 4 (20%) пациентов в основной группе и у 7 (35%) пациентов в контрольной группе. Тем не менее, дренаж плевральной полости потребовался только 1 пациенту из 4 в основной группе и 3 пациентам из 7 в контрольной группе из-за снижения сатурации и одышки. Гематомы по ходу продвижения иглы были зафиксированы на КТ у 3 (15%) пациентов в основной группе и у 5 (25%) пациентов в контрольной группе, однако они были небольших размеров и не требовали последующей хирургической коррекции.
Развитие пневмоторакса и гематомы как наиболее частых осложнений трансторакальной пункционной биопсии отмечено и другими авторами [11]. По данным литературы, при биопсии легкого под контролем КТ незначительные осложнения считаются обычным явлением и чаще возникают при трепан-биопсии, чем при тонкоигольной биопсии. Метаанализ частоты осложнений при трепан-биопсии легких показал 38,8% [12]. Это выше процента осложнений, полученных авторами в основной группе, и в целом соответствует таковому в контрольной группе пациентов. Частота осложнений у пациентов основной группы была достоверно ниже, чем в контрольной. На основании однофакторного анализа авторами было установлено, что частота развития пневмоторакса и гематом находится в прямой зависимости от расстояния от плевры до очага поражения и не зависит от других факторов, что также соответствует мнению других исследователей [10].
Преобладающим гистологическим типом новообразований была аденокарцинома – 5 (25%) в основной группе и 6 (30%) в контрольной группе. Также встречались недифференцированные атипичные клетки, плоскоклеточный рак, микроцеллюлярная карцинома, метастазы, что соответствовало различным эпидемиологическим исследованиям рака легких [13, 14]. Неопластические поражения не были обнаружены у 2/20 (10%) больных в основной группе и у 3/20 (15%) – в контрольной группе. Это были фиброз и организовавшаяся пневмония.
В основной/контрольной группах авторами получены следующие результаты: истинно положительных результатов – 17/16, истинно отрицательных – 1/1, ложноположительных – 1/2, ложноотрицательных – 1/1.
Таким образом, в основной/контрольной группах чувствительность (способность метода давать правильный результат) составила 85/80%; точность (доля правильных результатов среди всех обследованных) – 90/85%. Эти результаты соответствуют данным других авторов при аналогичных исследованиях, а в основной группе даже несколько превосходят [15].
Как видно из таблицы 1, использование роботизированного метода пункционной биопсии позволило существенно сократить время проведения процедуры. С нашей точки зрения и с точки зрения других авторов, этот факт очень важен, так как позволяет снизить степень лучевой нагрузки на пациента, которая значительно выше при интервенционных вмешательствах по сравнению с обычным КТ-исследованием [16].
Для расчета лучевой нагрузки в качестве контрольной точки авторы использовали продукт длительности дозы (Dose-Length Product – DLP) [17]. На основе этого показателя вычисляли эффективную дозу (Е), которая является более точной величиной, основанной на измерениях поглощенной дозы в физических фантомах, имитирующих тело пациента (https://medsoftpro.ru/kalkulyatory/effektivnaya-doza.html). Она рассчитывалась с учетом коэффициента, характеризующего радиочувствительность тканей грудной клетки: k=0,012.
Учитывая среднюю продолжительность биопсии в основной группе 19,4±5,3 мин и в контрольной группе 27,1±6,9 мин, DLР соответственно составил 481,5±11,3 мГр/см и 753,8±12,5 мГр/см (p<0,001), а эффективная доза Е – 5,7±0,8 мЗв и 9,1±1,1 мЗв (p<0,001). Таким образом, нам удалось снизить биологический риск облучения у пациентов основной группы по сравнению с контрольной.
Заключение. Исследование авторов показало, что трансторакальная трепан-биопсия периферических опухолевидных образований легких под контролем КТ является эффективной в плане диагностики процедурой, характеризующейся достаточно низкой частотой осложнений. Чаще всего они проявляются пневмотораксом легкой степени, не требующим дренирования, и гематомами по ходу пункционной иглы, также не требующими каких-либо методов лечения. Недостатком метода пункции «свободной рукой» является облучение врача-интервенционалиста. Однако пациент также получает высокую лучевую нагрузку из-за длительности интервенционной процедуры. Авторы решили эту проблему путем создания роботизированного устройства для биопсии, исключающего присутствие оператора в зоне облучения. Разработанное авторами устройство вследствие более точного продвижения иглы по намеченному треку позволило сократить частоту осложнений, повысить чувствительность и точность метода, сократить время проведения процедуры и, следовательно, снизить лучевую нагрузку на пациента.



