Внимание отечественных и зарубежных ученых к исследованию механизмов токсичности химических факторов окружающей среды на показатели здоровья человека не ослабевает. Доминируют среди ксенобиотиков соли тяжелых металлов в виде различных соединений. С учетом производственных выбросов, а также загрязнения внешней среды транспортными средствами содержание солей тяжелых металлов в экосистеме часто, по данным Роспотребнадзора России, превышает уровень ПДК. Наиболее токсичными среди химических загрязнителей считаются свинец и его соли, которые вызывают многообразие изменений, по мнению ВОЗ. Систематизация и анализ данных являются определяющим фактором приоритетности изучения механизмов их влияния [1–3]. Анализируя эффекты действия соединения свинца на животных и человека, следует отметить факторы риска: загрязнение окружающей среды, стойкость, их способность аккумулироваться в биологических средах и, соответственно, достаточно высокая аккумуляция в живом организме [4–6]. Вызывая гипоксию, ацетат свинца индуцирует развитие процесса перекисного окисления липидов (ПОЛ) и нарушение продукции конечных метаболитов оксида азота NOx как основного вазодилататора. Оксидативный стресс сопровождается развитием дисфункции эндотелия и повышением тонуса сосудов – вазоконстрикцией и гипертензией. Одновременно в условиях окислительного стресса происходит повреждение клеток внутренних органов, в частности почек и печени [7–9]. Важная роль при токсическом поражении почек отводится Na+/K+-АТФ-азе как компоненту натриевого насоса, определяющей реабсорбцию натрия в канальцах почек [10].
Однако на основании существующих данных можно отметить, что совокупные исследования по изучению роли про- и антиоксидантных систем в развитии дисфункции эндотелия и патологии почек и печени, а также эффективности фармакологических препаратов, регулирующих метаболизм оксида азота при свинцовой интоксикации, недостаточно представлены в доступной литературе. Вышеизложенное явилось мотивацией для проведения данного научного исследования.
Цель исследования – изучение механизмов развития токсических эффектов свинцовой интоксикации и их изменения фармакологическими веществами, выполняющими роль регуляторов экспрессии eNOS, в эксперименте у крыс.
Материалы и методы исследования. В исследовании использованы линейные крысы-самцы одной возрастной категории (10–14 месяцев), массой 200–280 г: интактные – контрольные (20 крыс) и на фоне систематического введения раствора уксуснокислой соли свинца (5 мг/кг массы животного парентерально 30 дней, 60 крыс). Интактным животным (20 крыс) и крысам с экспозицией ацетатом свинца производили инъекции фармакологических веществ: аминокислоты L-аргинин (10 мг/кг, Ajinomoto, Япония) и L-NAME (25 мг/кг, «Сигма Олдридж», США). Дизайн исследования: 1-я группа – интактные крысы – контрольная (20 крыс); 2-я опытная группа – 20 крыс с систематической интоксикацией, вызванной парентеральной инъекцией раствора ацетата свинца (5 мг/кг массы тела животного); 3-я группа – 20 крыс с экспозицией ацетатом свинца и L-NAME; 4-я группа – 20 крыс с интоксикацией ацетатом свинца + L-аргинин. Опыты проводили в соответствии с требованиями международных организаций по работе с животными в эксперименте и протоколом №6 от 26.12.2018 г. этического Комитета ИБМИ.
Эксперимент заканчивался у контрольных и опытных крыс забором крови под рауш-наркозом в пробирки с цитратом натрия с последующим центрифугированием для получения плазмы. Эритроцитарную массу, дважды промытую физиологическим раствором, подвергали лизису. При температуре +4оС гомогенизировали извлеченные образцы тканей почек и печени. По данным содержания малонового диальдегида (МДА) определяли концентрацию конечного продукта ПОЛ в гемолизате эритроцитов, в гомогенатах почечной и печеночной тканей по колориметрическому методу T.Аsacawa с тиобарбитуровой кислотой. Оценивали состояние антиоксидантной системы (АОС) организма по активности ее ферментов – каталазы в плазме крови по спектрофотометрическому методу М.А.Королюка (1988) и супероксиддисмутазы (СОД) в гемолизате эритроцитов методом окисления адреналина (Т.В. Сирота, 1999), концентрации ферооксидазы – церулоплазмина (ЦП). Определяли обмен холестерина (ХС) по данным общего ХС (ОХС), холестерина липопротеинов низкой плотности (ХС ЛПНП), холестерина липопротеинов высокой плотности (ХС ЛПВП) и триглицеридов (ТАГ) в плазме крови наборами («Витал», Россия). Активность специфических для органов ферментов: трансаминаз – аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АсАТ), мембранного гамма-глутамилтранспептидазы (ГГТП) и эксреторного энзима – щелочной фосфатазы (ЩФ) – в плазме крови определяли, также используя наборы фирмы «Витал». Конечные метаболиты оксида азота (NOx) в плазме крови исследовали, применяя метод В.А.Метельской (цит. по С.Г. Дзугкоеву) [11].
В эндотелии аорты у подопытных животных всех групп методом вестерн-блотинга исследовали уровень воспроизводства эндотелиальной NO-синтазы (eNOS) на базе биохимической лаборатории ФГБУ «Национальный медицинский исследовательский центр терапии и профилактической медицины» МЗ России. Активность АТФ-азы, активируемой Na и K, изучали в гомогенатах коркового и мозгового слоев почек, а также печени методом J.C.Scow (1957). Рассчитывали показатель активности на 1 мг белка в час (мкмольРн/мг белка/ч, где Рн – неорганический фосфор).
Статистический анализ результатов проводили с помощью программы Microsoft Excel. В соответствии с критерием Шапиро–Уилка полученные данные имели нормальное распределение, поэтому в дальнейшем применяли параметрический метод статистики. Данные были представлены в виде среднего значения (M) и ошибки среднего (±m). Достоверность различий определяли по t-критерию Стьюдента, различие между группами считали статистически значимым при уровне p<0,05. Коэффициенты корреляции определяли по Пирсону.
Результаты исследования и их обсуждение. Экспозиция свинцом биологических систем, включая целостный организм животных и человека, способствует развитию анемии, которая в дальнейшем приводит к гипоксии тканей. В этих условиях возникает дефицит кислорода и его превращение в активные радикалы кислорода (АРК), которые интенсифицируют процесс ПОЛ. Несмотря на присутствие свободнорадикального окисления (СРО) в клетках, в физиологических условиях для обеспечения их нормальной жизнедеятельности активация ПОЛ может стать причиной неблагоприятных проявлений и патологических процессов. При анализе литературных данных учитывали, что тема изучена недостаточно и, как следствие, представлены незначительные сведения о токсических эффектах свинца: активации СРО в крови и клетках внутренних органах, его взаимосвязи с другими процессами метаболизма, включая регуляцию продукции NO, активность эндотелиальной NO-синтазы и участие в этих процессах влияния регуляторов воспроизводства eNOS – L-аргинина и его модифицированного производного – L-NAME. При анализе определенного в результате исследования характера изменений про- и антиокислительной системы на фоне экспозиции ацетатом свинца по данным статистически значимого увеличения концентрации МДА в эритроцитах в клетках почечной и печеночной тканей выявлена интенсификация липопероксидации (табл. 1). АОС организма находится во взаимодействии с процессами СРО. Состояние АОС оценивали по активности СОД, каталазы и концентрации ЦП. Результаты исследования свидетельствуют о нарушении однонаправленности изменения активности ферментов АОС: об уменьшении функциональной активности СОД и, наоборот, о возрастании уровня каталазы и ЦП (табл. 1). Неоднозначность изменения активности ферментов обусловлена различием их молекулярной структуры. Следует отметить, что каталаза оказывается более оберегаемой, чем СОД, так как в ее молекуле присутствуют четыре молекулы гема и 4 НАДФН (никотинамидадениндинуклеотидфосфат).
Как правило, ксенобиотики подвергаются окислению в микросомах паренхиматозной клетки печени, при этом происходят их обеззараживание и выделение с мочой. Анализ результатов исследования позволил отметить, что АРК при интоксикации ацетатом свинца запускают развитие системного оксидативного стресса и одновременно снижение концентрации в плазме крови NOx (табл. 1).
Таблица 1
Влияние регуляторов экспрессии eNOS на характер изменений показателей окислительного стресса и липидного обмена при сатурнизме в эксперименте
|
Показатели |
Единицы измерения |
Контроль |
Ацетат свинца |
Ацетат свинца + L-NAME |
Ацетат свинца + L-аргинин |
|
МДА, эритроциты |
нмоль/мл |
4,74±0,16 |
6,32±0,015а |
6,59±0,03 б,в |
6,05±0,01 г,д |
|
МДА, корковое вещество |
нмоль /мг белка |
3,18±0,22 |
5,54±0,02а |
5,67±0,02 б,в |
3,40±0,01 г,д |
|
МДА, мозговое вещество |
нмоль /мг белка |
4,25±0,059 |
5,33±0,009а |
5,48±0,015 б,в |
5,19±0,009 г,д |
|
МДА, гепатоцит |
нмоль /мг белка |
1,73±0,05 |
3,36±0,007а |
3,52±0,013 б,в |
3,21±0,01 г,д |
|
СОД |
усл.ед. |
88,05±0,07 |
54,94±0,081а |
51,97±0,318 б,в |
57,18±0,38 г,д |
|
Каталаза |
мкат/л |
225,56±29,09 |
382,36±0,31а |
395,41±3,01 б,в |
370,17±3,12 г,д |
|
ЦП |
мг/л |
339,14±6,59 |
432,29±1,14а |
448,6±3,18 б,в |
416,3±3,71 г,д |
|
NOx |
мкмоль |
50,95±0,65 |
29,38±0,029а |
27,33±0,32 б,в |
31,07±0,29 г,д |
|
ОХС |
ммоль/л |
1,88±0,03 |
4,67±0,009а |
5,02±0,014 б,в |
4,32±0,009 г,д |
|
ХС ЛПНП |
ммоль/л |
1,09±0,01 |
4,15±0,02а |
4,54±0,005 б,в |
3,77±0,015 г,д |
|
ХС ЛПВП |
ммоль/л |
0,673±0,01 |
0,27±0,006а |
0,205±0,009 б,в |
0,31±0,001 г,д |
|
ТАГ |
ммоль/л |
0,246±0,011 |
0,55±0,009а |
0,61±0,007 б,в |
0,49±0,007 г,д |
Примечание:
а – р<0,001 – достоверность ацетата свинца относительно контроля; б – р<0,001 – достоверность ацетата свинца + L-NAME относительно контроля; в – р<0,001 – достоверность ацетата свинца + L-NAME относительно ацетата свинца; г – р<0,001 – достоверность ацетата свинца + L-аргинин относительно ацетата свинца, д – р<0,001 – достоверность ацетата свинца + L-аргинин относительно ацетата свинца+ L-NAME.
Корреляционный анализ взаимосвязи между возрастанием концентрации МДА в крови и убыванием уровня NOx демонстрирует наличие отрицательной сильной связи между этими субстратами (r=–0,69, р˂0,001). Причем можно отметить, что большое значение имеет нарушение сигнального пути L-аргинин-NO-синтаза-NO. Образующиеся конечные метаболиты NOx играют решающую роль в осуществлении вазодилататорного действия NO.
В этом плане нами изучались действие L-аргинина и L-NAME на активность ПОЛ, содержание его метаболитов, а также продукцию NOх и экспрессию eNOS. В исследовании, проведенном нами, показана роль увеличенной концентрации МДА в клетках крови и нарушении продукции NOx. Помимо этих изменений, показано нарушение паренхиматозных клеток печени. Для установления причины недостаточного образования NOx исследовали уровень экспрессии eNOS. Данные показали, что L-NAME вызвал активацию процесса ПОЛ, снижение уровня NOx вследствие ингибирования функциональной активности eNOS на 23,9%, в противоположность этому L-аргинин повысил данный показатель на 29,05% (табл.1). Нормализуя про- и антиоксидантную систему, L-аргинин вызвал возрастание продукции и содержание NOх как основных вазодилататоров.
Таким образом, результаты проведенного исследования свидетельствуют об участии аминокислоты L-аргинина и его модифицируемого производного – L-NAME в управлении степени воспроизводства эндотелиальной NO-синтазы.
Свою вспомогательную роль в нарушении биодоступности L-аргинина к NO-синтазе играет нарушение в метаболизме холестерина: повышение уровня ОХС и атерогенных β-липопротеинов (табл. 1). Полученные результаты при интоксикации ацетатом свинца показали рост в сыворотке крови содержания ОХС, ХС ЛПНП и снижение ХС ЛПВП (табл.1). Дефицит NOх сопровождается гемодинамическими изменениями, в частности в нефроне, и угнетением активности АТФ-азы, активируемой Na и K в обоих слоях почек, при интоксикации ацетатом свинца и его комбинации с L-NAME (рис. 1).
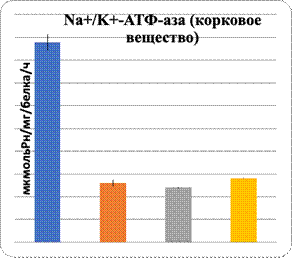
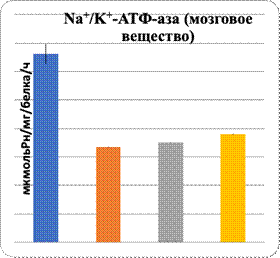
Рис. 1. Характер изменений активности Na+/K+-АТФ-азы при сатурнизме под влиянием регуляторов экспрессии eNOS
Данные показали повреждение паренхимы печени при интоксикации свинцом и в комплексе с L-NAME. Показаны увеличение в них уровня МДА и понижение активности Na+/K+-АТФ-азы. Показателем нарушения функции паренхиматозных клеток печени являются изменения уровня органоспецифических ферментов в плазме крови: АлАТ, АсАТ, ГГТП и щелочной фосфатазы (рис. 1, 2). На фоне введения L-аргинина подопытным животным произошли снижение интенсивности ПОЛ в клетках почечной и печеночной тканей и, наоборот, возрастание активности Na+/K+-АТФ-азы в них (рис. 1). Показателем позитивного влияния L-аргинина является снижение в плазме крови уровня активности ферментов, специфических для органов: АлАТ, АсАТ, ГГТП и ЩФ (рис. 2).
Таким образом, метаболическими показателями нарушения гидрофобности паренхиматозных клеток печени являются повышение их проницаемости по данным уровня активности органоспецифических ферментов плазмы крови и изменения активности Na+/K+-АТФ-азы в паренхиматозных клетках печени.
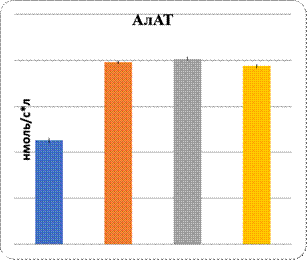
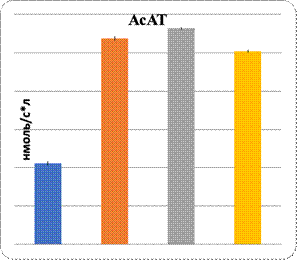
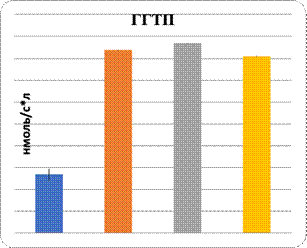
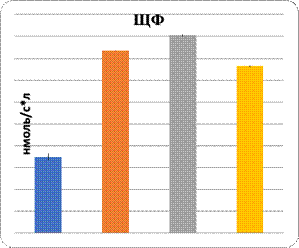
Рис. 2. Характер изменений активности органоспецифических ферментов под влиянием регуляторов экспрессии eNOS
Обсуждая эти результаты, можно утверждать, что свинцовая интоксикация вызывает активацию липопероксидации и дефицит NOх вследствие более низкого уровня воспроизводства eNOS. Эти биохимические изменения лежат в основе механизмов нарушения функционального состояния эндотелия сосудов и микроциркуляции – основных патогенетических звеньев нефропатии и гепатопатии при сатурнизме.
Заключение. На фоне экспозиции ацетатом свинца выявлено повышение активности СРО в эритроцитах, в гомогенатах клеток коркового и мозгового слоев почечной ткани и гепатоците. Оксидативный стресс характеризуется сниженным уровнем в плазме крови NOx вследствие пониженного уровня экспрессии NO-синтазы при свинцовой интоксикации и ее комбинации с L-NAME. Исследование влияния индуктора экспрессии eNOS – L-аргинина показало его стимулирующий эффект на процесс образования синтазы оксида азота и повышение содержания NOx, тогда как L-NAME ингибировал уровень экспрессии eNOS. Нормализация метаболизма NO, гемодинамики и обмена холестерина способствовала улучшению функции почек и печени, о чем свидетельствуют данные активности Na+/K+-АТФ-азы и уровня трансаминаз, мембранных и экскреторных ферментов в сыворотке крови при свинцовой интоксикации.



