Биоритмология как наука начала своё развитие с середины ХХ века, с работ F. Halberg (1960), автора понятия об околосуточных (циркадианных) ритмах и базовых представлений о временной координации физиологических функций организма. Ученый определил некоторые принципы исследований околосуточных ритмов в иммунологии на примере циркадианного характера восприимчивости мышей после введения бактериального эндотоксина [1, с. 675-725]. Известны также труды Ф.И. Комарова (1966) с соавторами «Суточные ритмы физиологических процессов в здоровом и больном организме» и других авторов - Чибисова С.М., Рапопорт С.И., Благонравова М.Л. и др., чьи работы посвящены изучению циркадианных ритмов как важного фактора в эндогенной системе гомеостаза [2, с. 203-648].
Важно отметить, что внутренние «часы» управляют иммунной системой, но и иммунная система регулирует функцию хронометража циркадианных часов. Модулирующее влияние иммунной системы на циркадианное хронометражирование и лежащий в его основе часовой механизм наблюдались в исследованиях, демонстрирующих, что введение липополисахарида индуцирует фазовые сдвиги ритма активности у мышей [3] и подавляет экспрессию генов супрахиазматического ядра (центральных циркадианных часов) в головном мозге (белок циркадного ритма 2 и витамин Д3-связывающий белок) [4] через изменения синтеза провоспалительных цитокинов.
В 2017 году лауреатами Нобелевской премии в номинации «Физиология и медицина» стали три американских учёных: Джеффри Холл (Jeffrey C. Hall), Майкл Росбаш (Michael Rosbash) и Майкл Янг (Michael W. Young), «за открытие и исследование молекулярных механизмов, управляющих циркадианными ритмами», что подчеркивает важность проведения исследований в области биоритмов человека.
Цель исследования: изучить роль цитокинов, как компонента иммунной системы, в процессах регулирования циркадианных ритмов организма.
Материалы и методы исследования
Поиск научных работ, посвящённых заявленной теме «Циркадианные ритмы цитокинов», опубликованных в период с 1960 по 2023 год и представленных в базах данных PubMed, Scopus, WoS, CochraneLibrary, eLibrary. Ключевые слова: цитокины, циркадианные ритмы, гомеостаз, иммунная система – были подобраны с учётом контент-анализа статей, представленных в международных базах научного цитирования.
Результаты исследования и их обсуждение
Циркадианными называются ритмы, отражающие ежедневные колебания в поведении и физиологии, подготавливающие организм к тому, чтобы лучше реагировать и предвидеть изменения в окружающей среде, которые являются следствием вращения Земли [2; 5]. Ритмическая синхронизация организма происходит через поведенческие циклы отдыха-активности и путем сложного и не до конца понятного взаимодействия в рамках нейро-иммуно-эндокринной системы [6; 7]. Немаловажную роль в этом процессе играет иммунная система, одним из значимых компонентов которой является система эндогенных полипептидных медиаторов межклеточного взаимодействия, регулирующих физиологические и патофизиологические процессы организма и ассоциированные с ними метаболические нарушения, - цитокинов.
Именно цитокины выступают многоуровневой системой, объединяющей все системы и органы. На молекулярном уровне они состоят из множества наборов транскрипционных факторов, которые приводят к авторегуляторным обратным связям транскрипции-трансляции (рис. 1).
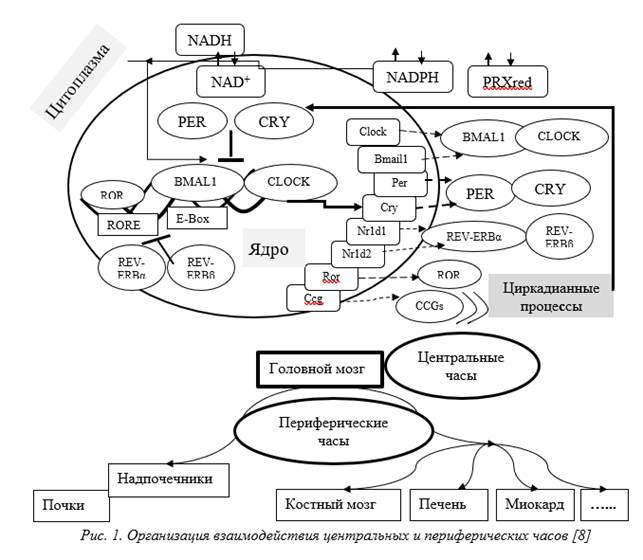
Организация поддержания циркадианных ритмов включает в себя скоординированную работу нейронов супрахиазматического ядра гипоталамуса (центральные часы, главный «кардиостимулятор» организма) [9; 10] и «часов» в периферических тканях, действующих через симпатические нервы для организации тканеспецифических колебаний экспрессии молекул адгезии и хемокинов эндотелиальными клетками [10] (рис. 2). Эти ритмы согласуются с эндогенными колебаниями экспрессии цитокинов иммунными и не иммунными клетками, что повышает вероятность реализации их эффектов действия на определенных этапах циркадианного цикла [11; 12].
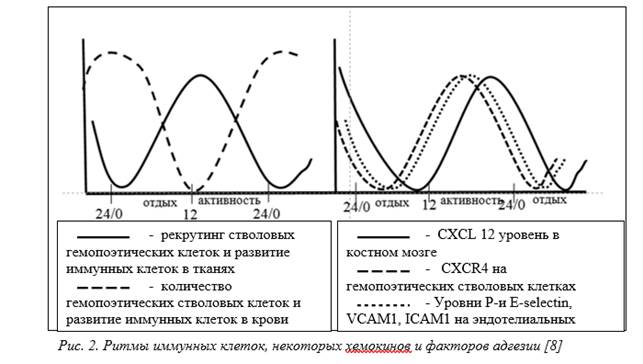
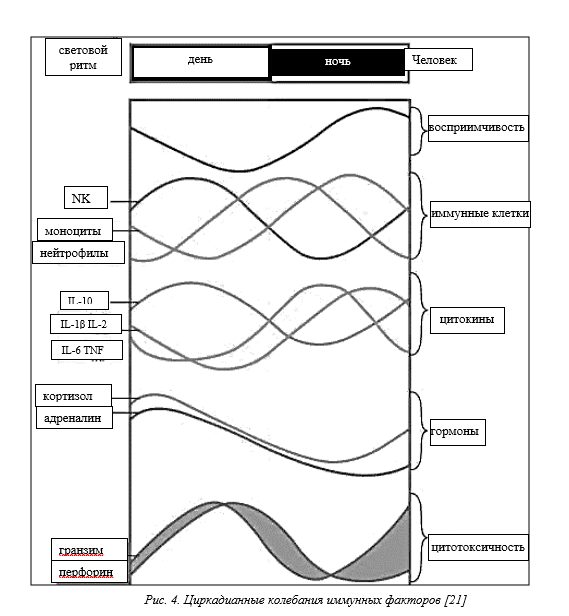
Клеточные и гуморальные компоненты иммунного ответа демонстрируют противоположные ритмы: количество гемопоэтических стволовых и прогениторных клеток и большинства зрелых лейкоцитов (за исключением эффекторных CD8+ Т-клеток) [13] достигают пика в циркуляции в фазе покоя (у человека ночью) со снижением в крови в период активности за счет перехода в ткани [11] (рис. 2). Зрелые иммунные клетки выходят из костного мозга в кровь в начале фазы покоя [14]. Важность этого наблюдения подтверждается увеличением восприимчивости к сердечно-сосудистым осложнениям, как одному из факторов инсульта и инфаркта миокарда, достигающим максимума в это время [15].
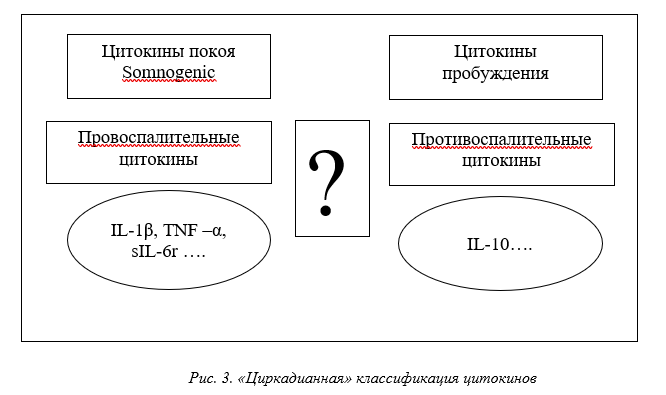
Цикл сна/бодрствования является одним из наиболее заметных проявлений циркадианного ритма и тесно взаимодействует с системой цитокинов двунаправленным образом. Хотя прямая роль чередования фаз сна и бодрствования была показана только для IL-1β, TNF, IFNγ [16] и IL-6 [17], но на основе этого все провоспалительные цитокины часто классифицируются как сомногенные [18], и базальные уровни этих цитокинов в плазме крови увеличиваются в фазу покоя, достигая максимума в ранние утренние часы. Противовоспалительные цитокины, такие IL-10, активизируются после пробуждения и подавляют сон (рис. 3).
Важно отметить, что индивидуальный анализ суточных кривых содержания цитокинов в периферической крови позволяет говорить о более сложных закономерностях, чем двухфазные изменения день-ночь. По данным Young M.R. (1995), количество IL-2 в сыворотке крови образует единый пик примерно в полдень, а IL-10, TNF и GМ-CSF демонстрируют двухфазный паттерн [19]. У испытуемых первый пик TNF приходился на 07:30, а второй - на 13:30, что не позволяет однозначно относить его к группе цитокинов покоя. Уровни IL-10 также демонстрировали двухфазную картину, с одним пиком в 07:30 и вторым 12 ч спустя в 19:30. Эти результаты показывают, что временные паттерны уникальны для каждого цитокина, как правило, с дневными максимумами и ночными минимумами.
Известны данные о связи сна с динамикой колебания IL-2 (увеличение продукции во время сна [20]) и sIL-6r. Сон достоверно усиливал концентрацию sIL-6r, превышая уровень бодрствования на 70% в конце сна.
Этот рост был обусловлен увеличением протеолитически расщепленного, а не дифференциально сплайсированного варианта sIL-6r. Сон не влиял на моноциты, продуцирующие IL-6, плотность mIL-6r или концентрацию sgp130. Селективное увеличение sIL-6r подразумевает повышенную транссигнальную способность, в результате чего сон отчетливо расширяет профиль действия IL-6, позволяя комплексно воздействовать на мозг и периферические органы [22]. Вышеуказанные эффекты отменялись при длительном бодрствовании.
Уровни синтеза цитокинов не только выступают факторами, подчиняющимися суточным закономерностям, но и при клиническом или субклиническом дисбалансе способны влиять как на главный центр циркадианных часов – супрахиазматическое ядро в головном мозге, так и способствовать потере синхронизации между главным центром и периферическими «часами» [12].
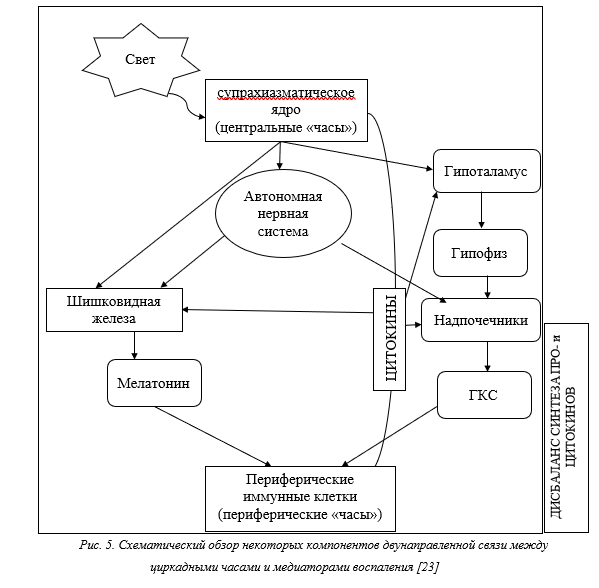
В системе регуляции циркадианных ритмов значимость гормонального уровня играет не последнюю роль, однако все больше данных указывает на наличие определенной автономности суточных ритмов синтеза цитокинов. В частности, продемонстрировано, что циркадные ритмы секреции цитокинов сохраняются в постоянных условиях культивирования in vitro, убедительно указывая на то, что местные макрофагальные внутренние часы, а не системные сигналы преимущественно регулируют эти ритмы иммунных клеток [24].
Данные исследования обладают достаточной перспективностью, поскольку циркадианные колебания компонентов иммунной системы потенциально способны влиять на начало заболевания и эффективность методов лечения [8; 10; 25].
Выводы
Иммунная система играет ведущую роль в регуляции циркадианных ритмов организма, чему имеется достаточное количество подтверждений, однако до сих пор этот вопрос является недостаточно изученным.
Наиболее ярким примером проявлений циркадианного ритма, обусловленного влиянием цитокинов, является цикл смены сна и бодрствования. Чередование фаз сон/бодрствование обусловлено влиянием провоспалительных (сомногенных) цитокинов IL-1β, TNF, IFNγ и IL-6 - их базальные уровни в плазме крови увеличиваются в фазу покоя, достигая максимума в ранние утренние часы. Противовоспалительные цитокины активизируются после пробуждения и подавляют сон, к ним относится IL-10.
В последние годы большое внимание уделяется раскрытию вклада провоспалительных и противовоспалительных цитокинов в патогенез различных заболеваний, а также прогнозированию исхода заболевания и оценке эффективности проводимой терапии.



