Основным вектором развития катарактальной хирургии в настоящее время считается снижение интраоперационной травмы и инвазивности операционного вмешательства [1, 2]. Основной гидродинамической проблемой при ФЭ является феномен ПОВ, возникающий вследствие прорыва закупоривших наконечник факоиглы катарактальных масс далее в аспирационную линию. ПОВ сопровождается значительными колебаниями давления в передней камере глаза, которые отрицательно сказываются на целостности внутриглазных структур [3, 4].
Одним из ведущих способов противодействия ПОВ является управление инфузионным потоком. Традиционно подача инфузионной жидкости происходит под действием гравитационных сил, при этом емкость со сбалансированным солевым раствором помещается на определенной высоте над уровнем глаза. При обеспечении инфузии под действием гравитационных сил отсутствует возможность быстрой регулировки инфузионного давления (изменения высоты инфузионной стойки) для поддержания стабильной передней камеры [5].
С целью снижения ПОВ во многих современных факоэмульсификаторах используется «форсированный» тип инфузии, при котором в инфузионной емкости при помощи различных механизмов создается положительное давление. Управление инфузией при этом осуществляется в зависимости от изменения определенных гидродинамических параметров хирургической системы [6, 7]. В современной хирургической системе Centurion Vision System (Alcon) реализована технология управления инфузионным потоком на основании изменения показаний датчиков инфузионного давления, которые расположены в одноразовой хирургической кассете и ультразвуковой рукоятке факоэмульсификатора [8]. По данным экспериментальных и клинических исследований, данная технология показала достаточно хорошую стабильность передней камеры с минимальными колебаниями ВГД [9–11].
В аспекте достоверной оценки гидродинамических условий операции и рационального управления инфузией с целью снижения ПОВ важен контроль не только инфузионного давления, как у Centurion Vision System, но и ряда других параметров хирургической системы: скорости жидкости в аспирационной и инфузионной магистралях, а также вакуума аспирационной линии. Интраоперационный мониторинг данных параметров может способствовать более точной и достоверной оценке проходимости факоиглы и своевременной компенсации ПОВ. С появлением неинвазивных ультразвуковых датчиков-расходомеров появилась возможность интраоперационной оценки динамики аспирационного потока, в том числе во время ПОВ. Детальный контроль изменения скорости аспирационного потока позволяет не только оценивать фактические колебания передней камеры при ПОВ, но и прогнозировать объем ПОВ.
Создание новых способов адаптивного управления инфузионным потоком на основании совмещения механизмов форсированной инфузии и комплексной оценки проходимости факоиглы посредством бесконтактного мониторинга скорости потоков в магистралях системы – актуальный шаг в обеспечении гидродинамической стабильности ФЭ и снижении негативного воздействия ПОВ на внутриглазные структуры.
Сотрудниками кафедры офтальмологии БГМУ совместно с инженерами отдела микрохирургического оборудования ЗАО «Оптимедсервис» на базе российской офтальмологической системы Оптимед Профи (РУ № ФСР 2011/11396 от 11.11.2013 г.) разработан новый способ адаптивного управления инфузией при ФЭ (Патент РФ на изобретение № 2788289 от 17.01.2023 г.) [12]. Способ позволяет регулировать инфузионное давление на основании характерных для определенной гидродинамической ситуации изменений скорости аспирационного и инфузионного потоков, а также уровня вакуума в аспирационной линии.
С позиции оценки эффективности нового способа очень важна количественная характеристика ПОВ с помощью различных параметров, важное место среди которых занимают амплитуда ПОВ и время восстановления ВГД до базового уровня [13, 14].
Актуальным является сравнительный анализ перечисленных количественных параметров ПОВ при экспериментальной ФЭ in vitro в тест-камере с применением нового способа адаптивного управления инфузией и существующего способа управления инфузией на базе хирургической системы Centurion Vision System.
Цель исследования – провести количественную оценку ПОВ при ФЭ с новым способом адаптивного управления инфузией и ФЭ с известным способом управления инфузией на базе хирургической системы Centurion Vision при эксперименте in vitro в тест-камере.
Материал и методы исследования
Исследование проводилось на базе кафедры офтальмологии с курсом ИДПО БГМУ, совместно с отделом микрохирургического оборудования ЗАО «Оптимедсервис», г. Уфа. Экспериментальная ФЭ с моделированием ПОВ выполнялась in vitro в стандартной силиконовой тест-камере и включала 2 серии опытов. Первая серия была выполнена на базе хирургической системы Оптимед Профи с новым способом адаптивного управления инфузией, вторая – с применением хирургической системы Centurion Vision с существующим способом управления инфузией.
Для обеих серий задавались идентичные настройки хирургических систем, превышающие стандартные клинические условия операции: предел вакуума – 500 мм рт. ст., скорость аспирационного насоса – 45 мл/мин, целевое ВГД – 50 мм рт. ст., калибр факоиглы – 20G, внутренний диаметр трубок аспирационной и инфузионной магистралей 1,3 мм и 3,25 мм соответственно. Для получения более точной и объективной информации мы намеренно не использовали ультразвук. В каждой серии ПОВ моделировалась не менее 30 раз.
Работа нового способа адаптивного управления инфузией заключается в том, что контроллер хирургической системы на основании мониторинга уровня вакуума в аспирационной линии, скорости инфузионного и аспирационного потоков распознает как минимум три гидродинамических состояния в магистралях системы: состояние «проходимая факоигла», состояние «окклюзия факоиглы» и состояние «прорыв окклюзии». При этом каждому из данных состояний соответствует определенный режим инфузионного давления. В рамках эксперимента необходимое инфузионное давление обеспечивалось с помощью механизма «форсированной» инфузии (нагнетанием воздуха в инфузионную емкость).
Для мониторинга скорости инфузионного и аспирационного потоков использовались цифровые ультразвуковые датчики-расходомеры Sonoflow CO.056/035 (Sonotec GmbH, Германия) (рис. 1а). Обработка информации с датчиков проводилась при помощи оригинального программного обеспечения – Sonoflow Software (рис. 1б). Перед экспериментами была проведена калибровка датчика под характеристики трубок в соответствии с инструкцией производителя (Sonotec Сalibration Guide).
При моделировании ПОВ тест-камеру герметично надевали на рабочую часть рукоятки факоэмульсификатора и соединяли с датчиком давления при помощи канюли. При работающем насосе пережимали линию аспирации в 5 см от рукоятки (имитируя состояние окклюзии), через 2 секунды после достижения максимального значения вакуума трубку разжимали, имитируя ПОВ.
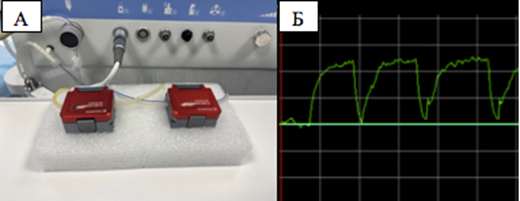
Рис. 1. Расположение ультразвуковых датчиков-расходомеров (А) и интерфейс программного обеспечения датчика во время записи потока (Б)
Сигнал с датчика давления оцифровывали с помощью осциллографа и визуализировали в виде кривой с помощью программы PicoScope 6 (рис. 2). Дополнительно производили оцифровку и визуализацию сигнала датчика вакуума аспирационной линии. Применяемая схема эксперимента позволила стандартизировать условия между группами и наиболее полно отвечала поставленной задаче.
Амплитуда ПОВ оценивалась как разница между максимальным давлением в тестовой камере при полной окклюзии и минимальным давлением после прорыва окклюзии. За время восстановления ВГД принимался период после прорыва окклюзии, за который ВГД стабилизировалось до базового уровня.
Для статистической обработки использовался пакет Statistica v. 11, Statsoft (США). Данные представлены в виде M±Sd, где M – выборочное среднее, Sd – стандартное отклонение. Межгрупповое сравнение количественных параметров проводилось с помощью непараметрического критерия Манна–Уитни. Различия показателей считались статистически значимыми при уровне значимости p<0,01.
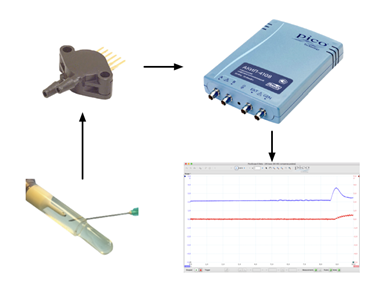
Рис. 2. Контроль давления в силиконовом тест-колпачке и уровня вакуума в аспирационной линии
Результаты исследования и их обсуждение
При визуальном сравнении осциллограмм с динамикой давления в тест-колпачке в серии с применением нового способа адаптивной инфузии отмечалось значительно меньшее время восстановления ВГД до базового уровня, при этом разница в амплитуде ВГД между сериями была невыраженной (рис. 3).
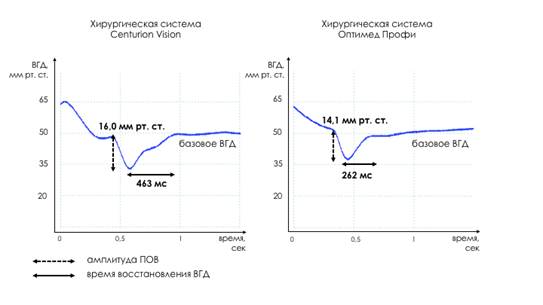
Рис. 3. Характерная динамика давления в тест-колпачке при моделировании ПОВ в каждой из серий опыта
Значение амплитуды ПОВ в серии с новым способом адаптивного управления инфузией составило 14,3 0,29 мм рт. ст., а при применении известного способа управления инфузией – 16,27
0,29 мм рт. ст., а при применении известного способа управления инфузией – 16,27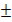 0,23 мм рт. ст. (рис. 4). При моделировании ПОВ с применением нового способа адаптивного управления инфузией наблюдалась меньшая амплитуда ПОВ по сравнению с известным способом. Различия между сериями имели статистическую значимость (p<0,01).
0,23 мм рт. ст. (рис. 4). При моделировании ПОВ с применением нового способа адаптивного управления инфузией наблюдалась меньшая амплитуда ПОВ по сравнению с известным способом. Различия между сериями имели статистическую значимость (p<0,01).
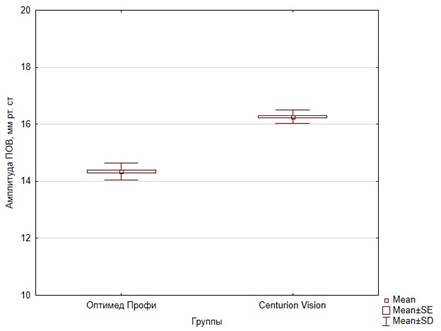
Рис. 4. Сравнение амплитуды ПОВ между сериями
При анализе времени восстановления ВГД до базового уровня в серии с новым способом адаптивного управления инфузией данный показатель составил 262,8±17,5 мс, а при использовании известного способа управления инфузией – 462,1±16,5 мс (рис. 5). В серии с новым способом отмечалось меньшее время после прорыва окклюзии, необходимое для восстановления ВГД до базового уровня. Различия между сериями по данному показателю также имели статистическую значимость (p<0,01).
При анализе полученных результатов необходимо учитывать строгие экспериментальные условия, включая применение фиксированного объема тест-камеры для всех случаев ПОВ, а также достижение предельного уровня вакуума перед каждым прорывом окклюзии. В клинических условиях ФЭ на ПОВ могут оказывать влияние множество факторов, таких как плотность ядра хрусталика, глубина передней камеры, состояние связочного аппарата хрусталика, размер разрезов, а также наличие сопутствующих офтальмологических заболеваний.
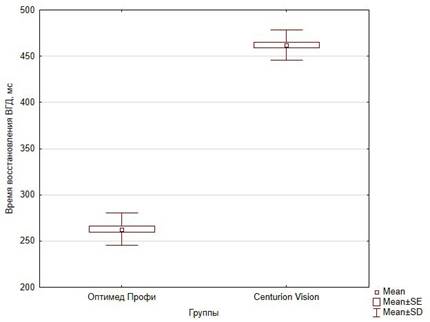
Рис. 5. Сравнение времени восстановления ВГД между сериями
Тем не менее, полученные результаты в рамках лабораторного эксперимента in vitro с применением нового способа продемонстрировали меньшую амплитуду ПОВ и сокращение времени восстановления ВГД до базового уровня, что предположительно может повысить безопасность ФЭ в клинических условиях и снизить колебания ВГД, связанные с ПОВ.
Выводы
Таким образом, экспериментальное использование нового способа адаптивного управления инфузией позволяет снизить амплитуду ПОВ и уменьшить время, необходимое для восстановления ВГД до базового уровня.
Следующим этапом планируется анализ эффективности и безопасности разработанного способа при структурно-морфологическом исследовании препаратов роговицы и сетчатки кроликов после экспериментальной ФЭ.



