В последнее время отмечается увеличение частоты таких заболеваний, как ожирение и метаболический синдром. В странах Европы избыточная масса тела и ожирение встречаются почти у 50% взрослых и до 26% детей [1]. Многочисленные исследования, касающиеся данной темы, показали, что на рост частоты данной нозологии оказывает влияние ряд разнонаправленных факторов, возникающих на этапах онтогенеза: генетические, конституциональные, особенности питания, двигательной активности, возрастные особенности. Ожирение в подростковом возрасте связано с формированием целого ряда эндокринных и метаболических нарушений, таких как резистентность к инсулину,диабет 2-го типа,дислипидемия,синдром поликистозных яичников, легочные, ортопедические и психологические расстройства [2, 3, 4].
Опубликованные исследования показывают, чтодефицит микроэлементов, таких как селен, может увеличить абсорбцию токсичных металлов. Особенно подвержены риску развитиядефицита селенадети, находящиеся на низкобелковых диетах, припарентеральном питании, больные хроническими или онкологическими заболеваниями. При этом данные о содержании селена у детей и подростков с ожирением весьма противоречивы [5]. Также известно, что у людей с избыточным весом или ожирениемантиоксидантнаязащита обычно хуже, а уровеньокислительного стрессаповышен [6].
В популяции больных ожирением широко распространен дефицит витамина D [7]. Факторы, влияющие на снижение синтеза витамина D на фоне избыточной массы тела, до сих пор являются предметом дискуссии [8]. Некоторые исследователи указывают, что на развитие гиповитаминоза D при ожирении оказывают влияние низкий уровень физической активности и сниженное потребление витамина D. Результаты научных исследований прямо указывают на роль дефицита витамина D в формировании нарушения чувствительности тканей к инсулину, инсулинорезистентности и возникновении системного воспаления [9]. Дети с ожирением представляют собой группу риска по дефициту витамина D, что влечет за собой определенные риски для здоровья [10].
Цель исследования – проведение комплексной оценки уровней витамина D в крови и селена в моче у подростков с ожирением с учетом фактора техногенного загрязнения территории проживания, а также для определения корреляции содержания данных микронутриентов с состоянием липидного и углеводного обмена.
Материалы и методы исследования. В исследование включены 164 мальчика-подростка с конституционально-экзогенным ожирением (КЭО) 1–3-й степени (sds ИМТ от 2,0 до 3,9) в возрасте 14–16 лет. Все дети европеоидной расы, постоянно проживают в Ростовской области. 1-ю группу составили 98 мальчиков, проживающих в условиях города (г. Ростов-на-Дону, Новочеркасск, Таганрог, Шахты, Волгодонск) с высоким и очень высоким уровнем загрязнения окружающей среды ксенобиотиками. Во 2-ю группу входили 66 подростков с конституционально-экзогенным ожирением (КЭО) 1–3-й степени (sds ИМТ от 2,0 до 3,9), проживающих в районах сельской местности без признаков загрязнения окружающей среды. Критериями исключения явилось наличие хронических и острых воспалительных процессов на основании осмотра и лабораторного исследования, прием различных витаминов, БАД, медикаментов и соблюдение специальных диет в течение 6 месяцев.
Обследование пациентов включало изучение семейного анамнеза, характера пищевого поведения и физических нагрузок. Проводили антропометрию и расчет индекса массы тела (ИМТ). Был собран стандартизированный анамнез и проведено физикальное обследование всех пациентов. Антропометрические измерения проводили в ходе профилактического медицинского осмотра подготовленные медицинские работники в соответствии со стандартизированным протоколом, разработанным ВОЗ. Физическое развитие детей оценивали с использованием программы WHO Anthro Plus (2009). Интерпретацию полученных значений Z-score проводили по критериям: избыточная масса тела – при SDS от +1 до +2, ожирение – при SDS >+2.
Уровень 25(ОН)D (VD) в сыворотке крови определяли методом иммуноферментного анализа. За нормальное содержание витамина принимали концентрацию 25(ОН)D>30 нг/мл, недостаточное – 21–30 нг/мл, дефицит – менее 20 нг/мл.
Биохимические исследования были проведены с помощью методов иммуноферментного анализа на анализаторе «AliseiQ.S.», Radim, Италия. Для оценки инсулинорезистентности (ИР) применялся индекс НОМА-IR (Homeostasis Model Assessment of Insulin Resistance), который рассчитывался по формуле: НОМА=(уровень глюкозы (ммоль/л) х уровень инсулина (мкМЕ/мл))/22,5. Для оценки показателей жирового обмена определяли: содержание общего холестерина, триглицеридов, холестерин-липопротеидов высокой плотности (Х-ЛПВП) и низкой плотности (Х-ЛПНП). Исследования проводили на автоматическом анализаторе с использованием стандартных реактивов. Коэффициент атерогенности (КА) определяли по формуле Friedewald. В норме указанный индекс составляет 2‒3.
Содержание селена (Se) определяли в утренней моче натощак атомно-абсорбционным методом на приборе «Квант-Z» (ООО «Кортэк», РФ).
Для сравнения результатов биохимических и гормональных исследований была привлечена группа контроля из 40 здоровых подростков, имеющих нормальную массу тела и проживающих в благоприятных районах.
Результаты биомедицинских исследований обрабатывали с помощью лицензионного пакета Statistica 6,0 в среде MeoCape 11.4.2, непараметрического корреляционного анализа по Спирмену. Достоверность показателей определяли по коэффициенту Стьюдента (t), данные имели нормальное распределение. За критический уровень значимости принято значение p<0,05.
Результаты исследования и их обсуждение. Результаты исследования показали, что дефицит витамина D был выявлен у 38,5% обследованных детей, недостаточность – у 36,1%. У 24,1% подростков отмечалось нормальное содержание витамина D в сыворотке крови. Пониженное содержание витамина D у мальчиков с ожирением в 1-й группе встречалось в 2,5 раза чаще, чем у детей 2-й группы (р=0,002), а его оптимальный его уровень – в 2,5 раза реже, чем у подростков из экологически благополучных районов (р=0,001) (табл. 1). Эти данные свидетельствовали о негативном влиянии техногенного загрязнения окружающей среды на уровень данного микронутриента у подростков.
Таблица 1
Обеспеченность витамином D у подростков с ожирением в зависимости от наличия фактора техногенного загрязнения в районе их проживания
|
Показатель
|
Уровень 25(OH)D |
||
|
<20 нг/мл (n=64) |
20–29 нг/мл (n=60) |
>30 нг/мл (n=40) |
|
|
1-я группа(n=98) |
52/53,1%* |
38/38,7% |
8/8,2%* |
|
2-я группа(n=68) |
22/32,3% |
24/35,3% |
20/29,4% |
Примечание: * – статистически значимые различия между 1-й и 2-й группой (при р<0,05).
Анализ содержания селена в моче у детей с ожирением (рис. 1) выявил выраженное снижение его уровня по сравнению с контролем (5,8±2,2 мкг/л против 12,4±3,1 мкг/л, р=0,012), при этом уровень его у детей 1-й группы был достоверно ниже, чем во 2-й (3,6±1,4 мкг/л против 6,1±1,6 мкг/л, р=0,02). Следовательно, определялись те же тенденции негативного воздействия экологического неблагополучия окружающей среды на обеспеченность данным микроэлементом у обследуемых подростков, как и при анализе VD-статуса.
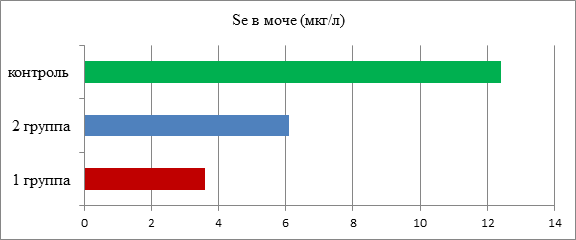
Рис. 1. Анализ содержания селена в моче у детей с ожирением
В группах были сопоставлены значения показателей липидного и углеводного обмена в зависимости от района проживания (табл. 2).
Таблица 2
Оценка показателей липидного, углеводного обмена и изучаемых микронутриентов (25(OH) D в крови, Se в моче) у подростков с ожирением
|
Показатель |
Группы обследованных подростков |
||
|
1-я группа (n=66) |
2-я группа (n=60) |
Контроль (n=40) |
|
|
sds ИМТ |
3,3±0,91 |
2,9±0,82 |
1,1 ±0,1 |
|
ХС, ммоль/л |
5,8±0,7 |
5,3±0,6 |
4,9±0,8 |
|
ТГ, ммоль/л |
1,6±0,9 |
1,1±0,6 |
0,9±0,3 |
|
Глюкоза, ммоль/лl |
5,8±0,7 |
5,4±0,4 |
4,9±0,2 |
|
Инсулин, мкЕд/мл |
21,2±4,1 * |
18,1±2,9 |
11,4±1,8 |
|
HOMA-IR |
6,6±2,9* |
4,9±2,8 |
2,4±1,6 |
|
25(OH)D
|
15,6±3,8 * |
26,9±4,1 * |
38,1±5,6 |
|
Se в моче, мкг/л |
3,6± 1,4 * |
6,1 ± 1,6 * |
12,4 ± 3,1 |
Примечание: *– статистические различия с контрольной группой (при р<0,05).
Анализ полученных данных показал, что, несмотря на отсутствие существенных межгрупповых различий средних значений ИМТ, у подростков 1-й группы отмечались более высокие показатели НОМА-IR по сравнению с мальчиками с ожирением из сельских районов (p<0,05). Значимых отличий уровня холестерина и триглицеридов отмечено не было. Однако определялась тенденция к их повышенным значениям у детей 1-й группы (p>0,05). У детей, проживающих на экологически менее благополучных территориях, определялись также более низкие значения витамина D в сыворотке крови и селена в утренней моче по сравнению с показателями 2-й и контрольной групп (p<0,05).
Так же как и в предыдущих исследованиях [11], установлено, что у подростков с ожирением уровень Se в моче снижен по сравнению с контрольной группой, отмечена обратная корреляция содержания Se в моче с уровнем инсулина в крови (R=–0,48, р=0,041) и индексом HOMA-IR (R=–0,62, р=0,023). Снижение содержания Se при ожирении у подростков независимо от половой принадлежности и возраста было показано и в других исследованиях, где приведены свидетельства обратной корреляционной зависимости между уровнем Se и НОМА-IR [12].
При анализе корреляции уровня витамина D с показателями липидного и углеводного обмена отмечена отрицательная связь с показателями глюкозы, инсулина и НОМА-IR (табл. 3). При этом отмечалась достоверная положительная корреляционная зависимость уровня витамина D от содержания селена в моче (p=0,04).
Таблица 3
Корреляционные связи уровня 25(ОН)D в крови с уровнем селена в моче, показателями липидного и углеводного обмена у подростков с ожирением
|
Показатель |
25(ОН)D, нг/мл |
|
|
R |
р |
|
|
sds ИМТ |
–0,52 |
0,02 |
|
Глюкоза, ммоль/л |
–0,33 |
0,04 |
|
Инсулин, мкЕд/мл |
–0,38 |
0,02 |
|
HOMA-IR |
–0,44 |
0,01 |
|
ХС, ммоль/л |
–0,31 |
0,05 |
|
ТГ, ммоль/л |
–0,22 |
0,08 |
|
Селен в моче, мкг/л |
0,44 |
0,04 |
Результаты согласуются с данными ряда авторов, выявивших более низкие уровни Se в сыворотке крови детей с ожирением в сравнении с детьми с нормальной массой тела [13].Что касается содержания селена в моче – широко используемой матрицы для биомониторинга, то колебания концентрации селена в моче могут быть связаны с различными географическими регионами и особенностями питания. Некоторые противоречия в результатах исследований, обусловленные разнородным возрастно-половым составом обследуемых, в исследовании были нивелированы за счет достаточно однородной группы подростков мужского пола. Возможно, ожирение приводит к снижению концентрации Se в моче (меньшее потребление, меньшее содержание в сыворотке).Однако, на взгляд авторов, следует проявлять осторожность, говоря о дефиците селена в отношении эпидемиологических, диетологических, токсикологических исследований и исследований в области общественного здравоохранения.
Существует мнение, что корреляция антропометрических и биохимических маркеров сердечно-сосудистых рисков со снижением уровня витамина D не является достоверной. Более значимыми причинами их возникновения являются малоподвижный образ жизни, нерациональное питание, низкая физическая активность, что впоследствии приводит к прогрессивному накоплению жировой массы. Полагают, что именно ожирение, а не недостаточная обеспеченность витамином D, положительно коррелирует с дислипидемией. Однако результаты авторов согласуются с данными авторов, которые описывают достоверную связь низкого уровня витамина D c показателями жирового обмена, показателями углеводного обмена и развитием сахарного диабета 2-го типа [14].
Выявленные нами корреляции между уровнем витамина D и селена могут носить как косвенный, так и прямой характер. Возможно, что сниженный уровень данных микронутриентов присущ популяции детей с ожирением, и, безусловно, на него оказывают влияние пищевые привычки, диетические ограничения, режим физической активности. Возможно, сама по себе недостаточность данных элементов может быть предрасполагающим фактором к формированию нарушений жирового и углеводного обмена.
Потенциальные взаимодействия между уровнем витамина D и селена были подтверждены на молекулярно-генетическом уровне путем измерения влияния каждого показателя на экспрессию генов, участвующих в метаболизме обоих микронутриентов. Результаты исследования показали, что Se увеличивал экспрессию CYP27B1 – фермента, превращающего гидроксивитамин D3 в его активную форму, а также что экспрессия цистатионин-бета-синтаза(CBS) – фермента, участвующего во включении Se в селенопротеины, повышалась под действием витамина D[15]. Следовательно, можно обсуждать потенциальное синергетическое взаимодействие витамина D и Se. Повышение уровня селена может повышать концентрацию активного витамина D, и, наоборот, витамин D может повышать содержание селена, при этом оба они могут оказывать влияние на развитие сосудистых и метаболических осложнений ожирения.
Поскольку в литературе поддерживается идея о том, что надлежащие уровни селена при определенных патологических состояниях обеспечивают лучшие исходы лечения, выводы о более низких уровнях селена при ожирении могут иметь определенное значение.Однако следует проявлять осторожность, поскольку многочисленные противоречивые результаты, касающиеся связи между селеном и различными патологиями, еще не полностью объяснены, а исследования метаболических эффектов селена все еще не завершены.Среди множества других осложнений, связанных с ожирением, оказывается, что дети с ожирением также могут быть группой риска дефицита селена.Возможно, будет разумно помнить об этом, когда речь идет о питании и лечении таких пациентов.
Заключение
Согласно полученным результатам, для подростков с ожирением характерен дефицит таких важных микронутриентов, как витамин D и селен, причем прослеживается существенная связь с экологическими характеристиками района проживания. Так, у подростков с ожирением, проживающих в условиях техногенного загрязнения, показатели данных микронутриентов значительно ниже, чем у такой же категории пациентов, живущих в экологически более благоприятных районах. Является ли это следствием воздействия неблагоприятных техногенных факторов или особенностей характера питания, режима физической активности у обследуемого контингента детей, вероятно, покажут дальнейшие исследования.
В исследовании подтверждено, что VD-дефицит, так же как и недостаток селена, коррелирует с повышением инсулинорезистентности и параметров липидного обмена при ожирении у подростков, т.е. начальным формированием метаболического синдрома. Так как дефицит витамина D и селена является предиктором формирования коморбидной патологии в последующем периоде жизни, необходимо своевременно выявлять и корректировать дисбаланс этих микронутриентов при ожирении у подростков, особенно при проживании в районах с повышенной антропогенной нагрузкой.



