Повышение эффективности лечения рака ободочной кишки представляется одной из наиболее актуальных проблем современной онкологии [1]. Поскольку его неотъемлемым этапом является оперативное вмешательство, сохраняется опасность развития воспалительных и гнойно-септических осложнений. При обширных полостных операциях, например на органах брюшной полости, страдают факторы иммунитета, причем не только системные, но и локальные, обеспечивающие местную иммунную защиту слизистых оболочек. Проводимая в таких случаях антибиотикопрофилактика может усиливать иммуносупрессивное действие, что отражается на течении послеоперационного периода. В настоящее время разработаны и применяются в хирургической практике, в частности при операциях по поводу колоректального рака, различные иммуномодуляторы [2, 3]. Представляется перспективным использование для профилактики инфекционных послеоперационных осложнений препаратов антител, среди которых – разработанные на основе иммуноглобулинов молозива и молока лактоглобулины [4]. Для таких препаратов характерны устойчивость к действию протеолитических ферментов, синергическое воздействие на кишечную микрофлору и на местный иммунитет слизистой толстой кишки, вследствие чего они используются для коррекции микробиоты у детей, однако они могут быть применены не только для таких больных. Среди эффектов лактоглобулинов выявлены антитоксический, выраженный как против термолабильных энтеротоксинов, так и против липополисахарида условно-патогенных энтеробактерий, иммуномодулирующий и антиоксидантный, связанные с нормализацией цитокинового баланса и стимуляцией кислородозависимой бактерицидности и функциональной активности нейтрофилов [4]. Изучение возможности и эффективности включения препаратов лактоглобулинов в комплексную предоперационную подготовку больных раком ободочной кишки для нормализации показателей местного иммунитета толстой кишки и снижения частоты развития гнойно-септических осложнений является актуальной задачей.
Целью данной работы явилось изучение факторов локального иммунитета и состава ряда интерлейкинов у больных раком ободочной кишки при проведении предоперационной подготовки с применением лактоглобулина.
Материалы и методы исследования. Для предоперационной подготовки применяли препарат лактоглобулин против условно-патогенных микроорганизмов (Pr. vulgaris, Pr. mirabilis, Kl. рneumoniae, S. аureus, Ps. аeruginosa, энтеропатогенные E. сoli), разработанный во ФБУН «Ростовский НИИ микробиологии и паразитологии» Роспотребнадзора. Больные раком ободочной кишки II–III стадии были разделены на 2 группы по 40 больных. В каждой группе преобладали лица женского пола (54 и 57% соответственно), средний возраст составлял 68±6,7 и 66±5,3 года соответственно. Основная группа получала предоперационную иммунопрофилактику указанным препаратом в дозе 2 г 2 раза в день в течение 5 дней; пациентам контрольной группы иммунопрофилактика не проводилась. Все больные давали письменное информированное согласие на участие в исследовании. Всем больным выполнены радикальные оперативные вмешательства; в послеоперационном периоде проводилась стандартная антибиотикотерапия (цефтриаксон 1 г 2 раза в день, метрогил 500 мг 2 раза в день). Для оценки локального клеточного иммунитета и определения количества интерлейкинов при операции брали образцы ткани опухоли (ОП), а также визуально не измененных участков тканей, отступив 1–3 см (перитуморальная зона, ПЗ) и 10 см (линия резекции, ЛР) от края опухоли. Определение концентрации интерлейкинов (IL-1α, IL-6, IL-8) и фактора некроза опухоли (TNF-a), проводили в гомогенатах полученных образцов тканей методом ИФА с тест-системами фирмы «Вектор-Бест» (Новосибирск) и выражали в пг/мл с расчетом удельного содержания (на 1 г белка, определяемого биуретовым методом); учет результатов проводили на анализаторе АИФР-01 («УНИПЛАН», Россия) при основной длине волны 450 нм и длине волны сравнения в диапазоне 620 нм. Уровни лимфоцитарных субпопуляций определяли в гомогенатах тканевых образцов с помощью проточной цитометрии (FACS Canto II, BD, США) с помощью панели Т- В- NK, результаты выражали в процентах.
Статистический анализ результатов исследования проводили с использованием программы STATISTICA 13.3 (StatSoft, США). Проверку на нормальность распределения осуществляли с помощью критерия Шапиро–Уилка. Поскольку полученные данные имели нормальное распределение, количественные показатели представляли в виде среднего (М) и ошибки среднего (m). Для выявления статистической значимости различия средних использовали критерий Стьюдента; результаты считали статистически достоверными при p<0,05.
Результаты исследования и их обсуждение. Количество общего белка в исследуемых тканях различалось несущественно, вариабельность данных по этому показателю незначительна. Удельное содержание провоспалительных цитокинов в гомогенатах исследуемых образцов тканей больных основной и контрольной групп представлено в таблице 1.
Таблица 1
Сравнительная характеристика удельного содержания цитокинов в тканях аденокарциномы толстой кишки, перитуморальной зоны и линии резекции больных основной и контрольной групп
|
Образцы тканей |
Удельное содержание цитокинов (пг/мл/г белка) |
|||||||
|
TNF-α |
IL-6 |
IL-8 |
IL-1α |
|||||
|
Осн. |
Контр. |
Осн. |
Контр |
Осн. |
Контр |
Осн. |
Контр. |
|
|
Опухоль |
1,3± 0,3** |
1,9± 0,4 |
6,9± 2,2● |
14,2± 1,6 ** |
22,3± 3,3**● |
33,0± 2,4** |
18,8± 2,8**● |
49,7± 11,4** |
|
Перитуморальная зона |
0,5± 0,2 |
0,6± 0,1* |
0,8± 0,5*● |
4,9± 1,2* |
7,7± 1,7*● |
17,3± 2,3* |
8,77± 1,7* |
17,7± 6,1* |
|
Линия резекции |
0,5± 0,09* |
1,0± 0,3 |
1,2± 0,5*● |
5,2± 1,1* |
10,3± 3,0* |
13,1± 1,6* |
6,7± 1,8*● |
19,0± 5,5* |
Примечание: * – статистически достоверные отличия от показателя опухолевой ткани); ** – отличия от показателя здоровой ткани (линии резекции); ● – отличия от контрольной группы (р<0,05).
Как видно из представленных в таблице 1 данных, содержание исследованных цитокинов в опухоли статистически значимо превышало их уровни в образцах обеих неопухолевых тканей, причем это наблюдалось в обеих сравниваемых группах. Так, у больных контрольной группы содержание всех исследованных цитокинов не различалось между перитуморальной областью и линией резекции, а в ткани опухоли было выше, чем в обеих неопухолевых тканях. У больных основной группы в опухоли также отмечено максимальное содержание исследованных цитокинов по сравнению с перитуморальной зоной и линией резекции.
Сопоставление показателей основной и контрольной групп продемонстрировало, что после применения лактоглобулина в опухоли содержание TNF-α находилось на уровне контрольной группы, а остальных исследованных цитокинов было статистически значимо ниже: IL-6 в 2 раза, IL-8 – в 1,5 раза, IL-1α – в 2,6 раза (р<0,05). В перитуморальной области у больных основной группы уровни IL-6 и IL-8 были статистически значимо ниже, чем у больных контрольной группы, а в ткани линии резекции были статистически значимо ниже уровни IL-1α и IL-6 (р<0,05). Особенно выраженные различия в неопухолевых образцах выявлены по уровню IL-6, количество которого в опухолевой ткани больных, получавших лактоглобулин, в тканях перитуморальной зоны и линии резекции было в 6,5 и 4,5 раза соответственно ниже, чем в контрольной группе (во всех случаях р<0,05). Уровни IL-8 были статистически достоверно ниже только в ткани опухоли и перитуморальной зоны, а IL-1α – в опухоли и линии резекции по сравнению с образцами тканей больных контрольной группы.
Итак, минимальные различия уровней тканевых цитокинов между основной и контрольной группами зарегистрированы по TNF-α, а максимальные – по IL-6.
Процентный состав лимфоцитов основных субпопуляций в образцах тканей больных основной и контрольной групп представлен на рисунке.
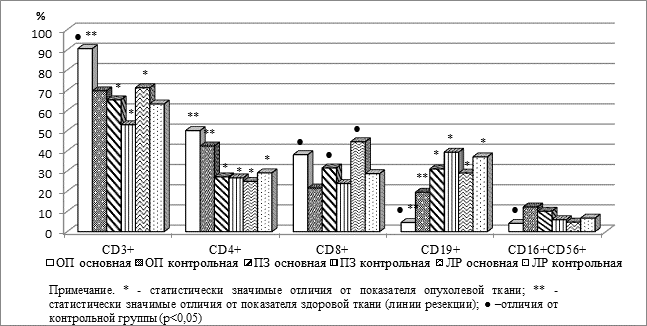
Сравнительная характеристика состава лимфоцитов основных субпопуляций в тканях больных основной и контрольной групп
Как видно из представленных на рисунке результатов, в ткани опухоли больных контрольной группы общее количество Т-лимфоцитов (CD3+) было статистически значимо выше, чем в тканях перитуморальной области, но не отличалось от показателя линии резекции, составляя 69,7±5,4, 52,9±5,0 (р<0,05) и 63,2±4,7% соответственно. В отличие от них, в образцах опухолей больных основной группы выявлено накопление Т-лимфоцитов, что выражалось в статистически значимо более высоком их количестве по сравнению с неопухолевыми образцами (90,6±5,5, 65,2±6,5 и 71,2±5,6% соответственно, в обоих случаях р<0,05). Кроме того, содержание Т-лимфоцитов в опухолях больных основной группы превышало соответствующие показатели больных контрольной группы (90,6±5,5 против 69,7±5,4%, р<0,05). Количество CD4+ лимфоцитов в опухолях больных обеих групп было статистически значимо выше, чем в перитуморальной зоне и линии резекции: 50,0±4,9, 27,1±5,2 и 24,9±4,7% в основной и 42,4±4,2, 26,6±2,9 и 29,1±4,0% в контрольной (в обоих случаях р<0,05), а статистически значимых различий между показателями всех тканевых образцов больных основной и контрольной групп не обнаружено.
При исследовании уровней CD8+ клеток в образцах тканей больных основной группы установлено, что они были статистически значимо выше, чем в соответствующих контрольных, на 22–54%, составляя в основной группе 38,1±6,4% в опухоли, 31,5±2,5 в перитуморальной области и 44,5±6,1% в линии резекции против 21,6±3,5, 23,8±2,2 и 28,7±2,8% в контрольной соответственно; во всех случаях р<0,05. По данному параметру обнаружены только межгрупповые различия, а между тканью опухоли, перитуморальной зоны и линии резекции не наблюдалось статистически значимых различий ни в основной, ни в контрольной группе.
Отмечен низкий уровень натуральных киллеров в образцах ткани опухоли больных основной группы, который является минимальным (4,1±1,1%) как среди других исследованных тканевых образцов, хотя и не отличаясь от них статистически значимо (10,1±3,4% в перитуморальной зоне и 4,7±1,9% в линии резекции), так и по сравнению с тканью опухолей больных контрольной группы – 12,2±2,5%; в последнем случае отличие статистически значимо (р<0,05). По-видимому, это связано с отмеченным выше выраженным преобладанием Т-лимфоцитов в опухолях больных основной группы. В ткани перитуморальной зоны и линии резекции различий между показателями основной и контрольной групп не наблюдается.
В ткани опухоли больных основной группы отмечается более низкое процентное содержание В-лимфоцитов по сравнению с контрольной: 4,5±1,2 против 19,5±2,8% (р<0,05), что мы также связываем с высоким содержанием в опухоли Т-клеток. В опухолевой ткани как контрольной, так и основной групп выявлено более низкое содержание В-лимфоцитов по сравнению с неопухолевыми тканями. В неопухолевых тканях таких различий не наблюдается: в перитуморальной зоне уровень СD19+ клеток составляет 31,0±7,3 в основной и 39,3±5,0% в контрольной группе; в ткани линии резекции – 29,0±4,8 и 37,0±4,4% соответственно, что является характерным для толстой кишки, богатой клетками-эффекторами гуморального иммунитета [5]. Основной функцией этих клеток является продукция секреторного IgА (SIgA), обеспечивающего антимикробную защиту слизистой кишечника. Результаты определения содержания SIgА в гомогенате исследованных образцов тканей, взятых у больных основной и контрольной групп, представлены в таблице 2, из которой видно, что в образцах опухоли больных основной группы его уровень статистически достоверно ниже, чем в контрольной группе, а соответствующих различий в образцах перитуморальной зоны и линии резекции не отмечено.
Таблица 2
Сравнительная характеристика локальной продукции SIgА в тканях больных основной и контрольной групп (мг/л)
|
Группы больных |
Опухоль |
Перитуморальная зона |
Линия резекции |
|
Основная |
26,1±2,0* |
31,1±2,2 |
26,6±2,3 |
|
Контрольная |
33,5±3,0 |
34,0±1,7 |
30,3±2,9 |
Примечание: * – статистически значимые отличия от контроля (р<0,05).
Возможно, снижение уровня SIgА происходит благодаря описанному выше снижению тканевого содержания IL-6, который является стимулятором его продукции и секреции [6], и объяснимо подавлением не только его продуцентов (В-лимфоцитов), но и стимулятора. Однако снижение уровня SIgА оказалось менее выраженным по сравнению со снижением как CD19+ клеток, так и IL-6. Несмотря на низкое содержание В-лимфоцитов в опухолевой ткани больных основной группы, их функция представляется достаточно сохранной, а возможно, и компенсаторно повышенной.
Таким образом, применение лактоглобулина вызывает благоприятные изменения в лимфоцитарном и цитокиновом составе тканей ободочной кишки, демонстрируя противовоспалительный эффект при применении в предоперационном периоде. Несмотря на однонаправленность различий между показателями основной и контрольной групп, они не являются одинаковыми. Статистически значимые различия зарегистрированы по IL-1α, IL-8 и IL-6. Последний считается фактором пролиферации и распространения опухоли [7, 8], поэтому снижение его тканевого содержания при применении лактоглобулина не только в удаляемой опухоли, но и в остающейся после операции ткани линии резекции может характеризовать ее состояние как более благоприятное по сравнению с тканью больных контрольной группы. Об этом же говорит и преобладание тканевого содержания Т-лимфоцитов за счет цитотоксических (CD8+) во всех тканевых образцах больных, получавших лактоглобулин, среди которых представляется особенно важной сохранность этих клеток в ткани линии резекции.
В литературе неоднократно описана значимость иммунологического микроокружения опухоли для обеспечения эффекта как иммунотерапии (в частности, ингибиторами иммунных контрольных точек), так и химиотерапии [9, 10, 11]. Авторы придают важное прогностическое значение локально присутствующим Т- и NK-клеткам [9, 12, 13], а также показателю immunoscore, характеризующему количество опухоль-инфильтрирующих лимфоцитов, причем предпочтение отдается Т-клеткам адаптивного иммунитета (CD8+) [14-17], повышение локального уровня которых после применения антительного препарата – лактоглобулина – показано в данной работе.
Заключение. Таким образом, нами установлено, что предоперационное применение препарата лактоглобулина у больных раком ободочной кишки приводит к ряду количественных изменений факторов локального иммунитета по сравнению с больными, получавшими стандартную антибиотикопрофилактику. Среди этих изменений представляются особенно благоприятными снижение содержания IL-6 в ткани линии резекции наряду с повышением в ней количества CD8+ Т-лимфоцитов, что предполагает усиление антипролиферативного потенциала ткани, остающейся в организме больного после оперативного вмешательства.



