Макулярный разрыв (МР) — заболевание, характеризующееся сквозным дефектом ткани макулярной области сетчатки, приводящее к снижению остроты зрения, возникновению центральной скотомы и метаморфопсии.
МР впервые был описан в 1869 году немецким офтальмологом H. Knapp у пациента с закрытой травмой глаза, вследствие чего достаточно продолжительное время превалировала теория травматической этиологии разрывов. H. Kuhnt в 1900 году высказал теорию, что в основе формирования МР лежат дегенеративные процессы, включающие атрофию, а затем и разрыв сетчатки вследствие повреждения сосудов. С тех пор значительная часть клинических исследований были посвящены патологическим изменениям стекловидного тела и сетчатки при МР, механизму их развития и прогрессирования [1].
До 1991 г. МР считался неизлечимым заболеванием, но в последнее десятилетие хирургические методики закрытия отверстия и улучшения центрального зрения стали рутинной практикой.Единственным доступным методом лечения была витрэктомия с использованием газа длительного действия и послеоперационным положением лицом вниз в течение 1 недели;однако в настоящее время доступны и другие методы лечения [2].
Заболеваемость МР составляет 3 случая на 1000 человек. Данная патология чаще встречается у пациентов в возрасте старше 55 лет, в структуре заболеваемости превалируют женщины. В 80% случаев процесс является односторонним. Риск развития МР на парном глазу в течение следующих 5 лет составляет 10–15% [3].
Нормальная витреоретинальная физиология
Стекловидное тело (СТ) представлено в основном коллагеновыми волокнами, которые проходят через его центр в переднезаднем направлении, соединяясь с передней частью основания стекловидного тела и прикрепляясь к задней части коры стекловидного тела [4].Межфибриллярные пространства волокон заполнены водой, которая составляет более 98% стекловидного тела, и гиалуроновой кислотой [5].Благодаря высокой прочности и сопротивляемости к растяжению своих структур стекловидное тело устойчиво к тракционным и компрессионным воздействиям.Над макулой располагается разжиженный слой СТ – прекортикальный витреальный карман, который был описан ранее как «bursa premacularis», или премакулярная сумка [6].
Витреоретинальный интерфейс (ВРИ) представляет собой область контакта преретинального стекловидного тела и сетчаткой и является сложной структурой.Более плотно спрессованные коллагеновые фибриллы задней части коры стекловидного тела расположены над макулой и поверхностно проникают во внутреннюю пограничную мембрану (ВПМ) сетчатки. Наиболее прочно стекловидное тело прикреплено к сетчатке в перипапиллярной области, в зоне макулы, у своего базиса, а также вдоль основных кровеносных сосудов сетчатки [7].
В результате нормального старения стекловидное тело претерпевает ряд физиологических изменений.После 40 лет оно подвергается прогрессирующему разжижению (синхизису) с выходом жидкости через дефекты в задней части коры стекловидного тела. Это приводит к формированию заполненных жидкостью карманов. Обычно к 80 годам около 50% стекловидного тела разжижается [5, 7].Со временем заполненные жидкостью карманы сливаются и увеличиваются, происходят постепенное разрушение коллагеново-гиалуроновой сети и ослабление адгезии между стекловидным телом и сетчаткой.В конечном итоге это приводит к неглубокому локализованному отделению стекловидного тела от перифовеальной области сетчатки, которое со временем прогрессирует [8].
Этот процесс может длиться от нескольких месяцев до нескольких лет.Часто задняя отслойка стекловидного тела (ЗОСТ) протекает бессимптомно до тех пор, пока не происходит отделение стекловидного тела от области диска зрительного нерва.Клинически полная (острая) ЗОСТ проявляется фотопсиями и плавающими помутнениями.Фотопсии вызваны тракцией стекловидного тела на периферии сетчатки, в то время как плавающие помутнения возникают вследствие скопления крови, сгущения коллагена СТ или глиальной тканью, отделенной от диска зрительного нерва [9].
Значительно чаще ЗОСТ встречается у женщин в постменопаузе, что связывают со снижением влияния эстрогена на соединительную ткань в стекловидном теле.Наличие миопии также обусловливает 3–4-кратное увеличение риска ЗОСТ [10].
Классификация макулярных разрывов
В настоящее время общепринятой концепцией является то, что тангенциальные витреомакулярные тракции (ВМТ) играют основную роль в патогенезе идиопатических макулярных разрывов (ИМР). Их суть заключается в том, что после ЗОСТ оставшиеся на перимакулярной поверхности радиальные волокна стекловидного тела сокращаются. Это постепенно приводит к появлению разрыва округлой формы в макулярной зоне сетчатки [11]. Эта теория основана на результатах исследований, проведенных R. Johnson и J. Gass в 1988 году. Благодаря этим исследованиям была разработана классификация МР, которая широко применяется в клинической практике, согласно которой выделяют 4 стадии [12]:
- стадия I а – ранняя серозная отслойка фовеолы;
- стадия I б – «скрытый фовеольный разрыв» с сохранением витреомакулярной фиксации;
- стадия II – сквозной дефект диаметром менее 400 мкм;
- стадия III – сквозной дефект более 400 мкм, фиксация задней гиалоидной мембраны сохраняется;
- стадия IV – это сквозной дефект сетчатки диаметром более 400 мкм с полной отслойкой задней гиалоидной мембраны от поверхности макулы и диска зрительного нерва [12].
В 2013 году The International Vitreomacular Traction Study (IVTS) Group была разработана новая анатомическая классификация МР, основанная на данных оптической когерентной томографии (ОКТ) сетчатки, согласно которой выделяют первичные и вторичные МР [13]. Первичные (идиопатические) МР появляются вследствие ВМТ. Вторичные развиваются из-за уже ранее существующих патологических заболеваний или состояний глаза.
На основании данных ОКТ также была предложена патогенетически обоснованная классификация, в основе которой лежит разделение МР на предразрыв, ламеллярный и полный разрыв. Предразрыв является локальной отслойкой нейроэпителия в области фовеолы. Ламелярный разрыв представляет собой дефект внутренней поверхности сетчатки, при котором слой фоторецепторов остается интактным. При сквозном МР дефект сетчатки распространяется на всю глубину [14].
По состоянию СТ выделяют разрывы с ВМТ или без нее. По размеру МР классифицируются на малые (≤250 мкм), средние (250–400 мкм), большие (>400 мкм) [13]. Однако в публикациях W.C. Soon с соавторами выявлено, что различие между МР 350 и 450 мкм незначимо в аспекте планирования операции. Учитывая, что 90% витректомий с вовлечением внутренней пограничной мембраны заканчиваются успешно для полных разрывов размером 250–650 мкм, авторы в качестве границы между средними и большими МР предлагают значение 650мкм [15].
Сообщается, что стандартная витрэктомия в случае МР более 650мкм менее успешна, и в лечении МР таких размеров требуются дополнительные манипуляции, такие как закрытие лоскутом из внутренней пограничной мембраны или методом растяжения сетчатки (RETMA)[15].
Клиническая картина и диагностика
Большинство МР стадии 1 и многие МР стадии 2 протекают бессимптомно, особенно если зрительные функции второго глаза сохранены, а поражен недоминантный глаз [16]. Основные симптомы связаны со структурными изменениями желтого пятна и включают снижение остроты зрения (ОЗ), метаморфопсию (нарушение зрительного восприятия, когда человек неправильно оценивает размеры, формы и другие параметры окружающих предметов), микропсию или макропсию (уменьшение или увеличение объектов в поле зрения), центральные скотомы и редко фотопсию (светящиеся лучи или вспышки) [17].
У пациентов с подозрением на МР необходимо собрать тщательный анамнез, важно узнать, как долго беспокоят симптомы и как возникло заболевание (остро или постепенно), офтальмологический анамнез (наличие глаукомы или других заболеваний, травм, хирургических вмешательств) и приема лекарств, которые потенциально связаны с развитием макулярных кист (например, системный ниацин, аналоги простагландина) [18].
Офтальмоскопическая картина МР зависит от стадии и времени его формирования. На ранних стадиях формирования разрыва (предразрыв) офтальмологическая диагностика довольно проблематична. Вид глазного дна в этом случае не является патогномоничным. На данном этапе врач-офтальмолог может определить снижение или отсутствие фовеолярного рефлекса, появление симптома «желтого пятна» или «желтого кольца». Однако следует помнить, что другие офтальмологические заболевания, такие как травматические поражения макулы или некоторые врожденные дистрофии, также могут вызывать данный симптом [19]. При ламеллярном разрыве в области фовеа определяется округлый очаг светло-розового цвета с нечеткими контурами, обычно окружен зоной патологических световых рефлексов вследствие витреоретинальной тракции. При полном МР дефект ярко-красный, с четко очерченными контурами, иногда с мелкими вкраплениями желтого цвета на дне (друзы) и валиком кистозного отека перифокально (рис. 1) [20].
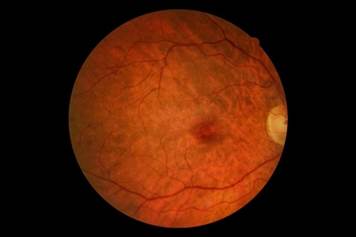
Рис. 1. Офтальмоскопическая картина макулярного разрыва
Наиболее полезным диагностическим тестом на данном этапе является тест Вотцке-Аллена. Суть метода заключается в следующем: на фовеолу через фундус-линзу необходимо направить узкую вертикальную полоску света, сформированную диафрагмой щелевой лампы. В случае если пациент отмечает разрыв полоски света, тест считается положительным. Этот эффект объясняется отсутствием нейросенсорной ткани в центре разрыва [21].
Золотым стандартом при постановке диагноза МР в настоящее время является ОКТ. Существует несколько методов измерения размера МР с применением ОКТ-сканов. Наиболее часто в клинической практике определяются размеры базового диаметра (БД) и минимального диаметра (МД) МР [21]. БД – это максимальный размер разрыва, который определяется на уровне пигментного эпителия сетчатки. МД – это минимальный размер МР между его краями. Значение данных показателей в предоперационном периоде является прогностически важным в отношении анатомического и функционального результатов лечения. Многие авторы, помимо линейных показателей, рекомендуют использовать расчетные показатели, такие как фактор формы разрыва, индекс МР, тракционный индекс разрыва (рис. 2) [11].
Фактор формы разрыва равен отношению суммы боковых сторон трапеции, имеющей основаниями БД и МД разрыва, к БД. Данный показатель был предложен S. Ullrich и соавторами в 2002 году. Они выявили, чем при большем значении фактора формы разрыва достигнуты лучшие результаты хирургического лечения [22].
Индекс МР равен отношению высоты края МР к БД разрыва. В 2004 году определение данного показателя предложили S. Kusuhara и соавторы. Притом они выяснили, что индекс, равный 0,5 и более, ассоциируется с лучшими хирургическими результатами, чем индекс менее 0,5 [23].
Еще два расчетных параметра были предложены в 2008 году J. Ruiz-Moreno и иными: индекс диаметра разрыва (данный показатель не имел прогностической ценности) и тракционный индекс разрыва – отношение высоты края МР к МД. По мнению авторов, наилучшие результаты получены у пациентов со значением тракционного индекса разрыва более 1,41 [24].
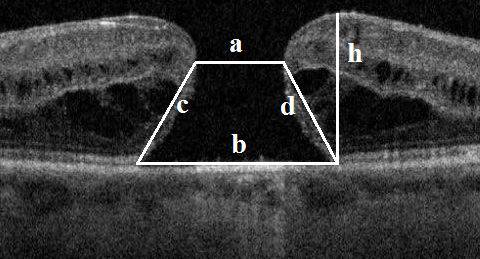
Рис. 2. Расчетные показатели, характеризующие МР: индекс макулярного разрыва = h/b; фактор формы разрыва = (c+d)/b; индекс диаметра разрыва = a/b; тракционный индекс разрыва = h/a. Условные обозначения: a – минимальный диаметр, b – базовый диаметр, h – высота края МР, c и d – боковые стороны трапеции
Лечение
Наиболее важным прогнозом для успешной хирургии МР является дооперационная острота зрения (ОЗ).Чем лучше дооперационная ОЗ, тем выше скорость восстановления зрения и анатомического закрытия МР.Выявление больных на ранних этапах заболевания также является решающим фактором для улучшения зрения и анатомического закрытия МР [2]. Стадия 1 в некоторых случаях может разрешиться спонтанно;однако такие больные должны находиться под пристальным наблюдением. В случае длительного сохранения симптомов и значительного снижения остроты зрения пациенту на стадии 1 рекомендуется хирургическое вмешательство.Стадия 2 и выше является абсолютным показанием к хирургической коррекции [25].
Золотым стандартом лечения макулярных разрывов считается трехпортовая витрэктомия pars planum с последующим прокрашиванием и пилингом ВПМ [25].
Целью данного метода лечения является удаление главного этиопатогенетического фактора формирования МР – витреомакулярных тракций. Витрэктомия включает удаление ядра стекловидного тела и периферических отделов. При отсутствии ЗОСТ задние кортикальные слои отделяют от сетчатки путем аспирации. Операция завершается заменой жидкости, заполняющей полость стекловидного тела, газом. После операции пациенту необходимо в течение 2 недель строго придерживаться положения «лицом вниз» [26].
В 2010 году J. Nawrocki и Z. Michalewska была предложена технология хирургии МР большого диаметра – техника «инвертированного, или перевернутого, лоскута». Фрагмент ВПМ размером около 2 диаметров ДЗН отделяется вокруг разрыва, при этом сохраняется его прикрепление к краям разрыва; после чего ее фрагменты укорачиваются, укладываются на разрыв в виде конверта (в перевернутом виде) и блокируются газо-воздушной тампонадой. Авторы сообщали, что в 98% случаев разрыв со средним минимальным диаметром 698 мкм был анатомически закрыт, тканевая архитектоника макулы была восстановлена, средняя острота зрения увеличилась на 0,28 строки. В 7 из 50 случаев произошел спонтанный отрыв фрагмента ВПМ от края разрыва и был утрачен во время обмена жидкости на газо-воздушную смесь. Авторы оценили это как осложнение, связанное с обучением новой технологии [27].
Техника «перевернутого лоскута» получила достаточно широкую популярность среди зарубежных и отечественных хирургов. Были предложены различные модификации технологии, касающиеся конфигурации формируемого лоскута ВПМ и различных методик удержания сформированного лоскута при обмене жидкость/воздух, например «лепестковая техника» [27, 28]. При этом отмечаются высокие функциональные результаты лечения МР большого диаметра [29, 30, 31].
При методе растяжения сетчатки (the retinal expansion method) сбалансированный солевой раствор вводится субретинально вокруг МР; тем самым вокруг разрыва формируется отслойка сетчатки [32]. Субретинальная инфузия раствора проводится до тех пор, пока каждый сформированный пузырек не соединится с МР и он не перестанет увеличиваться. Скорость введения регулируется вручную с помощью шприца в правой руке хирурга. Затем выполняется обмен «вода – воздух», но субретинальная жидкость при этом не удаляется [33]. Цель метода заключается в отделении сетчатки от пигментного эпителия. Отслоенная сетчатка становится более растяжимой, что позволяет сопоставить ее края и закрыть тем самым МР [32].
На сегодняшний день широко используется методика закрытия макулярных разрывов с PRP-терапией (platelet–rich plasma – плазма, обогащенная тромбоцитами). Пациентам проводится стандартная трехпортовая витрэктомия с пилингом ВПМ. После последовательной замены «жидкость – воздух», без механического сведения краев разрыва, PRP вводится интравитреально на область фовеа в объеме одной-двух капель в полость разрыва [26]. В опубликованных исследованиях отмечается высокая анатомическая и функциональная эффективность применения данного метода [34, 35].
Применение prp в офтальмологии
Тромбоциты способствуют гемостазу, предотвращая кровопотерю в местах повреждения сосудов, содержат большое количество факторов роста и цитокинов, которые играют ключевую роль в регенерации тканей. За последние два десятилетия возросло понимание физиологической роли тромбоцитов в заживлении ран, что привело к идее использования технологии концентрирования тромбоцитов в качестве терапевтических средств.
Белки и другие вещества, которые вырабатываются тромбоцитами, в основном хранятся в их альфа-гранулах. Белки, содержащиеся в этих гранулах, секретируются при помощи экзоцитоза путем образования секреторных везикул. После слияния с плазматической мембраной содержимое везикул высвобождается в окружающую среду [36].
Плазма, обогащенная тромбоцитами, состоит из ограниченного объема плазмы, которую получают от пациента. После активации концентрата тромбоцитов формируется трехмерный биосовместимый фибриновый каркас, и множество факторов роста и белков постепенно высвобождаются в местную среду, способствуя ускорению восстановления тканей. Кроме того, аутологическое происхождение этого препарата снижает риск иммуногенных реакций и передачи заболеваний [37, 38].
PRP содержит много биоактивных белков, таких как эпидермальный фактор роста (EGF), тромбоцитарный фактор роста AB (PDGF-AB), фактор роста эндотелия сосудов (VEGF), инсулиноподобный фактор роста (IGF-1), трансформирующий фактор роста бета (TGF-b) и иные, а также цитокины, включая такие белки, как CD40L и PF4, которые способствуют восстановлению тканей и влияют на ангиогенез и воспаление [39].
PRP – это недорогой, безопасный и доступный источник аутологических факторов роста и других биологически активных веществ. Ее нанесение в виде клея на поверхность поврежденных органов и тканей позволяет добиться лучшего анатомического, а также функционального результата.
Заключение
Данный литературный обзор показывает, что макулярный разрыв – патология фовеальной области сетчатки, патогенез которой чаще связывают с витреоретинальными тракциями вследствие задней отслойки стекловидного тела. Для постановки диагноза, помимо сведений о клинической картине и офтальмоскопического исследования, применяется ОКТ сетчатки. Методы лечения макулярных разрывов в настоящее время постоянно совершенствуются. К примеру, PRP-терапия широко применяется в офтальмологической практике для лечения не только заболеваний переднего отрезка, но и патологий сетчатки, в частности макулярных разрывов. Наиболее важным прогнозом для успешного лечения разрыва является дооперационная острота зрения – чем она лучше, тем выше скорость восстановления зрения и анатомического закрытия разрыва.



