Опухоли головного мозга являются тяжелым, нередко инвалидизирующим, в немалом числе случаев жизнеугрожающим заболеванием и входят в первую десятку самых распространенных причин гибели пациентов с онкологическими болезнями. На астроцитарные, олигодендроцитарные и эпендимальные глиомы приходится около 40% всех первичных опухолей головного мозга у взрослых [1]. Заболеваемость глиомами составляет 8–12:100000 в популяции. Несмотря на относительно низкую удельную плотность (всего 1,5% всей онкозаболеваемости человека), глиомы служат причиной смерти 25% онкологических пациентов. Астроцитомы и олигодендроглиомы – наиболее часто встречающиеся глиальные новообразования, 60 и 75% соответственно [2]. Самым распространенным и злокачественным гистологическим подтипом выступает глиобластома с годовой заболеваемостью 4–5:100000 человек, при этом средний возраст пациента при постановке диагноза составляет примерно 60 лет. Выживаемость у больных раком головного мозга на 5-летнем горизонте – приблизительно 75%.
Распространенность первичных опухолей головного мозга в Санкт-Петербурге составляет 14:100000 в популяции в год. У 80% пациентов при поступлении в стационар определяются опухоли больших и гигантских размеров, не менее половины из них – с выраженными клиническими проявлениями. Данные различных исследований определяют встречаемость астроцитарных опухолей головного мозга в Санкт-Петербурге в среднем как 7,03:100000 населения. Согласно данным государственной медицинской статистики и данным Росстата за 2020 г., в структуре заболеваемости злокачественными новообразованиями в Российской Федерации на опухоли головного мозга и центральной нервной системы (ЦНС) приходилось 1,6% среди мужчин и 1,4% среди женщин [3].
Абсолютное число опухолей головного мозга и ЦНС в структуре впервые диагностированных злокачественных заболеваний по России составило 4101 из 256069 среди мужчин и 4315 из 299967 среди женщин; средний возраст – 55,3 года (52,9 для мужчин, 57,5 для женщин) [3].
По Санкт-Петербургу за тот же год заболеваемость всеми злокачественными опухолями составила 23770 человек (9787 мужчин и 13923 женщины; «грубый» показатель – 439,8:100000). Из них опухоли головного мозга и ЦНС были выявлены у 411 человек (172 мужчины, 239 женщин; «грубый» показатель – 7,62:100000, стандартизированный показатель – 4,88:100000). Смертность от всех злокачественных образований составила 12868 человек (5911 мужчин и 6957 женщин; «грубый» показатель – 238,69:100000, стандартизированный показатель – 112,34:100000); смертность от опухолей головного мозга из них – 376 человек (165 мужчин и 211 женщин; «грубый» показатель 6,97:100000, стандартизированный – 4,02:100000) [3].
Злокачественные астроцитарные опухоли среди всех онкологических заболеваний головного мозга показали наибольшую распространенность в Пушкинском и Курортном районах Санкт-Петербурга, а максимальное число больных приходится на Невский и Приморский районы. Наименьшее число злокачественных новообразований этой нозологии зафиксировано в Петроградском, Колпинском и Кронштадтском районах и составляет менее 5% от числа всех зарегистрированных пациентов [3].
Клиническая картина опухолей полушарий головного мозга многогранна. В значительной части наблюдений заболевание манифестирует головной болью, которая усиливается в утренние часы и нередко сопровождается тошнотой и рвотой. Эпилептический приступ иногда является первым и единственным симптомом. Когнитивный дефицит представляется важным диагностическим критерием, поскольку влияет на качество жизни и определяет уровень возможности реабилитации, однако в ряде случаев, особенно на ранних этапах онкологического процесса, этот симптом может быть малозаметным [4–7]. Невзирая на большое количество опубликованных исследований, при клинико-неврологическом осмотре дифференциальная диагностика новообразований головного мозга с другими заболеваниями ЦНС в значительном числе случаев может вызвать затруднения [8; 9]. В данной работе представлены результаты клинико-неврологического осмотра, МРТ-диагностики, нейрофизиологического мониторирования, хирургического лечения пациентов с опухолями больших полушарий головного мозга.
Целью исследования являлась оптимизация мониторирования пациентов с опухолями больших полушарий головного мозга, основанного на клинико-инструментальных данных, полученных на разных этапах течения болезни, диагностических процедур, хирургического вмешательства и послеоперационного ведения [5].
Материалы и методы исследования. В исследование включены данные обследования 132 пациентов (18–79 лет), прооперированных с 2014 по 2021 г. по поводу опухолей больших полушарий головного мозга, локализованных в различных его долях. Новообразования были как впервые выявленными, так и рецидивирующими. По полу пациенты распределились следующим образом: 64 (48,48%) мужчины, 68 (51,51%) женщин, что сопоставимо по количеству. Средний возраст пробандов составил 46 лет для мужчин и 51 год – для женщин.
Приведенные выше данные на 2020 г. по Санкт-Петербургу демонстрируют, что удельный вес мужчин в популяции выше, чем женщин, в показателях заболеваемости и смертности как среди всех злокачественных новообразований, так и среди опухолей головного мозга и ЦНС. Это коррелирует с соотношением числа пробандов, включенных в наше исследование (64 и 68 соответственно от общего числа 132). Однако при экстраполяции на популяцию страны в целом соотношение меняется, что позволяет говорить о неоднородности территориального распределения факторов, влияющих на заболеваемость и смертность от злокачественных новообразований.
Очаговые симптомы и признаки, возникающие при клинической картине опухоли головного мозга, зависят от ряда факторов. Локализация и скорость роста являются наиболее важными, за ними следуют общий размер и характер поражения, будь то инфильтрация или смещение нервных структур, а также наличие или степень сопутствующей патологии, включая отек, кровоизлияние и сосудистые нарушения. Механизмы проявления симптоматики подразделяются на опухолевые и перитуморальные факторы. Опухолевые факторы включают гистологию – в том аспекте, что судороги распространены у пациентов с некоторыми глиомами низкой степени злокачественности. Перитуморальные факторы, включая региональную гипоксию и ионные изменения в перитуморальной зоне, способны влиять на активность нейронов, а внеклеточный глутамат может быть связан с их гипервозбудимостью. Нарушение гематоэнцефалического барьера способно предрасполагать к эпилептизации и локальной дисфункции нейронов. Наконец, признаки и симптомы при опухолях головного мозга могут быть генерализованными, связанными с повышенным внутричерепным давлением, но также и локальными, основанными на поражении основных структур головного мозга [10].
Судорожные приступы представляют собой распространенный сигнал о внутричерепных опухолях, часто являющийся симптомом и основным фактором, влияющим на качество жизни. Некоторые исследователи полагают, что, например, при низкозлокачественных астроцитомах с эпилепсией целесообразно комплексное предоперационное обследование, включающее в том числе ЭЭГ-видеомониторирование, а при статических непрогрессирующих опухолях рекомендуют его к обязательному использованию. В этих случаях нейрохирургический подход должен включать удаление зоны начала приступа, часто расположенной вне очага поражения [11]. Среди большого разнообразия опухолей головного мозга нейроглиальные новообразования являются наиболее эпилептогенными. Дисэмбриопластические нейроэпителиальные опухоли, ганглиоглиомы, глиальные опухоли низкой степени злокачественности, глиобластомы, метастазы, лептоменингеальные опухоли и первичные лимфомы ЦНС связаны с эпилептическими приступами с разной частотой. Эпилептические приступы – наиболее частый симптом на начальных этапах заболевания, однако у пациентов они могут начаться и на более позднем этапе заболевания. Эти варианты эпилепсии способны серьезно повлиять на качество жизни пациентов, привести к когнитивному дефициту и даже к инвалидности. В настоящее время большинство исследований показывает, что если эпилепсия не будет полностью излечена, пациенты по-прежнему не смогут жить самостоятельно [12].
Результаты функциональных методов диагностики включали данные электроэнцефалографического (ЭЭГ) исследования, а также интраоперационной электрокортикографии (ЭКоГ), осуществлявшейся для обеспечения максимально эффективного удаления эпилептического очага.
Картирование мозга часто имеет решающее значение для успеха хирургии опухолей головного мозга. При рассмотрении оптимальной зоны для конкретного пациента необходимо учитывать ряд важных соображений, в том числе предполагаемые цели картирования, факторы пациента, анестезирующие эффекты, параметры стимуляции, интересующие корковые функции, а также рассматриваемые модальности картирования. Одним из основных применений ЭКоГ в хирургии эпилепсии является картирование областей коры, отвечающих за сенсомоторные и когнитивные функции, включая язык, и связанных с эпилептиформной активностью. Эта информация используется для планирования границ резекции [13].
В качестве нейровизуализационной методики применялась магнитно-резонансная томография (МРТ); исследования проводились на аппарате Siemens Magnetom c разрешающей способностью 1,5 Тл. МРТ является давно признанным методом выбора, позволяющим максимально приблизиться к правильной диагностике опухолей ЦНС. В некоторых случаях результаты МРТ могут быть подкреплены использованием компьютерной томографии (КТ) для демонстрации кальцификации или разрушения кости. В отдельных ситуациях для дифференциации новообразований и воспалительных поражений или для наблюдения за динамикой лечения опухоли может быть полезна МР-спектроскопия. В нашем исследовании при проведении МРТ оценивались следующие признаки: локализация и размеры образования, его тип, степень васкуляризации стромы, отношение к окружающим структурам, наличие инфильтрационного роста, степень кровоизлияния, наличие дислокационного синдрома, наличие и степень перифокального отека.
Результаты исследования и их обсуждение. Мы разделили наших пациентов на 4 группы – в зависимости от степени злокачественности новообразования и его типа. В 1-ю группу (49; 32,81%) вошли больные с менингиомами, лимфомами, метастазами, нейроцитомой и нейробластомой без обозначения степени злокачественности; во 2-ю (11; 9,38%) – с олигоастроцитомами и олигодендроглиомами (Grade II; Классификация первичных опухолей центральной нервной системы Всемирной организации здравоохранения 2016 г.). 3-ю группу (27; 26,56%) составили пациенты с анапластическими и фибриллярно-протоплазматическими астроцитомами (Grade III); 4-ю (45; 31,25%) – с глиобластомами и глиосаркомами (Grade IV).
В отношении корреляции среднего возраста пациентов с типами новообразований во всех группах, кроме 4-й, были получены достоверно значимые результаты (p<0,05). Распределение следующее: 1-я – 55,26 года; 2-я и 3-я – 37,1 года; 4-я – 50,4 года (рис. 1).
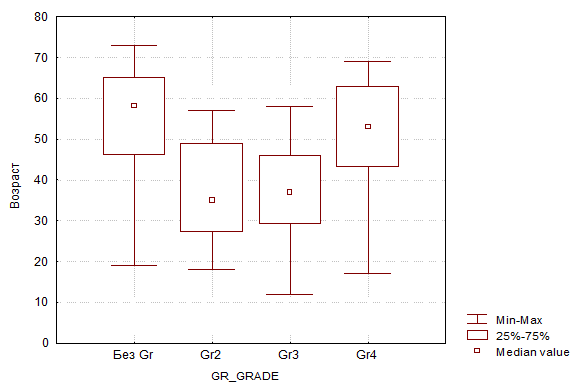
Рис. 1. Корреляция среднего возраста пациентов и типа опухоли
Клинико-неврологическая симптоматика оценивалась на основании жалоб и неврологического статуса.
По мнению отечественных и зарубежных специалистов, головная боль – один из ведущих симптомов опухолей головного мозга. Однако, согласно последним исследованиям, она может быть соотнесена с опухолью головного мозга, только если развилась в тесной временной связи с неоплазией, значительно усилилась параллельно с прогрессированием опухоли и/или значительно уменьшилась после успешного удаления новообразования.
Данный постулат подтверждается тем, что среди жалоб головная боль нашими пациентами упоминалась наиболее часто (120; 90,91%), также среди частых симптомов были нарушения чувствительности (76; 57,58%), когнитивные нарушения (75; 76,82%), спастический гемипарез (73; 55,30%), судорожные приступы (59; 44,70%).
В неврологическом статусе оценивалась динамика нарушений, которые в сумме составили у наших больных 681 наблюдение. В раннем послеоперационном периоде наблюдений в отношении неврологической симптоматики отмечалась положительная динамика (уменьшение пареза лицевой мускулатуры, нормализация сухожильных рефлексов и патологических знаков, улучшение координаторных проб). Нарастание неврологического дефицита в вышеозначенном периоде обусловил отек головного мозга, в связи с чем число выявленных нарушений возросло до 725. Распределение неврологических симптомов по типам представлено на рис. 2.
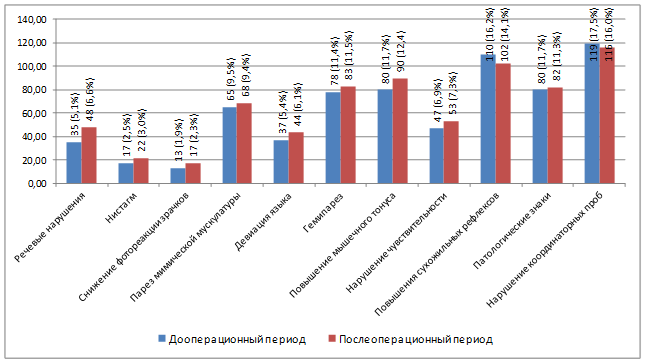
Рис. 2. Динамика неврологической симптоматики в пред- и послеоперационном периодах
Как уже говорилось выше, эпилептические приступы различного типа достаточно часто выступают в качестве сопутствующей симптоматики при новообразованиях головного мозга, и как их распространенность, так и рефрактерный к медикаментозному лечению статус ухудшаются по мере прогрессирования роста опухоли. Для улучшения контроля над эпилептическими припадками и качества жизни пациентов необходимо назначение антиэпилептического лечения.
У значительной части включенных в представленное исследование пациентов отмечалось наличие эпилептического синдрома с судорожными приступами, что обусловило необходимость проведения ЭЭГ для дифференциальной диагностики и уточнения локализации объемного процесса, а также назначения антиэпилептических препаратов в дооперационном и послеоперационном периодах. Кроме того, в случаях эпилептического синдрома также проводилось интраоперационное ЭКоГ-мониторирование. Данная техника была впервые применена в начале 1950-х гг. с целью более точной идентификации эпилептогенных очагов и облегчения хирургического лечения эпилепсии и, согласно исследованиям, применяется интраоперационно более чем 80% хирургов-эпилептологов во всем мире. На рис. 3 показана зависимость типа приступов от локализации опухоли.
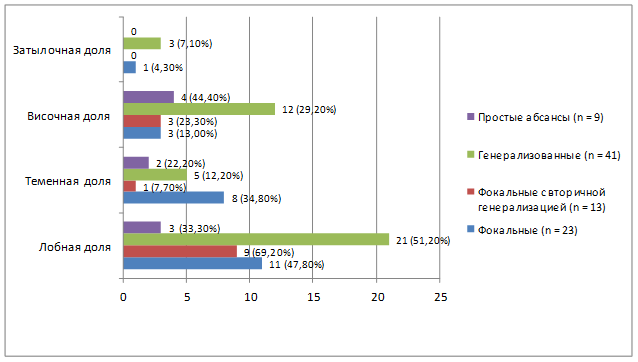
Рис. 3. Зависимость типа судорожных приступов от локализации опухоли
Достоверно значимые результаты p<0,05 в отношении корреляции локализации очага с распространением и типом новообразования получены для лобной доли в 3-й группе (12; 32,4%), теменной доли в 4-й группе (11; 40,7%); височной доли в 4-й группе (21; 36,8%); для затылочной доли в 1-й группе (8; 47,1%) [11].
Проведенное нашим пациентам в пред- и постоперационном периодах ЭКоГ-мониторирование показало положительную динамику в виде снижения количества приступов. В 1-й группе ЭКоГ проводилась 44 пациентам из 49, во 2-й – 6 из 11, в 3-й – 19 из 27 и в 4-й – 42 из 45 человек. Наши наблюдения показали, что после проведения оперативного вмешательства приступы прекратились у 30 из 44 пациентов (68,18%) в 1-й группе, у 2 из 6 (33,33%) – во 2-й группе, у 7 из 19 (36,38%) – в 3-й группе и у 26 из 42 больных (61,90%) – в 4-й группе. Таким образом, ЭКоГ-мониторирование продемонстрировало наибольшую эффективность у пациентов с менингиомами, лимфомами, метастазами, нейроцитомой и нейробластомой (1-я группа) и у больных с глиобластомами и глиосаркомами (4-я группа). Для пациентов с олигоастроцитомами и олигодендроглиомами (2-я группа), а также с анапластическими и фибриллярно-протоплазматическими астроцитомами (3-я группа) его эффективность оказалась несколько ниже, однако в этих группах приступы были купированы не менее чем у трети пробандов, которым был применен метод.
В плане распределения опухолей по гистологическому типу относительно их локализации в долях головного мозга нами отмечено, что фибриллярно-протоплазматические астроцитомы, глиобластомы и менингиомы характерны для лобной доли, тогда как глиобластомы, метастазирование, менингиомы – для теменной и височной долей, а метастазы и глиобластомы – для затылочной доли (рис. 4).
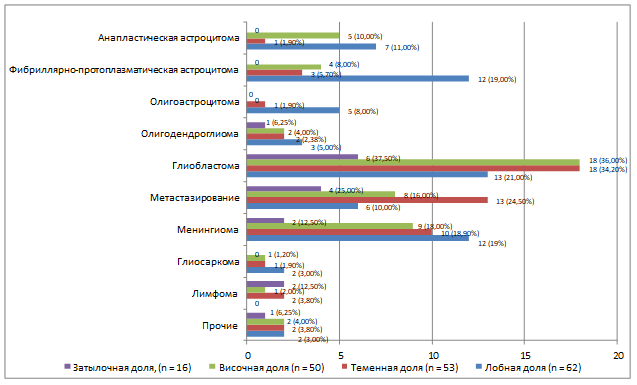
Рис. 4. Распределение локализации опухолей в зависимости от их гистологического типа
Всем 132 наблюдаемым проведено оперативное вмешательство. Впервые выявленные опухоли диагностированы у 98 (74,2%) из них, рецидивирующие – у 34 (25,8%). Тотальную резекцию опухоли удалось провести при следующих локализациях: в лобной доле – у 23 (37%); в теменной – у 26 (49%); в височной – у 24 (48%); в затылочной доле – у 10 (62,5%) пациентов. Субтотальная резекция осуществлена в случае следующих локализаций: в лобной доле – у 39 (63%); в теменной – у 27 (51%); в височной – у 26 (52%); в затылочной доле – у 6 (37,5%).
Распределение по группам новообразований головного мозга в зависимости от их локализации представлено на рис. 5.
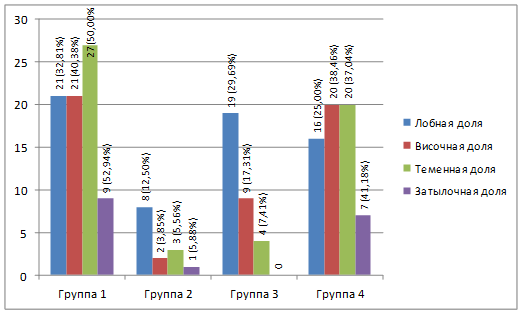
Рис. 5. Локализация в зависимости от типа опухоли
Основными клиническими проявлениями опухолей больших полушарий головного мозга, по нашим наблюдениям, выступали головная боль – у 32 (60,4%) больных; когнитивные нарушения – у 25 (47,1%); нарушение чувствительности – у 24 (45,3%); гемипарез – у 27 (50,9%); общая слабость – у 22 (41,5%), что соответствует литературным данным. МРТ-исследование у неврологов и нейрохирургов является «золотым стандартом» диагностики для оценки гистологического типа опухоли, характера роста, локализации и объема образования, а ранняя МРТ-диагностика позволяет улучшить прогноз для пациента. Подчеркнем еще раз, что судорожный приступ на фоне полного здоровья с большой долей вероятности позволяет заподозрить объемный процесс головного мозга. Проведение ЭЭГ на раннем этапе диагностики позволило установить диагноз эпилепсии у 86 включенных в наше исследование пациентов, а интраоперационное ЭКоГ-мониторирование – снизить на 49% частоту эпилептических приступов в послеоперационном периоде.
В дооперационном и послеоперационном периодах состояние пациентов оценивалось по шкале Карновского (Karnofsky Performance Status scale). Оценка проводилась при поступлении больного и при выписке с учетом локализации опухоли, что продемонстрировало следующую динамику: лобная доля – 73,4 балла против 77,1; теменная доля – 69,9 против 75; височная доля – 74,6 против 75,1; затылочная доля – 74,1 против 77,8. При оценке вышеуказанным методом в группах максимальная положительная динамика была отмечена во 2-й группе – 76,36 балла до операции и 80,91 балла – после; минимальные показатели, в свою очередь, зафиксированы в 4-й группе – 66,78 и 72,67 балла до и после оперативного вмешательства соответственно (рис. 1). Во всех группах, кроме 4-й, по шкале Карновского получены достоверно значимые (p<0,05) результаты в 1, 2 и 3-й группах (рис.6).
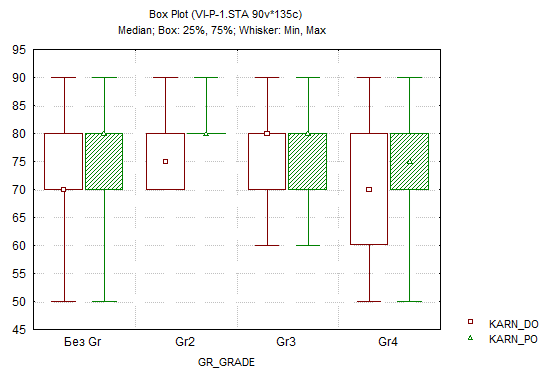
Рис. 6. Оценка состояния по шкале Карновского
Заключение. Полученные нами данные демонстрируют, что дифференцированный подход к оперативному лечению нейрохирургических пациентов, страдающих онкологическими заболеваниями головного мозга, обеспечивает снижение клинико-неврологического дефицита в раннем периоде после удаления новообразования на 6%.
Нами наблюдался ряд осложнений после оперативного вмешательства. Наиболее частыми из них были нарушения речи, двигательные и чувствительные нарушения, вызванные внутричерепными кровоизлияниями (26 (19,7%) наблюдений) и отеком головного мозга (87 (65,9%) пациентов). Ишемические изменения в этом периоде отмечались у 29 больных: в 8% наблюдений в лобной и в 14% – в височной доле.
Шкала эффективности Карновского за период многолетнего использования зарекомендовала себя как информативная методика для оценки состояния и качества жизни нейроонкологических пациентов. Нами этот метод применялся для оценки предоперационного и ближайшего послеоперационного состояния. Кроме того, шкала Карновского может применяться и как прогностический инструмент в отношении дальнейшего качества жизни пациентов на отдаленном постоперативном и реабилитационном этапах.
Таким образом, по результатам исследования можно прийти к выводу, что избранная нами и отраженная в представляемой работе методика мониторирования пациентов с опухолями больших полушарий головного мозга на всех этапах ведения представляется оптимальной. Подразумевается, что своевременная диагностика полушарных опухолей должна осуществляться на доклиническом этапе, включая поликлинический этап диагностики с проведением необходимых современных высокоинформативных исследований – нейровизуализационных (МРТ, а также КТ и позитронно-эмиссионная томография головного мозга) и нейрофизиологических (ЭЭГ). Интраоперационно больным с эпилептическим синдромом рекомендуется проведение ЭКоГ-мониторирования для обеспечения максимально эффективного удаления эпилептического очага. Дальнейшее клиническое ведение, наблюдение нейрохирурга и невролога в специализированном стационаре позволит вовремя выявить продолженный рост опухоли в случае развития такового, а при его отсутствии и, таким образом, успешности проведенного оперативного вмешательства по удалению новообразования – значимо улучшить реабилитационный потенциал и качество жизни пациентов.



