Одним из возможных осложнений факоэмульсификации (ФЭК) и ФЭК с фемтолазерным сопровождением является синдром сухого глаза (ССГ), приводящий у части пациентов к снижению их удовлетворенности результатами вмешательства как за счет появления или усиления субъективного дискомфорта (зрительные флуктуации, снижение скорости чтения), так и за счет ошибок в достижении целевой рефракции [1–3]. Патогенез этого варианта ССГ, получившего в зарубежной литературе название ятрогенного («iatrogenic dry eye»), связан с частичной денервацией роговицы (приводящей к снижению слёзопродукции, уменьшению частоты мигательных движений и развитию нейроэпителиопатии), а также с асептическим воспалением и воздействием консерванта глазных капель в послеоперационном периоде (вызывающим разрушение липидного слоя слёзной пленки, ухудшение морфофункционального состояния эпителия конъюнктивы и роговицы и снижение функциональной активности мейбомиевых желез) [1, 2, 4]. Все вышеизложенное явилось причиной включения в фармакологическое сопровождение катарактальной хирургии слёзозаместительной терапии, как правило, назначаемой на 8-е сутки после вмешательства [1, 5, 6].
Однако фоновые изменения глазной поверхности по типу ССГ диагностируются у значительного числа пациентов до проведения ФЭК, что обусловлено возрастным периодом данной категории больных (лица ≥55 лет), частичным возрастным андрогенодефицитом и другими факторами риска [1, 7, 8]. Так, по данным наших исследований, ССГ легкой степени (по классификации В.В. Бржеского и соавт., 2003; 2016) выявляется у 25,5% пациентов с катарактой до проведения ФЭК, а ССГ средней тяжести – у 27,7% больных [7]. С учетом этого представляется целесообразным проведение фармакологической подготовки, направленной на нормализацию состояния глазной поверхности, у пациентов с катарактой и ССГ перед выполнением ФЭК.
Необходимо подчеркнуть, что одним из наиболее распространенных факторов риска, статистически значимо связанных с ССГ, у пациентов с катарактой является дисфункция мейбомиевых желез (ДМЖ; частота – 77,7%; χ2=88,542; р<0,001; С´=0,580; сила связи «относительно сильная»), приводящая к развитию липидодефицита [7]. В связи с этим потенциальные возможности повышения эффективности фармакологического сопровождения катарактальной хирургии у пациентов с ССГ, с нашей точки зрения, могут быть связаны с проведением в предоперационном периоде терапевтической гигиены век (ТГВ), поскольку данные ряда исследований показывают, что указанное лечебное воздействие позволяет снизить выраженность липидодефицита, ассоциированного с ДМЖ [7, 9, 10].
По нашему мнению, приведенные факты обосновывают необходимость дальнейшей оптимизации как предоперационной терапевтической подготовки, так и послеоперационного фармакологического сопровождения у пациентов с ССГ и катарактой, что определило актуальность и цель нашего исследования.
Цель исследования: оценить клиническую эффективность различных подходов к фармакологическому сопровождению факоэмульсификации у пациентов с ССГ.
Материал и методы исследования. В исследование были включены 90 пациентов (90 глаз; 42 мужчины, 48 женщин; средний возраст – 67,5±3,6 года) с сенильной катарактой. Дизайн: открытое проспективное рандомизированное исследование. Критерии включения: незрелая, почти зрелая и зрелая сенильная катаракта; ССГ средней степени тяжести (по классификации В.В. Бржеского и соавт., 2003; 2016); ДМЖ [6]. Критерии исключения: осложненная катаракта; начальная и перезрелая сенильная катаракта; ССГ легкой, тяжелой и особо тяжелой степени; воспалительные заболевания органа зрения; глаукома; витреоретинальная патология.
Помимо стандартного офтальмологического обследования, у всех пациентов выполняли: оценку выраженности субъективных проявлений ССГ (OSDI); определение времени разрыва слёзной пленки (ВРСП; тест Норна, с); оценку состоятельности липидного слоя слёзной пленки (тест на липидинтерференцию по Norn в модификации J.S. Lopez Garsia и соавт., 2003) и состояния водного компонента слёзной пленки (тест Ширмера-1, мм; визуальная оценка высоты и индекса нижнего слёзного мениска); определение показателя ксероза по Bijsterveld (ПК; баллы) и выявление симптома «дворников» при окрашивании лиссаминовым зеленым [1, 11, 12].
Для оценки функции мейбомиевых желез и тяжести ДМЖ при ее выявлении проводили компрессионный тест Norn в модификации Korb (2002): отсутствие ДМЖ определяли, если прозрачный секрет выделялся не менее чем из 75% выводных протоков; ДМЖ легкой степени диагностировали, если прозрачный или «молочный» секрет выделялся не менее чем из 50% протоков; умеренную ДМЖ определяли в тех случаях, когда густой секрет выделялся менее чем из 50% протоков; тяжелую ДМЖ выявляли, если густой секрет выделялся менее чем из 25% протоков мейбомиевых желез [12, 13]. Полученные результаты выражали в баллах: нормофункция мейбомиевых желез (отсутствие ДМЖ) – 0 баллов; легкая ДМЖ – 1 балл; умеренная ДМЖ – 2 балла; тяжелая ДМЖ – 3 балла. В качестве дополнительного критерия для диагностики ДМЖ использовали выявление симптома «дворников»: окрашивание края века лиссаминовым зеленым свидетельствовало о снижении функциональной активности мейбомиевых желез и липидодефиците, вследствие чего развивалась эпителиопатия края века («lid viper» epitheliopathy) (рис. 1, 2) [7, 12, 13].
При анализе состоятельности липидного слоя слёзной пленки (интерференционный тест по Norn в модификации J.S. Lopez Garsia и соавт., 2003) исходили из того, что, по данным авторов, у офтальмологически здоровых лиц появление интерференционной картины происходит в условиях прикрывания глазничной щели на 50%, что соответствует нормальной толщине липидного слоя слёзной пленки [14]. В соответствии с этим, критерием наличия липидодефицита считали отсутствие формирования интерференционной картины при сужении глазной щели на 50%, что свидетельствует об уменьшении толщины липидного слоя слёзной пленки <65 нм [15]. Сочетание липидодефицита и дисфункции мейбомиевых желез классифицировали как липидодефицит, ассоциированный с ДМЖ [7, 14].
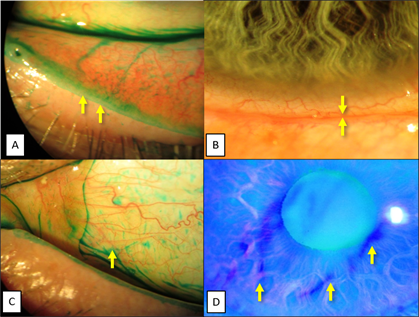 |
Вододефицит диагностировали при снижении суммарной слёзопродукции по результатам теста Ширмера-1 (ТШ-1) менее 15 мм и уменьшении высоты нижнего слёзного мениска (рис. 1, 2) [1, 6].
Рис. 1. Состояние глазной поверхности у пациентов 1-й группы при включении в исследование – ССГ средней тяжести на фоне липидо-водо-дефицита: А – ДМЖ средней тяжести (после компрессии густой секрет выделяется менее чем из 50% желез), симптом «дворников», липидодефицит; В – уменьшение высоты нижнего слёзного мениска при его визуальной оценке, вододефицит; С – патологического окрашивания конъюнктивы лиссаминовым зелёным не выявляется, муцинодефицит отсутствует; D – определение времени разрыва слёзной пленки (тест Норна), рисунок разрыва слёзной пленки
Рис. 2. Состояние глазной поверхности у пациентов 2-й группы при включении в исследование – ССГ средней тяжести на фоне липидо-водо-муцино-дефицита: А – ДМЖ средней тяжести (после компрессии густой секрет выделяется менее чем из 50% желез), симптом «дворников», липидодефицит; В – уменьшение высоты нижнего слёзного мениска, вододефицит; С – определяется >50 пятен лиссаминового зеленого, муцинодефицит
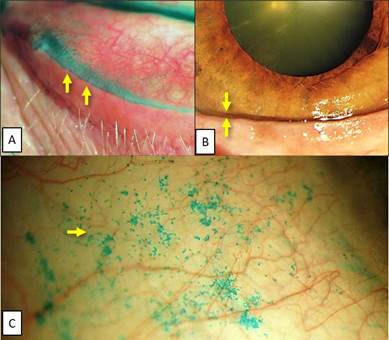 |
Муцинодефицит («заякоренных» муцинов) определяли при значениях показателя ксероза по Bijsterveld больше 3 баллов при суммарной оценке трех полей: роговица, назальная и каудальная конъюнктива (рис. 1, 2) [11].
Нами были выделены две группы наблюдения. В 1-ю группу включили 45 пациентов с ССГ средней тяжести на фоне комбинированного липидо-водо-дефицита (рис. 1). Критерии включения: OSDI >15 баллов; ВРСП <10 с; тест Ширмера-1 <15 мм; липидодефицит, ассоциированный с ДМЖ; ПК ≤3 баллов.
Во 2-ю группу вошли 45 больных с ССГ средней тяжести в условиях комбинированного липидо-водо-муцино-дефицита (рис. 2). Критерии включения: OSDI >15 баллов; ВРСП <10 с; тест Ширмера-1 <15 мм; липидодефицит, ассоциированный с ДМЖ; ПК >3 баллов.
Всем наблюдавшимся была выполнена ФЭК с имплантацией ИОЛ (Eva, Dorc, EU). Перед проведением хирургического вмешательства пациенты обеих групп при помощи блоковой рандомизации были распределены в три подгруппы [15].
Пациентам подгрупп 1.1 и 2.1 терапевтическая подготовка к ФЭК не проводилась. Больные остальных подгрупп в качестве фармакологического сопровождения ФЭК в предоперационном периоде получали слёзозаместительную терапию (4 раза в сутки 1 месяц): пациенты подгрупп 1.2 и 1.3 – инстилляции 0,3% натрия гиалуроната (НГ), а подгрупп 2.2 и 2.3 – 0,3% НГ и 3% трегалозы (ТР). Определяя дифференцированные подходы к слёзозамещению, в зависимости от изменений глазной поверхности мы ориентировались на рекомендации международного соглашения по ССГ (TFOS-DEWS-II), а также результаты ранее проведенных исследований [1, 6, 16].
Пациенты подгрупп 1.3 и 2.3 в предоперационном периоде перед ФЭК дополнительно получали терапевтическую гигиену век на основе использования изделий ООО «Гельтек-Медика»: Блефарогель-очищение, Блефаролосьон, Блефарогель-1 (2 раза в сутки 1 месяц). ТГВ является патогенетически ориентированным лечебным воздействием у больных с ДМЖ и ССГ, целью которого служит попытка восстановления функции мейбомиевых желез и уменьшения выраженности липидодефицита, ассоциированного с ДМЖ [10, 13, 17].
Терапевтическая гигиена век включала четыре этапа. Целями 1-го этапа ТГВ были: очищение век, в том числе их ресничного края; противовоспалительное воздействие; нормализация консистенции загустевшего липидного секрета мейбомиевых желез [10, 17]. В ходе 1-го этапа ТГВ применяли Блефарогель-очищение, содержащий следующие компоненты: полоксамер 184 (обладающий очищающими свойствами); полиглицерил-4 капрат (эмульгатор растительного происхождения), сок алоэ вера и D-пантенол (обладающие противовоспалительным, репаративным и дерматопротективным эффектами).
Цели 2-го этапа ТГВ включали: нормализацию консистенции секрета мейбомиевых желез; противовоспалительное воздействие [10, 13, 17]. Для этого проводили теплые компрессы (t≈38°C; 5 мин) на область век с использованием Блефаролосьона или Блефаросалфетки. Блефаролосьон содержит в своем составе поливинилпирролидон (обладающий сорбирующими свойствами и являющийся фармакологической основой искусственной слезы), экстракты ромашки, зеленого чая и гамелиса (оказывающие противовоспалительное, противоотечное и асептическое воздействие на веки) [10]. Блефаросалфетка дополнительно содержит экстракт календулы, обладающий противовоспалительным эффектом.
Целью 3-го этапа ТГВ была эвакуация пробок из загустевшего секрета мейбомиевых желез из их выводных протоков путем проведения точечного кругового самомассажа краев век [9, 10, 17]. В завершение этого этапа при необходимости осуществляли повторное очищение краев век от измененного загустевшего секрета.
Целями 4-го этапа ТГВ были: репаративное и регидратирующее воздействие (для снижения выраженности эпителиопатии краев век – «lid viper epitheliopathy» и восстановления функциональной активности мейбомиевых желез) [10, 17]. В ходе 4-го этапа ТГВ пациенты проводили аппликации на край век средства Блефарогель-1, содержащего гиалуронат натрия и экстракт алоэ, что позволяло осуществлять необходимое лечебное воздействие [10].
В послеоперационном периоде фармакологическое сопровождение ФЭК включало инстилляции 0,5% левофлоксацина (5 раз в сутки 7 дней), 0,1% дексаметазона (3 раза в сутки 7 дней), 0,09% бромфенака (2 раза в сутки, с 8-го дня после ФЭК), слёзозамещение (3 раза в сутки, с 8-х суток после ФЭК: в 1-й группе – инстилляции 0,3% НГ; во 2-й группе – 0,3% НГ и ТР).
Контрольными точками были: 1) осмотр при включении в исследование; 2) осмотр перед ФЭК после предоперационной терапевтической подготовки (кроме пациентов подгрупп 1.1. и 2.1); 3) осмотр через 1 месяц после ФЭК и его послеоперационного фармакологического сопровождения.
Критерии оценки состояния глазной поверхности во всех контрольных точках включали: OSDI (баллы), ВРСП (с), тяжесть ДМЖ (Т-ДМЖ, баллы), ТШ-1 (мм), ПК (баллы). В 3-й контрольной точке оценивали эффективность различных подходов к фармакологическому сопровождению ФЭК. Помимо определения вышеперечисленных критериев, в 3-й контрольной точке проводили оценку удовлетворенности пациентов (УДП) результатами ФЭК (УДП-ФЭК; баллы, по 5-балльной шкале, где балльной оценке «5» соответствовала максимальная удовлетворенность пациентов результатами хирургии).
Статистическая обработка полученных результатов включала расчет: М±SD; U-критерия Манна–Уитни (оценка достоверности различий в двух подгруппах); Т-критерия Краскела–Уоллиса и двухвыборочного критерия Уилкоксона (оценка достоверности различий в трех подгруппах); критерия Уилкоксона (оценка достоверности различий между контрольными точками в пределах одной подгруппы) [15]. Проводили расчет эмпирических значений указанных критериев и сравнение их с критическими значениями, определенными исходя из числа пациентов в подгруппах наблюдения; значение р определяли по таблице; различия считали достоверными при р<0,05 [15].
Исследование выполнялось в рамках гранта Российского Фонда фундаментальных исследований и Министерства образования, науки и молодежной политики Краснодарского края № 19-415-230007 р_а (договор № 19-415-230007\21 от 20.04.2022 г.). Авторы не имеют финансовых или имущественных интересов в упомянутых материалах и методах.
Результаты исследования и их обсуждение. Симптомы и признаки, характеризующие состояние глазной поверхности у пациентов обеих групп, представлены в таблице 1. Все лица, включенные в исследование, имели ССГ средней степени тяжести (вододефицит по результатам ТШ-1) [1, 6]. Также у всех наблюдавшихся выявлялся липидодефицит, ассоциированный с ДМЖ (в соответствии с вышеописанными критериями) [7, 12, 14]. Различия в тяжести ДМЖ оказались статистически не значимыми.
Таблица 1
Состояние глазной поверхности у пациентов 1-й и 2-й групп на момент включения в исследование, M±SD
|
Оцениваемые показатели
|
1-я группа наблюдения: ССГ средней тяжести на фоне липидо-водо-дефицита |
2-я группа наблюдения: ССГ средней тяжести на фоне липидо-водо-муцино-дефицита |
|
OSDI, баллы |
38,13±4,2 |
49,9±4,6 * |
|
ВРСП, с |
5,3±0,47 |
4,65±0,63 * |
|
Т-ДМЖ, баллы |
2,5±0,27 |
2,7±0,13 |
|
ТШ-1, мм |
9,2±0,57 |
7,2±0,53 * |
|
ПК, баллы |
2,45±0,1 |
6,2±0,53 * |
|
Примечание: *достоверность различия между группами 1 и 2 (критерий Манна–Уитни; р<0,05) |
||
Тем не менее, у больных 2-й группы показатель OSDI был достоверно выше, а ВРСП достоверно ниже, чем у пациентов 1-й группы, что говорит о более выраженных изменениях глазной поверхности в рамках средней степени клинической тяжести ССГ. По нашему мнению, это было связано с наличием муцинодефицита заякоренных муцинов (ПК>3 баллов по Bijsterveld) у больных 2-й группы, а также с достоверно большей выраженностью вододефицита.
Динамика состояния глазной поверхности у пациентов 1-й группы на фоне фармакологического сопровождения ФЭК показана в таблице 2. Во 2-й контрольной точке статистически значимое положительное влияние предоперационной подготовки на ВРСП и OSDI было зафиксировано как в подгруппе 1.2 (слёзозамещение), так и в подгруппе 1.3 (слёзозамещение + ТГВ), однако положительная динамика указанных показателей была статистически достоверно более выраженной в подгруппе 1.3. С нашей точки зрения, это может быть связано со статистически значимым снижением Т-ДМЖ в результате проведения ТГВ у этих пациентов, что способствовало восстановлению липидного слоя слёзной пленки (СП) и, как следствие, более выраженному увеличению ВРСП, чем при проведении слёзозамещения, что соотносится с результатами ранее проведенного нами исследования [17]. В подгруппе 1.2 динамика тяжести ДМЖ на фоне слёзозамещения оказалась статистически не значимой, а стабилизация СП и купирование субъективного дискомфорта были обусловлены влиянием слёзозаместительной терапии (протезирование водного компонента СП, связывание нативного водного слоя СП).
В свою очередь, более выраженное увеличение ВРСП у пациентов подгруппы 1.3 приводило к более выраженному снижению ПК (несмотря на то, что его исходные значения находились в пределах нормы в соответствии с критерием Bijsterveld, то есть были <3 баллов). Результатом более выраженной положительной динамики со стороны ПК и ВРСП у больных подгруппы 1.3 было более выраженное купирование показателя OSDI. Динамика ТШ-1 во 2-й контрольной точке оказалась статистически не значимой в обеих рассматриваемых подгруппах, в которых проводилась предоперационная подготовка.
В 3-й контрольной точке у пациентов подгруппы 1.1 (отсутствие предоперационной подготовки, слёзозамещение в послеоперационном периоде) была отмечена статистически значимая отрицательная динамика показателей OSDI, ВРСП и ПК сравнительно с состоянием до ФЭК, что соотносится с данными нескольких исследований, продемонстрировавших негативное влияние ФЭК на состояние глазной поверхности [2–4]. У больных подгруппы 1.2. (периоперационное слёзозамещение) в 3-й контрольной точке все оцениваемые показатели не имели статистически значимых отличий от состояния при включении в исследование, однако OSDI и ВРСП показали статистически значимую отрицательную динамику сравнительно со 2-й контрольной точкой. У пациентов подгруппы 1.3 (предоперационное слёзозамещение + ТГВ и послеоперационное слёзозамещение) показатели OSDI, ВРСП, Т-ДМЖ и ПК в 3-й контрольной точке были достоверно лучше, чем у больных двух других подгрупп, что, с нашей точки зрения, обусловило достоверно большую удовлетворенность этих пациентов результатами ФЭК (табл. 4). Перечисленные показатели в этой контрольной точке оставались достоверно лучше, чем при включении в исследование, а тенденция к их ухудшению сравнительно со 2-й контрольной точкой оказалась статистически не значимой. Динамика ТШ-1 во всех подгруппах на протяжении наблюдения была недостоверной. Отрицательная динамика Т-ДМЖ после ФЭК также была статистически не значимой во всех подгруппах.
Таблица 2
Динамика состояния глазной поверхности у пациентов 1-й группы, M±SD
|
Оцениваемые показатели
|
1-я группа наблюдения: ССГ средней тяжести на фоне липидо-водо-дефицита) |
|||||||
|
Подгруппа 1.1 |
Подгруппа 1.2 |
Подгруппа 1.3 |
||||||
|
1 контроль |
3 контроль |
1 контроль |
2 контроль |
3 контроль |
1 контроль |
2 контроль |
3 контроль |
|
|
OSDI, баллы
|
37,9± 4,6 |
49,4± 4,6 ≈ |
38,3± 3,8 |
29,4± 4,5 ≈ |
36,1± 3,9 ⌐ |
38,2± 4,2 |
19,2± 4,3 * ≈ |
23,1± 2,4 * # ≈ |
|
ВРСП, с
|
5,4± 0,5 |
4,4± 0,3 ≈ |
5,3± 0,5 |
6,6± 0,7 ≈ |
5,2± 0,4 ⌐ |
5,2± 0,5 |
7,3± 0,6 * ≈ |
6,9± 0,5 * # ≈ |
|
Т-ДМЖ, баллы
|
2,5± 0,5 |
2,8± 0,4
|
2,4± 0,5 |
2,3± 0,5 |
2,5± 0,5
|
2,5± 0,5 |
1,5± 0,5 * ≈ |
1,6± 0,5 * # ≈ |
|
ТШ-1, мм |
9,1± 0,9
|
8,5± 0,9
|
9,3± 0,1
|
9,5± 1,1
|
9,4± 1,3
|
9,2± 1,2
|
9,6± 1,3
|
9,5± 1,1
|
|
ПК, баллы
|
2,5± 0,1
|
3,2± 0,3 ≈ |
2,44± 0,1
|
1,84± 0,1 ≈ |
2,1± 0,2
|
2,4± 0,2
|
1,3± 0,1 * ≈ |
1,5± 0,2 * # ≈ |
|
Примечание: *достоверность различия между подгруппами 1.2 и 1.3 (критерий Манна–Уитни; р<0,05) #достоверность различия между всеми подгруппами (критерий Краскела–Уоллиса + двухвыборочный критерий Уилкоксона; р<0,05) ≈достоверность различия с 1-й контрольной точкой (критерий Уилкоксона; р<0,05) ⌐достоверность различия со 2-й контрольной точкой (критерий Уилкоксона; р<0,05) |
||||||||
Таким образом, фармакологическое сопровождение ФЭК у пациентов с ССГ на фоне липидо-водо-дефицита, включающее предоперационное слёзозамещение + ТГВ и послеоперационное слёзозамещение, показало лучшую клиническую эффективность, чем послеоперационная слёзозаместительная терапия или периоперационное слёзозамещение. Важно отметить, что данный подход обеспечил достоверно большую субъективную удовлетворенность пациентов результатами ФЭК (табл. 4).
Динамика показателей, характеризующих состояние глазной поверхности, на фоне фармакологического сопровождения ФЭК у больных 2-й группы приведена в таблице 3. Как следует из данных, представленных в таблице 3, статистически значимая положительная динамика показателей OSDI и ВРСП в результате предоперационной подготовки была отмечена как после слёзозаместительной терапии (подгруппа 2.2), так и после слёзозаместительной терапии в сочетании с ТГВ (подгруппа 1.3). Вместе с тем положительная динамика OSDI и ВРСП была более выраженной у пациентов подгруппы 1.3, что, по нашему мнению, было связано с достоверным снижением показателя Т-ДМЖ после проведения ТГВ и частичным купированием липидодефицита. Динамика показателя Т-ДМЖ у больных подгруппы 2.2 ожидаемо оказалась статистически не значимой. Положительная динамика показателей ВРСП и OSDI у пациентов подгруппы 2.2 была обусловлена влиянием предоперационной слёзозаместительной терапии: протезирование водного компонента СП, связывание остаточного нативного водного компонента СП (0,3% НГ); компенсация муцинодефицита заякоренных муцинов, то есть снижение выраженности эпителиопатии конъюнктивы и роговицы (3% ТР) [1, 6, 11].
Статистически значимая положительная динамика ПК также была зафиксирована в обеих рассматриваемых подгруппах, в которых проводилась предоперационная терапевтическая подготовка (табл. 3), однако снижение ПК было достоверно более выраженным у пациентов подгруппы 2.3 (слёзозамещение + ТГВ). В подгруппе 2.2 положительная динамика ПК была связана со слёзозамещением (воздействие гиалуроновой кислоты и трегалозы), что соотносится с данными нашего ранее проведенного исследования [17]. Более выраженное снижение ПК у больных подгруппы 2.3, с нашей точки зрения, было связано с более выраженным увеличением ВРСП, которое, в свою очередь, определялось снижением выраженности липидодефицита, ассоциированного с ДМЖ, в результате ТГВ. Динамика ТШ-1 в результате предоперационной подготовки продемонстрировала тенденцию к увеличению показателя в обеих подгруппах, однако она оказалась статистически не значимой.
Таблица 3
Динамика состояния глазной поверхности у пациентов 2-й группы, M±SD
|
Оцениваемые показатели
|
2-я группа наблюдения: ССГ средней тяжести на фоне липидо-водо-муцино-дефицита |
|||||||
|
Подгруппа 2.1 |
Подгруппа 2.2
|
Подгруппа 2.3
|
||||||
|
1 контроль
|
3 контроль
|
1 контроль
|
2 контроль
|
3 контроль
|
1 контроль
|
2 контроль
|
3 контроль
|
|
|
OSDI, баллы
|
49,8± 3,1 |
63,7± 6,5 ≈ |
49,9± 5,7 |
38,9± 4,2 ≈ |
50,2± 6,2 ⌐ |
50,1± 5,05 |
27,1± 3,5 * ≈ |
29,3± 6,8 * # ≈ |
|
ВРСП, с
|
4,6± 0,6 |
3,7± 0,6 ≈ |
4,64± 0,6 |
5,74± 0,6 ≈ |
4,9± 0,5 ⌐ |
4,7± 0,7 |
6,6± 0,8 * ≈ |
6,2± 0,6 * # ≈ |
|
Т-ДМЖ, баллы
|
2,7± 0,5 |
2,9± 0,3
|
2,7± 0,4
|
2,6± 0,6 |
2,7± 0,6
|
2,8± 0,4 |
1,9± 0,3 * ≈ |
1,8± 0,4 * # ≈ |
|
ТШ-1, мм
|
7,1± 0,9
|
6,9± 0,8
|
7,3± 0,7
|
7,56± 0,9
|
7,5± 0,7
|
7,3± 0,5
|
7,67± 0,8
|
7,6± 0,9
|
|
ПК, баллы
|
6,1± 0,5 |
6,9± 0,3 ≈ |
6,3± 0,5 |
5,1± 0,3 ≈ |
5,9± 0,5 ⌐ |
6,2± 0,6 |
4,5± 0,4 * ≈ |
4,7± 0,4 * # ≈ |
|
Примечание: *достоверность различия между подгруппами 2.2 и 2.3 (критерий Манна–Уитни; р<0,05) #достоверность различия между всеми подгруппами (критерий Краскела–Уоллиса + двухвыборочный критерий Уилкоксона; р<0,05) ≈достоверность различия с 1-й контрольной точкой (критерий Уилкоксона; р<0,05) ⌐достоверность различия со 2-й контрольной точкой (критерий Уилкоксона; р<0,05) |
||||||||
В 3-й контрольной точке у пациентов, получавших только послеоперационное фармакологическое сопровождение (подгруппа 2.1), показатели OSDI, ВРСП и ПК продемонстрировали статистически значимую отрицательную динамику относительно осмотра при включении в исследование (табл. 3). Полученные нами результаты, в целом, соотносятся с данными ряда исследований, показавших отрицательное влияние катарактальной хирургии (ФЭК и ФЭК с фемтолазерным сопровождением) на состояние глазной поверхности [2–4]. У больных, получавших периоперационное слёзозамещение (подгруппа 2.2), в 3-й контрольной точке значения показатели OSDI, ВРСП, Т-ДМЖ, ТШ-1 и ПК не отличались от исходных (при включении в исследование). Тем не менее, показатели OSDI, ВРСП и ПК показали статистически значимую отрицательную динамику сравнительно со 2-й контрольной точкой (состояние после предоперационной подготовки перед ФЭК). У больных подгруппы 2.3, получавших предоперационную подготовку (слёзозамещение + ТГВ) и послеоперационную слёзозаместительную терапию, показатели OSDI, ВРСП, Т-ДМЖ и ПК в 3-й контрольной точке были достоверно лучше, чем в 1-й контрольной точке, тенденция к их ухудшению относительно 2-й контрольной точки была статистически не значимой (табл. 3). Необходимо отметить, что значения показателей OSDI, ВРСП, Т-ДМЖ и ПК у пациентов подгруппы 2.3 были достоверно лучше, чем у больных остальных подгрупп 2-й группы, что, по нашему мнению, определило достоверно большую субъективную удовлетворенность пациентов подгруппы 2.3 результатами ФЭК (табл. 4).
Таблица 4
Удовлетворенность пациентов результатами хирургии на 30-е сутки после ФЭК, M±SD
|
Группы наблюдения |
Подгруппы наблюдения
|
Удовлетворенность пациентов, баллы |
|
Группа 1
|
Подгруппа 1.1 |
4,1±0,1 |
|
Подгруппа 1.2 |
4,25±0,2 |
|
|
Подгруппа 1.3 |
4,75±0,1 * |
|
|
Группа 2
|
Подгруппа 2.1 |
3,8±0,64 |
|
Подгруппа 2.2 |
4,1±0,61 |
|
|
Подгруппа 2.3 |
4,62±0,1 * |
|
|
Примечание: *достоверность различия между подгруппами в пределах группы (критерий Краскела–Уоллиса + двухфакторный критерий Уилкоксона; р<0,05) |
||
Полученные нами результаты дают основание заключить, что фармакологическое сопровождение ФЭК у пациентов с ССГ на фоне липидо-водо-муцино-дефицита (предоперационное слёзозамещение + ТГВ и послеоперационная слёзозаместительная терапия) продемонстрировало большую клиническую эффективность, чем тактика, основанная на послеоперационном или периоперационном слёзозамещении. Важным обстоятельством является тот факт, что достоверно большая субъективная удовлетворенность наблюдавшихся результатами ФЭК была зафиксирована именно в подгруппе 2.3 (сравнительно с другими подгруппами), что, с нашей точки зрения, было связано с достоверно лучшими значениями показателей, характеризующих состояние глазной поверхности у этих пациентов в 3-й контрольной точке (табл. 3, 4).
Заключение. Фармакологическое сопровождение у пациентов с катарактой ССГ и ДМЖ, включавшее слёзозамещение и терапевтическую гигиену век перед ФЭК и слёзозамещение после операции, позволило достичь достоверно лучших значений OSDI, ВРСП, тяжести ДМЖ и удовлетворенности пациентов результатами ФЭК через месяц после хирургии сравнительно с тактикой, основанной на слёзозамещении в послеоперационном периоде или периоперационном слёзозамещении.



