Гипоксически-ишемические повреждения миокарда занимают ведущее место в структуре перинатальных повреждений сердечно-сосудистой системы у глубоконедоношенных новорожденных [1]. Неблагоприятный медико-биологический и социальный прогноз определяет значимость данной патологии [2]. По литературным данным [3], последствия гипоксической кардиопатии, характеризующиеся снижением сократительной функции миокарда, перегрузкой правых отделов сердца и нарушениями ритма, могут сохраняться в течение 3–6 месяцев после рождения детей. Связанные с кислородным голоданием и тканевой гипоксией структурные изменения в миокарде, как правило, характеризуются мелкоочаговыми повреждениями в виде субэндокардиального и папиллярного некроза, капилляростаза, микротромбоза, периваскулярных геморрагий, способствующих контрактурным повреждениям кардиомиоцитов [4, 5]. В современной литературе появились сведения о взаимосвязи между повреждением митохондрий и дисфункцией тканевых структур фетоплацентарного комплекса (ФПК) [6]. Очевидно, сердце, как и другие органы ФПК, подвергается окислительному стрессу [7], в связи с чем изменяются морфофункциональные характеристики кардиомиоцитов и сократительная способность миокарда [8, 9], детальное изучение морфогенеза нарушений которой у глубоконедоношенных новорожденных приобретает особую актуальность. Повреждающее воздействие гипоксии на миокард перинатального периода представляется мультифакториальным [10], а морфогенетические изменения кардиомиоцитов – до конца не изученными. В кардиологии среди клинико-лабораторных методов исследования особую актуальность приобретает количественное определение в крови пациентов биохимических маркеров гипоксически-ишемического повреждения миокарда. К таковым относятся тропонин и миоглобин. Субъединицы тропонинового комплекса (I, T, С) входят в состав контрактильного аппарата мышечных клеток [11, 12]. Миоглобин – кислород-связывающий белок, обеспечивающий энергетический потенциал сократительной функции миокарда [13]. В неонатологии тропонины применяются в качестве биохимических маркеров некроза кардиомиоцитов. Отмечено повышение миоглобина и тропонинов в крови у детей с внутрижелудочковыми кровоизлияниями и врожденными пороками сердца (ВПС), в том числе и у глубоконедоношенных новорожденных [14]. Однако в литературе практически отсутствуют сведения об особенностях экспрессии указанных биомаркеров непосредственно в миокарде.
Цель исследования: изучить структурные особенности миокарда, определяющие его сократительную способность, у новорожденных с экстремально низкой (ЭНМТ) и очень низкой массой тела (ОНМТ), развивавшихся в условиях хронической внутриутробной гипоксии.
Материалы и методы исследования. Выполнено морфологическое исследование сердца 25 умерших новорожденных с экстремально низкой массой тела (ЭНМТ) – от 500 до 999 г (1-я группа) и 15 детей с очень низкой массой тела (ОНМТ) – от 1000 до 1499 г (2-я группа). Комплексное исследование включало органометрию, обзорную гистологию, морфометрию, иммуногистохимическое исследование с антителами к сердечному тропонину Т (сТnT) и миоглобину, а также трансмиссионную электронную микроскопию. Материалом для исследования являлись иссеченные из правого и левого желудочков сердца фрагменты.
Для гистологического исследования использовали стандартный метод парафиновой проводки материала с последующей окраской препаратов гематоксилином и эозином. Стандартное иммуногистохимическое исследование на парафиновых срезах включало этапы обработки тканей в условиях высокой температуры, демаскирования антигена, блокирования эндогенной пероксидазы. В работе применялись кроличьи антитела: моноклональные к тропонину T (1:800) и поликлональные к миоглобину (1:800) (Biorbyt, Великобритания). Для концептуализации комплексов «антиген-антитело» на гистологических препаратах использовали систему детекции «UltraVision» (ThermoFisher Scientific, USA). Для оценки экспрессии сердечного тропонина Т применяли основанный на визуализации полуколичественный метод, в соответствии с которым отрицательную экспрессию биомаркера обозначали знаком «–», а положительную – знаком «+» с учетом того, что последняя может быть слабой (+), умеренной (++) и выраженной (+++). Интенсивность реакции «антиген-антитело» оценивали в 100 клетках 10 полей зрения при увеличении светового микроскопа в 400 раз (×400). При оценке экспрессии миоглобина количественным методом определяли индекс экспрессии (ИЭ) биомаркера по известной формуле [15]:
ИЭ = ∑P(i) /100 у.е.,
где I – интенсивность окраски иммунных комплексов в баллах от 0 до 3;
Р(i) – процент клеток, окрашенных по-разному.
Гистостереометрию интерстиция и мышечной части миокарда правого желудочка – вычисление средней площади ядра кардиомиоцита и определение удельной плотности ядер в единице площади ткани – проводили с использованием компьютерной программы «ВидеоТест-Морфология-4.0».
Для электронно-микроскопического исследования материал после фиксации и постфиксации обезвоживали и заключали в смолы. Подготовленные для дальнейшей обработки ультратонкие срезы с целью контрастирования последовательно обрабатывали 3%-ным уранилацетатом, 100%-ным метиловым спиртом и цитратом свинца. Изучение ультратонких срезов осуществляли при помощи электронного микроскопа ЭВМ-100АК. Цифровой материал обработан с помощью стандартного пакета программного обеспечения «Statistica». Достоверность различий между вариационными рядами с нормальным типом распределения оценивали с помощью t-критерия Стьюдента. Для малых выборок использовали непараметрический критерий Манна–Уитни.
Результаты исследования и их обсуждение. Внутриутробно новорожденные 1-й и 2-й групп развивались в условиях хронической субкомпенсированной фетоплацентарной недостаточности (ХСФПН), которая явилась одной из основных причин развития преждевременных родов. Структурную основу ХСФПН составили хронические нарушения материнского (32%) и фетального (28%) кровообращения в сочетании с воспалением (67,3%). В плацентах новорожденных 2-й группы чаще (р=0,01) определялись материнская (32%) и фетальная мальперфузия (44%), преждевременная отслойка нормально расположенной плаценты (67%) и хронические инфаркты (33%). Базальный (68,8%) и париетальный (62,5%) децидуит и хронический виллузит промежуточных ворсин (56,3%) с поствоспалительной гиповаскуляризацией стромы ворсин (50%) чаще диагностировались в 1-й группе (p=0,05). Патологические изменения в исследуемых плацентах развивались на фоне несформированных компенсаторных процессов. В плацентах обеих групп были диагностированы лишь адаптационные перестройки в виде дилатации и полнокровия капилляров промежуточных ворсин.
Новорожденные исследуемых групп по соматическому статусу соответствовали сроку гестации (табл. 1).
Таблица 1
Антропометрические показатели новорожденных в зависимости от гестационного возраста, Me [25;75]
|
Параметры |
1-я группа 22–27 недель, n=25 |
2-я группа 28–32 недели, n=15 |
Достоверность различий, р |
|
Масса, г |
582,5 [465,0; 700,0] |
1260,0 [960,0; 1400,0] |
0,001 |
|
Длина, см |
28,5 [24,0; 32,0] |
38,0 [31,0; 39,0] |
0,002 |
|
Окружность головы, см |
23,0 [20,0; 24,5] |
27,5 [26,0; 28,0] |
0,002 |
|
Окружность груди, см |
19,7 [18,0; 22,0] |
24,0 [23,0; 25,0] |
0,002 |
Продолжительность жизни новорожденных 1-й группы в среднем составила 3,5 суток, у детей 2-й группы – 3 суток. Органометрия и раздельное взвешивание сердца, выполненные при патологоанатомическом исследовании умерших детей, позволили выявить у новорожденных 2-й группы значимое (р=0,01) увеличение показателя массы сердца (9,05±1,38 г) по отношению к аналогичному параметру детей 1-й группы (7,16±1,76 г), обусловленное не только закономерным ростом плода по мере увеличения гестационного возраста, но и избирательной гипертрофией правого желудочка. Структурной основой последней, по данным гистометрии, является увеличение показателей удельной площади его мышечной части и площади ядра гладкомышечной клетки. Кроме того, удельная площадь интерстиция миокарда у детей с ОНМТ значимо меньше аналога новорожденных с ЭНМТ (табл. 2).
Таблица 2
Морфометрические параметры правого желудочка сердца
|
Морфометрические параметры |
1-я группа 22–27 недель, n=25 |
2-я группа 28–32 недели, n=15 |
Достоверность различий, р |
|
Площадь ядер кардиомиоцитов, мкм² |
20,72 [19,4; 22,57] |
26,84 [22,08; 24,51] |
0,001 |
|
Плотность расположения ядер кардиомиоцитов |
591 [552; 602] |
510 [497; 521] |
0,04 |
|
Удельная площадь мышечного компонента миокарда, % |
78,83 [76,78; 79,24] |
85,24 [83,42; 86,92] |
0,004 |
|
Удельная площадь интерстициального компонента миокарда, % |
21,17 [20,06; 22,23] |
14,76 [13,08; 16,58] |
0,001 |
При морфологическом исследовании миокарда у всех глубоконедоношенных новорожденных в правом желудочке сердца обнаруживались изменения в виде нарушений архитектоники и фрагментации кардиомиоцитов, участков венозного застоя и геморрагий диапедезного характера, обусловленных гипоксией. Патоморфологическими особенностями миокарда детей с ЭНМТ являются выраженные в значительной степени внутриклеточный цитолиз, распространенные микроциркуляторные нарушения, инфильтрация эозинофилами, беспорядочное расположение кардиомиоцитов относительно друг друга на фоне отека интерстиция. Гипоксические повреждения выявлены в сосудах разного калибра и топографии (субэндокардиальных, субэпикардиальных и интрамиокардиальных отделах миокарда). Сосуды микроциркуляторного русла в основном были дилатированы, что носило компенсаторный характер, поскольку увеличение площади соприкосновения сосудов с окружающими тканями играет важную роль в осуществлении обменных процессов между кровью и тканями, а также является ключевым звеном регенерации.
Иммуногистохимическое исследование маркеров ранних гипоксических повреждений кардиомиоцитов и сократительной функции миокарда – тропонина Т и миоглобина – позволило выявить следующие особенности. Экспрессия тропонина Т у новорожденных 1-й группы была слабовыраженной (+), а в зонах гипоксически-обусловленного некроза миокарда – отрицательной (рис. 1).
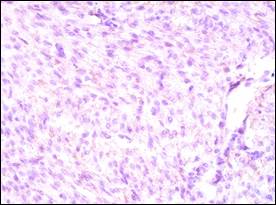
Рис. 1. Миокард новорожденного 25 недель гестации. Слабая (+) экспрессия сердечного тропонина Т, некроз кардиомиоцитов. ИГХ с антителами к сердечному тропонину Т, визуализация диаминобензидином. СМ ×400
Дети 2-й группы отличались умеренно выраженной (++) экспрессией биомаркера в структурированном миокарде правого желудочка сердца и выраженной (+++) – в субэпикардиальных отделах (рис. 2).
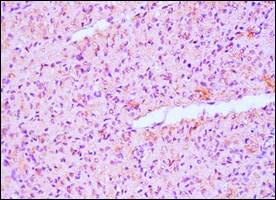
Рис. 2. Миокард новорожденного 30 недель гестации. Выраженная экспрессия сердечного тропонина Т. ИГХ с антителами к сердечному тропонину Т, визуализация диаминобензидином. СМ ×100
Положительная ИГХ-реакция с антителами к миоглобину визуализирована в виде мелкозернистых гранул темно-коричневого цвета в цитоплазме кардиомиоцитов. У детей 1-й группы экспрессия биомаркера определялась в 30% кардиомиоцитов правого желудочка и таком же проценте клеток межжелудочковой перегородки. При этом ИЭ миоглобина в миокарде топографически разных областей сердца составил 0,5 усл.ед. У новорожденных 2-й группы положительная иммуногистохимическая реакция выявлена в среднем в 50% кардиомиоцитов правого и 33,3% клеток левого желудочков, а также в 20% клеток межжелудочковой перегородки, а ИЭ миоглобина соответственно составил 0,4; 0,4 и 0,3 усл.ед. Подобная динамика иммуногистохимической экспрессии биомаркера свидетельствует о низкой сократительной способности миокарда глубоконедоношенных детей, перенесших внутриутробную гипоксию.
Исследование миокарда глубоконедоношенных детей на клеточном уровне позволило детализировать ультраструктуру миоцитов для объективизации дифференциальной диагностики незавершенной дифференцировки клеток и нарушений, обусловленных гипоксией. У новорожденных с ЭНМТ, внутриутробно развивавшихся в условиях гипоксии, саркоплазма миоцитов обеднена клеточными органеллами, включая перинуклеарную область. Миофибриллы, обеспечивающие сократительную функцию кардиомиоцитов, истончены, фрагментированы и отличаются беспорядочным расположением в пучках, сосредоточенных в основном под клеточной мембраной (рис. 3).
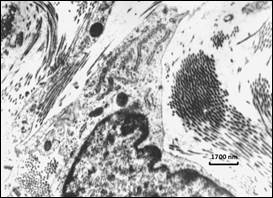
Рис. 3. Миокард новорожденного 27 недель гестации. Расположение тонких миофибриллярных структур под сарколеммой. Единичные фаго- и лизосомы. Инвагинаты нуклеолеммы. ТЭМ. Контрастирование уранилацетатом и цитратом свинца
В миокарде новорожденных с ОНМТ определяется упорядоченное расположение пучков миофибрилл с преимущественно перинуклеарной локализацией. В саркоплазме – малочисленные митохондрии с нарушенной архитектоникой крист и вакуолизацией матрикса. Ядерный гетерохроматин образует фрагментарные скопления в основном под нуклеолеммой либо в центральной части нуклеоплазмы, что свидетельствует о слабой функциональной активности ядер кардиомиоцитов. Кроме того, в последних выявлены участки фокального плазмолизиса (рис. 4). Полученные данные согласуются с результатами опубликованных ранее научных исследований, в том числе экспериментальных [16].
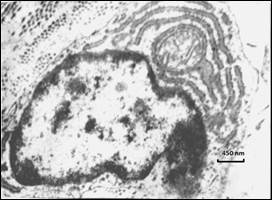
Рис. 4. Миокард новорожденных с ОНМТ. Гранулярный эндоплазматический ретикулум и мембранные рибосомы в перинуклеарной плазмолемме кардиомиоцита. ТЭМ. Контрастирование уранилацетатом и цитратом свинца
Заключение. Таким образом, при комплексном морфологическом исследовании образцов сердца глубоконедоношенных новорожденных, развивавшихся в условиях хронической гипоксии, было показано, что основные изменения на разных уровнях структурной организации преимущественно обнаруживаются в правом желудочке. К таковым относятся дисциркулятрные (спастически-паретические изменения сосудов микроциркуляторного русла, диапедезные паравазальные кровоизлияния, интерстициальный отек) и деструктивные (фрагментация и дезориентация кардиомиоцитов, деструкция митохондрий, внутриклеточный цитолиз) изменения, а также слабая экспрессия основных маркеров сократительной функции миокарда – сердечного тропонина Т и миоглобина – у глубоконедоношенных новорожденных, особенно родившихся в гестационные сроки 22–27 недель. Выявленные структурные особенности являются обоснованием нарушения сократительной способности миокарда у данной категории новорожденных.



