*Работа выполнена с использованием оборудования ЦКП «Протеомный анализ», поддержанного финансированием Минобрнауки России (соглашение № 075-15-2021-691).
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Одним из наиболее серьезных осложнений при использовании химиотерапии является развитие периферических полинейропатий, которые возникают в 85–98% случаев при применении таких наиболее часто используемых препаратов, как паклитаксел и оксалиплатин [1–3]. Симптомы нейропатической боли варьируют от пациента к пациенту, и их проявление зависит от возраста пациента, наличия других заболеваний, таких как астма / хронические обструктивные болезни легких, диабет, гипертония, ожирение [4–7]. Химио-индуцированные периферические нейропатии (ХИПН) могут проявляться как острая боль непосредственно при введении препарата или сразу после введения, но могут и переходить в хроническую форму, продолжаясь в течение нескольких месяцев или лет после прекращения химиотерапии [8–10]. Методы медикаментозного купирования ХИПН практически отсутствуют, и в тяжелых случаях приходится прибегать к модификации доз, отсрочке очередных циклов терапии и даже прекращению лечения.
Патофизиологические механизмы ХИПН недостаточно изучены. В спинном мозге и дорсальных ганглиях обнаружены нарушения миелинизации и повреждение аксонов чувствительных нейронов, изменение активности потенциал-зависимых кальциевых и натриевых каналов, нарушения гомеостаза кальция, дисфункция митохондрий, окислительный стресс, активация апоптоза нейронов, проявления стерильного нейровоспаления (см. детальнее – обзоры Quintão et al., 2019, Fumagalli et al., 2021 [11, 12]). Последовательность и соотношение тех или иных процессов при развитии ХИПН остаются неясными, причем возможно, что различные препараты, использующиеся в химиотерапии, могут вызывать ХИПН по разным патофизиологическим механизмам [13].
Нейровоспаление играет важную роль в развитии ХИПН, медиаторами нейровоспаления являются провоспалительные цитокины и хемокины, которые могут стать индукторами многих последующих патологических процессов в периферической нервной системе [14, 15]. В дорсальных ганглиях спинного мозга основными источниками провоспалительных цитокинов являются инфильтрирующие ганглии активированные макрофаги [16] и, в меньшей степени, клетки сателлитной глии [12].
С целью выяснить вклад провоспалительных цитокинов в поддержание ХИПН в представленной работе мы изучали экспрессию матричных РНК (мРНК) фактора некроза опухолей -α (TNF-α,) и интерлейкина 6 (IL-6) в люмбарных дорсальных ганглиях (ЛДГ) спинного мозга мышей линии C57BL/6j при полинейропатии, вызванной введением паклитаксела.
Материалы и методы исследования
Животные
Эксперименты проводили на мышах линии C57BL/6j, самцах, в возрасте 6–7 месяцев, весом 27–30 г, полученных из Вивария конвенциональных животных ФИЦ ИЦиГ СО РАН. Животных содержали в семейных группах при световом режиме 12 часов день / 12 часов ночь, 22±1°C, при свободном доступе к пище и воде. Тестирование проводили в светлое время (с 9 часов до 15 часов). Перед началом эксперимента мыши проходили десятидневный период адаптации к условиям лабораторного вивария. После первого тестирования животных делили на две группы. Мыши каждой из семейных групп присутствовали как в опытной (n =20), так и в контрольной (n=10) группе.
Все работы с животными проводились в строгом соответствии с законодательством Российской Федерации, положениями Директивы 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 года по охране животных, используемых в научных целях, и протоколом эксперимента, утвержденным Комитетом по биомедицинской этике ФИЦ ФТМ.
Препараты
Нейропатическую боль индуцировали введением раствора паклитаксела для инфузий (EBEWE Pharma Ges.m.b.H. Nfg.KG, Австрия). Препарат хранили при –20°C не более 14 дней. Непосредственно перед введением животным паклитаксел разбавляли стерильным физиологическим раствором (0,9% NaCl, Baxter, S.L., Испания) до конечной концентрации 2 мг/мл. Паклитаксел вводили внутрибрюшинно (в/б) в дозировке 2 мг/кг. Инъекции делали через день четырежды, то есть кумулятивная доза составляла 8 мг/кг на мышь. Животным контрольной группы вводили стерильный физиологический раствор, следуя аналогичной схеме. Все инъекции проводили утром с 9 до 13 часов, после чего животных немедленно возвращали в домашние клетки.
Поведенческие исследования
Формирование периферической полинейропатии у мышей оценивали по тестам механической и холодовой аллодинии и спонтанной локомоторной активности, которые проводили до начала введения паклитаксела (исходное состояние) и через 7 и 24 дня после последней инъекции. Перед тестированием каждого животного аппараты тщательно очищали 3%-ной перекисью водорода для минимизации обонятельных сигналов. В день тестирования мышей оставляли в домашних клетках в экспериментальной комнате в течение 2 ч перед началом поведенческих исследований.
Оценка механической аллодинии
Механическую гиперчувствительность оценивали с помощью нейлоновых нитей Фрея в соответствии с методом, описанным в работе [17]. Мышь помещали на приподнятую решетчатую платформу в прозрачный пластиковый цилиндр (диаметром и высотой 15 см), позволяя животному адаптироваться в течение 15 мин. Монофиламенты (0,2 г, 1,5 г и 3,0 г) прикладывали к средней части подошвенной поверхности задней лапы в порядке возрастания силы. Каждую нить удерживали на месте в течение 5 секунд, после чего регистрировали количество отдергиваний лапы (ответ). Тестирование проводили на каждой задней лапе 5 раз, с интервалом 30 секунд. Подсчитывали и объединяли количество ответов на монофиламенты с обеих лап.
Оценка холодовой аллодинии
Холодовую гиперчувствительность оценивали с использованием ацетонового теста, как описано ранее [18].При тестировании использовали ту же установку, что и для оценки механической аллодинии.Каплю ацетона (50мкл) наносили на подошвенную поверхность задней лапы с помощью автоматического дозатора. Ответы регистрировали в течение 20 секунд после применения ацетона, оценивая их в баллах следующим образом: 0 – отсутствие ответа; 1 – однократное отведение (поднятие, щелчок лапой); 2 – многократное или длительное отведение; 3 – отведение лапы и лизание подошвенной поверхности.Баллы 6 измерений для каждой мыши суммировали для вычисления среднего значения по группе животных.
Оценка спонтанной локомоторной активности
Для оценки спонтанной локомоторной активности использовали стандартную установку для проведения теста открытого поля (open-field test) у мышей, представляющую собой квадратную арену размером 80 х 80 см с высотой стенок 20 см. Яркость освещения арены составляла 500 люкс. Поведение мыши в течение 5 мин регистрировали видеокамерой, расположенной над установкой. При анализе видеозаписей регистрировали количество пересеченных квадратов, считая квадрат пересеченным, если там находились две передние лапы животного.
Количественная полимеразная цепная реакция реального времени
На 7-й и 24-й дни после проведения поведенческих тестов мышей умерщвляли методом цервикальной дислокации, идентифицировали и выделяли люмбарные дорсальные ганглии. Образцы замораживали в жидком азоте и в дальнейшем хранили при –70°C. В каждый из указанных дней использовали 5 животных из контрольной и 10 – из опытной группы.
Выделение РНК
К ганглию добавляли 100 мкл лизирующего буфера (LBB – Биолинк, Россия) и перемешивали, затем к каждой пробе приливали 2 мкл раствора протеиназы К и инкубировали в термошейкере при температуре 56оС в течение 30 мин. После инкубирования к пробе приливали 280 мкл раствора для сорбции («Биолинк», Россия) и тщательно перемешивали на вортексе, затем наносили на колонку и центрифугировали 1 мин при 13000 об/мин. Фильтрат удаляли. Полученные нуклеиновые кислоты трижды промывали на колонке, добавляя по 500 мкл раствора для промывки и центрифугируя 1 мин при 13000 об/мин, после каждого цикла промывки фильтрат удаляли. После последней промывки для удаления остатков жидкости колонку центрифугировали еще один раз. Микроколонку извлекали и помещали в новый эппендорф, элюцию проводили при 100 мкл деионизированной, депротеинизированной воды при комнатной температуре в течение 3 мин, после чего колонку центрифугировали 1 мин при 13000 об/мин. Полученный раствор нуклеиновых кислот собирали и использовали для постановки реакции обратной транскрипции.
Реакция обратной транскрипции
Для проведения реакции обратной транскрипции использовали комплект реагентов РЕВЕРТА-L («Амплисенс», Россия) согласно инструкции производителя. Реакцию обратной проводили на приборе QuantStudio5 (AppliedBiosystems, USA) при температуре 45оС в течение 30 минут.
Полимеразная цепная реакция реального времени (Real-time PCR)
Исследование проводилось методом Real-time PCR в амплификаторе CFX-96 (BIO-RAD, USA). Реакционная смесь в объеме 15 мкл содержала по 0,3 микромоля специфических праймеров (табл. 1), ПЦР буфер (16 мМ трис-HCl, pH8,9, 2,4 vV MgCl2, 65mM (NH4)2SO4), 0,2 mM dNTP, 1xSYBRE green, 1 ед Taq-полимеразы, 5 нг кДНК. Условия проведения ПЦР – денатурация 3 мин 95°C, далее 10 циклов в режиме 10 с – 95°C, 10 с – 66°C, 10 с – 72°C, затем 40 циклов в режиме 10 с – 95°C, 20 с – 66°C, 20 с – 72°C. Съем флуоресценции проводился каждый цикл на следующих температурах:
77°C для IL-6;
83°C для TNFa;
87°C для β-actin.
Затем для оценки специфичности реакции проводили съем кривой плавления с 50°C при инкременте температуры 0,5°C и съем флуоресценции на каждом шаге. Полученные данные интерпретировали исходя из анализа графиков накопления флюоресценции, специфичность оценивали с помощью кривой плавления
Таблица 1
Последовательности праймеров
|
IL-6 |
5′-CGGAGAGGAGACTTCACAGAG-3′ |
|
|
5′-CATTTCCACGATTTCCCAGA-3′ |
|
TNF-a |
5′-TATGGCTCAGGGTCCAACTC-3′ |
|
|
5′-GGAAAGCCCATTTGAGTCCT-3′ |
|
β –actin |
5′-ATGGTCACGCACGATTTCCC-3′ |
|
|
5′-GAGACCTTCAACACCCCAGC-3′ |
Примечание: праймеры были синтезированы ООО «СибЭнзайм» г. Новосибирск, РФ.
Статистическая обработка результатов
Статистическая обработка результатов проводилась с использованием программного обеспечения OriginPro (OriginLab Corp, USA). Различия между группами были проанализированы с помощью непараметрического дисперсионного анализа Крускала–Уоллиса. Для определения достоверности различий в группах определяли критический уровень значимости p, при этом нулевая гипотеза (H0) отклонялась при p<0,05. Результаты представлены как среднее значение и стандартная ошибка среднего (M±SEM).
Результаты исследования и их обсуждение
Общее состояние животных
Масса тела животных составляла 27–30 г в начале эксперимента, практически не изменяясь в ходе эксперимента. Все мыши дожили до конца исследования, одна мышь была исключена из группы контроля из-за повышенной агрессивности. У остальных животных общий вид и поведение были нормальными. Не было выявлено симптомов мышечной слабости конечностей, то есть отсутствовало влияние паклитаксела на функцию моторных волокон. Таким образом, не было отмечено серьезной токсичности в опытной группе мышей, доза паклитаксела и схема введения, используемые в нашей работе, практически не влияли на общее состояние животных.
Развитие паклитаксел-индуцированной полинейропатии у животных
С целью подтверждения наличия нейропатического болевого синдрома проводили количественную оценку механической и холодовой аллодинии и спонтанной локомоторной активности.
У контрольной группы животных, получавших инъекции физиологического раствора, механическая чувствительность практически не изменялась (рис. 1, 2). Не было обнаружено достоверных различий между количеством ответов до начала инъекций и на 7-й и 24-й дни как при использовании монофиламента 0,2 г, так и при стимуляции монофиламентом 1,5 г.
Паклитаксел вызывал у мышей выраженную механическую аллодинию (рис. 1), на 7-й день было обнаружено снижение порога чувствительности к механическому воздействию монофиламента 0,2 г у опытной группы по сравнению с контролем на 80%. На 24-й день наблюдалась тенденция к повышению порога чувствительности у опытной группы животных, однако достоверных различий между показателями на 7-й и 24-й дни не было, отличие же от контрольной группы сохранялось.
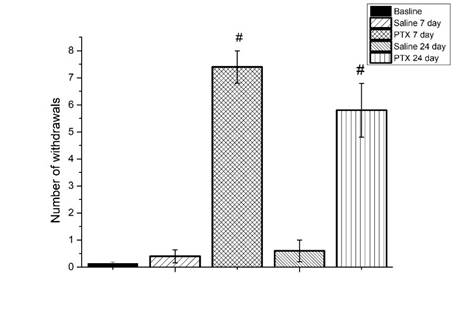
Рис. 1. Паклитаксел вызывает механическую аллодинию у мышей C57BL/6j (тестирование с использованием монофиламента 0,2 г).
Ось ординат – количество ответов (отдергиваний лапы)
Результаты представлены в виде среднего значения и стандартной ошибки среднего (mean ±SEM). Показаны статистически значимые сравнения групп, получавших дозу паклитаксела (PTX), с контрольной группой, получавшей физиологический раствор (Saline), на 7-й и 24-й день, # – p <0,01)
При использовании монофиламента 1,5 г на 7-й день у животных опытной группы было обнаружено снижение порога механической чувствительности на 60% по сравнению с контрольной группой (рис. 2). Различия между животными, которым вводили паклитаксел, и животными, получавшими физиологический раствор, были достоверны (7-й день, р<0,05; 24-й день, р<0,05).
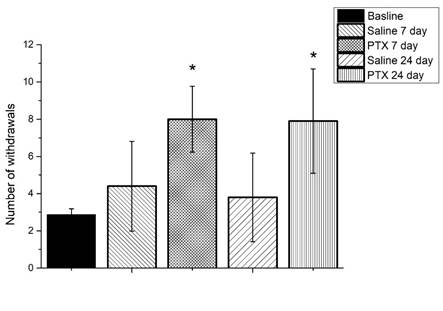
Рис. 2. Паклитаксел вызывает механическую аллодинию у мышей C57BL/6j (тестирование с использованием монофиламента 1,5 г)
Ось ординат – количество ответов (отдергиваний лапы)
Результаты представлены в виде среднего значения и стандартной ошибки среднего (mean ±SEM). Показаны статистически значимые сравнения групп, получавших дозу паклитаксела (PTX), с контрольной группой, получавшей физиологический раствор (Saline), на 7-й и 24-й день (* – р<0,05)
При оценке действия паклитаксела на механическую чувствительность с использованием монофиламента 3,0 г ни на 7-й, ни на 24-й день не было выявлено статистически достоверных различий между опытной и контрольной группами. При исходном тестировании, как и при дальнейших тестированиях, животные отдергивали задние лапы практически при каждом приложении нити Фрея. Очевидно, что воздействие монофиламентом 3,0 г оказалось избыточно сильным для мышей C57BL/6j.
Тяжесть механической аллодинии, вызываемой паклитакселом, оказалась примерно такой же, как и при других моделях болезненной периферической невропатии [19, 20]. Необходимо отметить, что при тестировании не обнаружено различий в реакции на нити Фрея правой и левой лап животного, то есть паклитаксел индуцировал симметричную невропатию.
Достоверное снижение локомоторной активности в опытной группе животных наблюдается лишь на 24-й день после окончания введения паклитаксела (рис. 3).
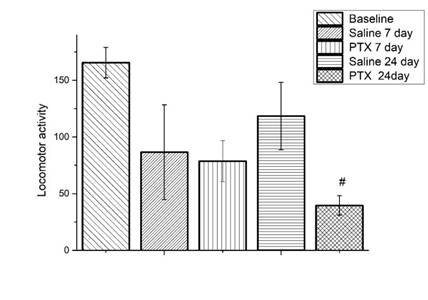
Рис. 3. Локомоторная активность мышей C57BL/6j на 7-й и 24-й дни после введения паклитаксела.
Результаты представлены в виде среднего значения и стандартной ошибки среднего (mean ± SEM). Показаны статистически значимые сравнения групп, получавших дозу паклитаксела (PTX), с контрольной группой, получавшей физиологический раствор (Saline), на 24-й день после последней инъекции PTX (# – р<0,01)
При тестировании холодовой аллодинии у мышей нам не удалось выявить статистически значимых различий между группой животных, получавших инъекции паклитаксела, и контрольной группой, которой вводили физиологический раствор (рис. 4).
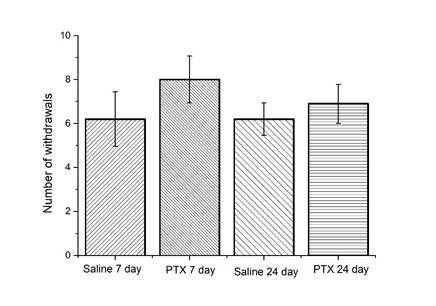
Рис. 4. Отсутствие изменений холодовой чувствительности у мышей C57BL/6j на 7-й и 24-й дни после введения паклитаксела.
Ось ординат – количество ответов (отдергиваний лапы). Результаты представлены в виде среднего значения и стандартной ошибки среднего (mean ± SEM). Отсутствуют статистически значимые сравнения групп, получавших дозу паклитаксела (PTX), с контрольной группой, получавшей физиологический раствор (Saline), на 7-й и 24-й день после последней инъекции PTX
Оценка экспрессии цитокинов в модели периферической нейропатии, индуцированной паклитакселом
Отсутствуют существенные изменения в экспрессии цитокинов (TNF-α, IL-6) в DRGs (p>0,05) у животных группы Паклитаксел (кумулятивная доза 8 мг/кг) по сравнению с контрольной группой мышей C57Bl/6j на 7-й день и 24-й день (данные не показаны) после последнего введения (рис. 5).
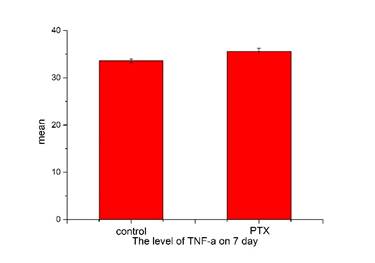
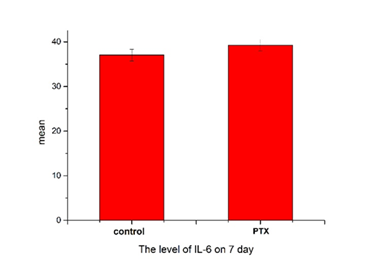
Рис. 5. Экспрессия цитокинов (TNF-α, IL-6) в модели периферической нейропатии, индуцированной PTX
Результаты представлены в виде M ± SEM. Сравнения групп, получавших кумулятивную дозу 8 мг/кг паклитаксела (PTX), с контрольной группой, получавшей физиологический раствор (control), на 7-й день после последнего введения (критерий Крускала–Уоллиса, р>0,05)
Развитие химио-индуцированных полинейропатий, механизмы которых в настоящее время до конца не ясны, создает серьезные трудности при лечении пациентов с онкологическим заболеваниями. Несмотря на большое количество экспериментальных работ, посвященных изучению механизмов ХИПН, в частности роли стерильного нейровоспаления при применении таксанов, приведенные в них данные часто противоречивы. Эти противоречия могут быть связаны с использованием разных экспериментальных животных (крысы или мыши, преимущественно молодого возраста), различными схемами введения, разовыми и кумулятивными дозами, сроками забора образцов для анализа и, наконец, применяемыми методами анализа. Все это делает сложным сопоставление полученных разными исследователями результатов.
Использованная нами схема введения и относительно низкие разовые и кумулятивная дозы паклитаксела позволили получить модель ХИПН на мышах C57BL/6j без выраженного влияния на общее состояние животных. Не было обнаружено влияния на функцию моторных волокон, так как отсутствовали симптомы слабости конечностей, а появлявшийся только на 24-й день дефицит локомоторной активности, скорее всего, связан именно с развитием механической аллодинии. По всей видимости, у животных индуцированные паклитакселем периферические полинейропатии являются обратимыми. Как отмечено в работе [21], длительность механической аллодинии у крыс, получавших кумулятивную дозу паклитаксела 4 мг/кг, не превышает 6, а при кумулятивной дозе 8 мг/кг – 16 недель. Инфильтрация ЛДГ макрофагами, активированными по М1-типу, выявлена уже на 3-й день после первой инъекции паклитаксела, далее она нарастает к 7-му и 14-му дням, несколько снижаясь к 21-му дню [16]. Хотя измерения содержания провоспалительных цитокинов и их мРНК после единичной инъекции паклитаксела не проводились, можно предположить, что продукция цитокинов TNF-α и IL-6 начинает расти в ганглиях именно с этого времени. Тем не менее, в экспериментах Маккер и соавторов [22] не обнаружено изменений содержания TNF-α и IL-6 в ЛДГ мышей C57BL/6 j непосредственно сразу после проведения цикла инъекций паклитаксела (5 мг/кг х 4). В работе [23], выполненной на крысах Вистар (паклитаксел 2 мг/кг х 5), в ЛДГ показано увеличение содержания как мРНК, так и собственно TNF-α непосредственно после окончания курса введения паклитаксела. К 11-му дню оба этих показателя не отличаются от контрольных, то есть наши данные об отсутствии повышенного содержания мРНК TNF-α на 7-й день после окончания курса паклитаксела достаточно хорошо согласуются с данными, полученными в указанной работе. Н. Калиновска и соавторы не обнаружили изменений в содержании IL-6 и мРНК этого цитокина сразу по окончании курса инъекций, а к 11-му дню выявили повышение уровня IL-6, но содержание мРНК оставалось без изменений [23]. Это также согласуется с нашими данными. Таким образом, можно предположить, что провоспалительные цитокины TNF-α и IL-6 играют важную роль в индукции, вызванной введением паклитаксела ХИПН, но не в ее поддержании, и повлиять на действие провоспалительных цитокинов можно в случае воздействия до начала введения паклитаксела или одновременно с проведением курса. Например, введение антител к IL-6 до начала инъекций паклитаксела предотвращало развитие ХИПН у мышей C57BL/6 [24]. Ингибитор рецептора ангиотензина II, лозартан, при введении одновременно с паклитакселом или сразу по окончании курса снимал проявления нейропатической боли, снижая уровень провоспалительных цитокинов в ЛДГ у крыс [25]. В случае одновременной с паклитакселом внутривенной инфузии иммуноглобулина человека крысам также наблюдали облегчение симптоматики периферической нейротоксичности [26].



