Опухолевые заболевания являются одной из самых частых причин смертности в мире, из-за них только в 2020 г. умерли более 8 млн больных, что соответствует населению мегаполиса [1]. Ученые, представители агентства по надзору за статистикой, установили, что эта патология с учетом современных методов диагностики будет выявлена у каждого 5-го жителя планеты. К сожалению, прогнозируется и высокая смертность от данной патологии.
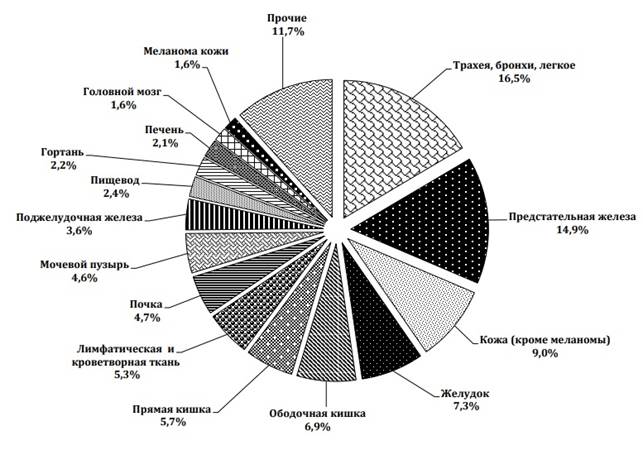
Рис. 1. Структура заболеваемости злокачественными новообразованиями населения России в 2020 г.
Статистика в России также неутешительна. В 2020 г. выявлено более 500 тыс. случаев опухолевых новообразований. При анализе статистики заболеваемости по половому признаку установлено, что количество больных женщин на 10% больше, чем мужчин. К концу 2020 г. в территориальных онкологических учреждениях состояли на учете почти 4 млн больных. Общий коэффициент заболеваемости населения составляет 2712,9 на 100 000 населения. «Грубый» показатель заболеваемости на 100 тыс. жителей России составил 379,7 (доверительный интервал 378,7–380,6) при росте за десятилетний период около 20,5%. Онкологические заболевания занимают 2-е место среди всех причин смертности населения России; в 2017 г. от злокачественных новообразований умерли 290,7 тыс. больных, что составляет 15,9% от общего числа больных с установленным диагнозом. В 2017 г. совокупный риск, т.е. риск развития тяжелых заболеваний гистологического характера, перенесших (больных) при жизни до 75 лет, при вероятности возникновения всех причин смерти составил 26,5% [2].
К сожалению, многие противораковые препараты наносят ущерб здоровью клеток организма, этот ущерб может быть представлен выпадением волос, зудом и шелушением кожи, временной тошнотой и рвотой, а может быть и необратимым, например бесплодие, токсические кардиомиопатии и др. [3, 4, 5].
Вышеперечисленные проблемы актуальны для огромного числа пациентов, и их решение является сложной медицинской задачей. Необходимо будет создать препарат, который не только эффективно борется с опухолевыми клетками, но и не повреждает здоровые ткани организма. Это позволит бороться с данным недугом, не ухудшая качество жизни пациентов [6].
Цель исследования: оценить фармакологическую эффективность применения субстанции (фумарат 3-ОП) как при монотерапии, так и в комплексе с лучевой терапией на мезенхимальные стволовые клетки и опухолевые клетки.
Материал и методы исследования
Объектом выполняемого фармакологического экспериментального исследования были выбраны стандартные, хорошо культивируемые в лабораторных условиях клеточные культуры – мезенхимальные стволовые клетки (МСК) и клетки линии HeLa (первые клетки человека, которые когда-либо были выращены на искусственной питательной среде, которые дали возможность ученым культивировать сотни других линий опухолевых клеток). Клеточные культуры выращивались согласно стандартной методике – до 60–80% конфлюэнтного слоя. Исследуемое вещество – фумарат 3-оксипиридина. Фумарат 3-ОП представляет собой соль 2-этил-6-метил-3-гидроксипиридина с фумаровой кислотой, которую получили путем взаимодействия этих веществ в среде растворителя при перемешивании реагентов и кипячении с последующей отгонкой растворителя охлаждением осадка и перекристаллизацией выпавшего целевого продукта. Полученная таким способом соль представляет собой белое кристаллическое вещество, растворимое в спирте, плохо растворимое в воде. Фумарат 3-ОП был синтезирован доцентом кафедры органической химии ИАТЭ НИЯУ МИФИ С.В. Шкавровым на основании патента автора А.В. Семенова.
Статистический анализ полученных данных и графическая визуализация результатов выполнены на базе компьютерных программ Microsoft Excel и RStudio на персональном компьютере. Экспериментальное исследование проводилось в трех повторениях. Для статистической обработки полученных данных применялся непараметрический критерий Манна–Уитни, который отражает достоверность различий между контрольными и анализируемыми группами при уровне значимости p<0,05.
Структура эксперимента
В рамках эксперимента использовали стандартные линии клеточных культур – HeLa и МСК.
Разделим каждую линию на несколько подгрупп.
1-я группа – клетки без изучаемого соединения, подвергшиеся только облучению;
2-я группа – клетки только с изучаемым соединением;
3-я группа – комбинированная терапия (соединение + облучение);
4-я группа – контрольная (интактные клетки).
Готовили раствор препарата в подсчитанной концентрации (0,01 мг в 1 мл), которая была выбрана с учетом данных о LD50 фумарата 3-ОП, добавляли в среду к растущим клеточным линиям, и клетки культивировали еще в течение 1 суток.
В намеченный день эксперимента клетки выявляли с помощью культуральных флаконов с помощью трипсина и переносили в эпендорфы (по 2 мл в каждом) в определенной среде с культуральной средой.
Облучение проводили гамма-квантами на установке ГУР-120 (ФГБНУ ВНИИРАЭ) в дозах 1, 2, 4 и 6 Гр (с мощностью дозы 0,9 Гр в минуту).
Облученные клетки высеивали в чашки Петри с концентрацией 10 тыс. клеток на чашку.
Культивация проходила в течение 2 суток. В качестве тестов использовали определение времени удвоения культуры и клоногенную активность.
Производили подсчет клеток в счетной камере Горяева. Полученные результаты сопоставляли с контролем, в качестве которого использовалась культура клеток, облученная без препарата в тех же дозах.
Формула, используемая для подсчета клеток:
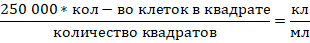
Для подсчета времени удвоения (TD) использовали следующую формулу:
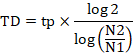
где tp – время культивирования, N1 – начальное количество клеток, N2 – конечное количество клеток.
Клоногенная активность клеток (или выживаемость клеток)
1. Клетки, подвергшиеся облучению, сеяли в стерильные чашки Петри. В каждой чашке находилось от 1000 до 100 000 клеток, количество клеток зависит от дозы.
2. Следующую неделю клетки инкубировали в CO2-инкубаторе. Через 7 дней в чашках появляются колонии, которые видно невооруженным взглядом.
3. Для подсчета колоний необходимо зафиксировать клетки. Для этого среду для культивирования сливали, в чашку Петри добавляли краситель (2%-ный раствор метиленового синего с 50%-ным раствором этанола).
4. Считали колонии ручным методом на ручном счетчике из расчета, что в одной колонии должно содержаться более 50 клеток. Те колонии, которые содержали меньше клеток, в расчет не брали.
Для определения показателя клоногенной активности клеток его переводили в проценты по отношению к клеткам, высеянным в каждой группе (учитывая суммарную дозу ионизирующего излучения). Также учитывали клоногенную активность в контроле (клетки, которые не были подвергнуты облучению).
Результаты исследования и их обсуждение
Начнем с времени удвоения МСК в трех группах.
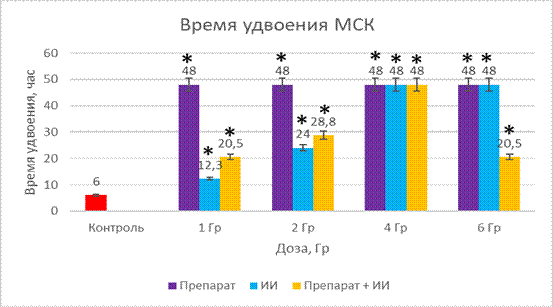
Рис. 2. Время удвоения мезенхимальных стволовых клеток при действии препарата, облучения и комбинированного действий препарата и облучения
* Учет ведем при разнице р<0,05 к контролю
На рисунке 1 изображено, что под действием исследуемого вещества время удвоения составило 48 часов, когда в контрольной группе это же значение составляет 6 часов. Здесь наблюдается значимое увеличение этого показателя в 8 раз.
Результаты действия ионизирующего излучения зависят от его дозы. Время удвоения для 1 Гр – 12 ч (увеличение на 6 часов), 2 Гр – 24 ч, при дозах 4 и 6 Гр значения оказались одинаковыми по этому показателю и составили 48 ч.
3-я группа — это группа, на которую воздействовали комбинацией исследуемого вещества и ионизирующего излучения в разных дозах. Время удвоения увеличивалось в зависимости от дозы облучения: 1 Гр – 20,5 ч, 2 Гр – 28,8 ч, 4 Гр – 48 ч, 6 Гр – 20,5 ч.
Полученные данные свидетельствуют о токсическом действии изучаемого соединения на культуру мезенхимальных стволовых клеток, однако необходимо отметить, что при комбинированном действии облучения во всех дозах и химиопрепарата наблюдается защитное действие.
Отмечено аналогичное действие изучаемого препарата, облучения и их комбинированного действия на опухолевые клетки линии HeLa. При этом время удвоения клеточной линии в контроле составило почти 6 ч.
Время удвоения для опухолевых клеток линии Hela показано на рисунке 2. Результаты разделены также на группы в зависимости от воздействий на клетки.
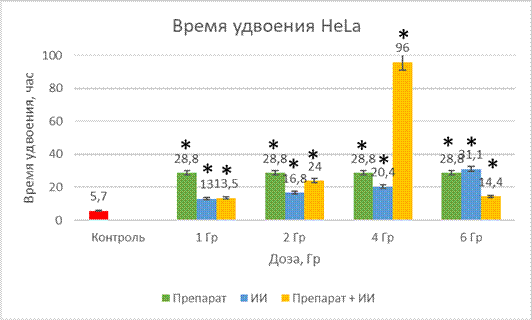
Рис. 3. Время удвоения HeLa при действии препарата, облучения и комбинированного действий препарата и облучения
* Учет ведем при разнице р<0,05 к контролю
При действии на клеточную линию HeLa исследуемого вещества время удвоения составило 28,8 ч. Отмечено существенное увеличение по сравнению с контролем, которое составило 5,7 ч.
Время удвоение при действии ионизирующего излучение возрастало в зависимости от применяемой дозы, для 1 Гр – это 13 часов (увеличение в 2 раза по сравнению с контролем), 2 Гр – 16,8 ч, 4 Гр – 20,4 ч, 6 Гр – 21,1 ч.
Последняя группа — это совместное действие исследуемого вещества и облучения. Увеличение времени удвоения было неравномерным, самое большое увеличение было отмечено при действии облучения в дозе 4 Гр и составило 96 часов, что в 16 раз больше, чем в контрольной группе. В остальных группах также наблюдалось удлинение: 1 Гр – 13,5 ч, 2 Гр – 24 часа, 6 Гр – 14,4.
Из представленных данных видно, что при комбинированном действии препарата и гамма-облучения в дозе 4 Гр наблюдается синергическое действие агентов.
На рисунке 3 показано изменение клоногенной активности в 3 исследуемых группах и группе контроля.
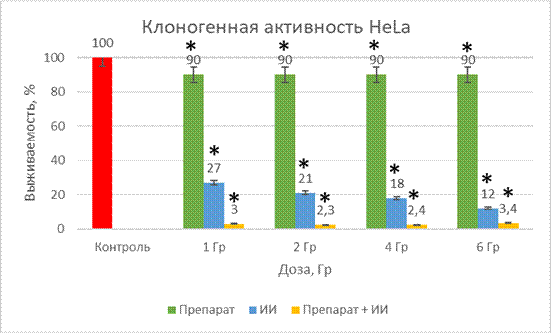
Рис. 4. Клоногенная активность HeLa при действии препарата, облучения и комбинированного действий препарата и облучения
* Учет ведем при разнице р<0,05 к контролю
При изолированном действии исследуемого вещества клоногенная активность опухолевых клеток снизилась минимально и составила 90%.
Действие ионизирующего излучения значительно снизило клоногенную активность клеток, причем, чем больше доза облучения, тем ниже этот показатель: 1 Гр – 27%, 2 Гр – 21%, 4 Гр – 18%, 6 Гр – 12%. В самой большой дозе снижение клоногенной активности произошло в 8 раз.
Последняя группа – это сочетание действия исследуемого вещества и ионизирующего действия. В этой группе мы наблюдаем самое сильное снижение клоногенной активности, оно примерно одинаково при всех дозах облучения и составило: 1 Гр – 3%, 2 Гр – 2,3%, 4 Гр – 2,4%, 6 Гр – 3,4%.
Таким образом, мы видим, что во всех случаях комбинированного воздействия наблюдается резкое снижение клоногенной активности опухолевых клеток, следовательно, рост опухоли замедляется.
Выводы
1. Фармакологическое действие исследуемого соединения фумарата 3-ОП значительно удлиняет время удвоения как МСК, так и опухолевых клеток линии HeLa, при этом незначительно снижает клоногенную активность клеток HeLa.
2. Максимальное увеличение времени удвоения для МСК наблюдалось на фоне ионизирующего излучения в дозах 4 и 6 Гр, а для опухолевых клеток линии HeLa – в дозе 4 Гр. Клоногенная активность HeLa значительно уменьшается при использовании любых доз, но наибольший результат выявлялся при дозе 6 Гр.
3. На фоне комбинированной терапии (фумарат-3-ОП + ионизирующее излучение) наблюдалось наиболее сильное увеличение времени удвоения для мезенхимальных стволовых клеток и опухолевых клеток линии HeLa при дозе 4 Гр. Клоногенная активность клеток значительно уменьшается при комбинированном действии в любых дозах облучения.
4. На основе предоставленных данных о действии фумарата на мезенхимальные стволовые клетки можно предположить цитопротекторное действие соединения.
Таким образом, по результатам проведенного исследования становится понятно, что фумарат 3-ОП обладает противоопухолевой активностью, при этом имеет меньшую цитотоксичность, его можно комбинировать с радиотерапией, в связи с этим дальнейшее изучение данного соединения является перспективным.



