Несмотря на то что по данным Всемирной организации здравоохранения туберкулез (ТБ) представляет угрозу для населения, в Российской Федерации отмечается улучшение эпидемических аспектов в борьбе с туберкулезом. Более того, ВОЗ в 2021 г. исключила нашу страну из списка стран с высокой распространенностью туберкулеза. Многие авторы считают, что это является результатом реализации поставленных национальных программ здравоохранения [1].
Согласно политической стратегии DOTS (лечение под непосредственным контролем коротким курсом) выявлено, что туберкулез остается одной из распространенных и смертоносных болезней в большинстве стран мира [2].
Данные литературы указывают, что лекарственная устойчивость (ЛУ) в мире составляет примерно 6,1% среди вновь выявленных случаев туберкулезной инфекции и около 20,4% среди пациентов, ранее получавших лечение [3]. Особое внимание также уделяется пациентам с туберкулезом с ЛУ и другими инфекциями, такими как ВИЧ и COVID. ВОЗ отмечает, что пандемия COVID-19 влечет тяжелые осложнения для человечества, которые будут расти в период с 2020 по 2025 гг., особенно при лекарственно-устойчивых формах заболевания [4].
Терапевтическая успешность лечения ЛУ, судя по данным современной литературы, равняется примерно 60% [5]. По данным современных исследований выявлено, что в основе эффективности применяемых в практике методов лечения ТБ лежат такие факторы, как устойчивость возбудителя, характер воспалительного процесса, объем поражения легочной ткани, приверженность больного к терапии. Поэтому многие исследователи придают важное значение течению и лечению ЛУ туберкулеза [6].
Новая программа лечения пациентов с устойчивой формой ТБ заключается в применении V режима химиотерапии с назначением наиболее эффективных противомикробных лекарств, таких как диарилхинолины, оксазолидиноны, фторхинолоны и др. Терапевтическая тактика лекарственно-устойчивого туберкулеза носит персональный характер, нередко требуется хирургическое вмешательство. В дополнение к применению современных противотуберкулезных препаратов большую значимость имеет рациональное комбинированное назначение химиопрепаратов [7].
При утяжелении патологии и развитии лекарственно-устойчивых штаммов возбудителя современные тактики лечения должны применяться с учетом роста лекарственной резистентности [8].
Итак, в данное время необходимо решить вопрос усиления воздействия препаратов, обладающих высокими противомикробными эффектами против микобактерии туберкулеза (МБТ) [9].
Цель исследования – усиление терапевтической эффектности лечения пациентов с туберкулезом легких с ЛУ.
Материалы и методы исследования
В клиническое обследование входили 90 пациентов с туберкулезом легких и лекарственной устойчивостью.
Критерии включения: собственное согласие на участие; клиническое подтверждение диагноза «туберкулез легких с ЛУ»; формы патологии – впервые выявленная и рецидивирующая; возраст – 25–65 лет; пол – женский и мужской; легкие сопутствующие патологии.
Критерии исключения: персональный отказ от исследования; туберкулез других органов, кроме легких; возраст моложе 25 и старше 65 лет; тяжелые сопутствующие болезни; ВИЧ-инфекция.
Верификация диагноза осуществлялась с применением молекулярно-генетических и лабораторных методов биологического материала мокроты с целью обнаружения ДНК, микроскопии, посева на плотные (ППС) и жидкие (ЖПС) питательные среды возбудителя.
Участники исследования распределены рандомным способом на 2 группы в зависимости от формы проявления патологии. Данные группы также были разделены на подгруппы в зависимости от базового вида химиотерапии.
Первая (основная, n=47) группа – больные с впервые выявленным ТБ и ЛУ, которая разделена на подгруппу 1 (n=16) – левофлоксацин (Lvf) + линезолид (Lzd), подгруппу 2 (n=17) – моксифлоксацин (Mfn) + Lzd + бедаквилин (Bq), подгруппу 3 (n=14) – Lzd + Bq.
Вторая (клинического сравнения, n=43) группа – с рецидивирующим ТБ и ЛУ, в которую входили подгруппа 4 (n=14) – левофлоксацин (Lvf) + линезолид (Lzd), подгруппа 5 (n=13) – моксифлоксацин (Mfn) + Lzd + бедаквилин (Bq), подгруппа 6 (n=16) – Lzd + Bq.
Гендерно-возрастной анализ показал, что средний возраст больных составил 45,2±2,87 года (в первой группе – 42,5±2,98 года, во второй – 48,3±2,71 года). При распределении изучаемых пациентов по полу выявлено, что мужчин было 50 (55,6%), а женщин – 40 (44,4%). В первой группе представители мужского пола составили 27 (57,4%), а женского – 20 (42,6%). Во второй группе этот показатель равнялся 25 (58,1%) и 18 (41,9%) соответственно.
При изучении анамнеза выявлено, что у пациентов группы наблюдения обнаружены сопутствующие заболевания, в том числе сердечно-сосудистые (у 22 (24,0%)), желудочно-кишечные (у 15 (16,7%)), эндокринные (13 (14,4%)), респираторные (17 (18,9%)), инфекционные (у 11 (12,2%)).
Обследование пациентов проводили клиническим методом: сбор анамнеза – жалобы, давность патологии, контакт с больными туберкулезом; бактериологическими методами: люминесцентная микроскопия (исследование мокроты на возбудителя туберкулеза) и ПЦР (молекулярно-генетическая идентификация МБТ), посевы ППС и ЖПС, анализ крови (лейкоциты, лимфоциты, гемоглобин и др.); инструментальными методами: рентгенографическое исследование и КТ органов грудной клетки, ЭКГ и др.
Для сравнения исследуемых параметров с референсным уровнем обследованы люди без признаков заболевания (n=10).
Период исследования – 3, 6 и 12 месяцев стационарного лечения.
Статистическая обработка полученного материала проведена с применением пакета прикладных программ Statistica 13.1. и программы IBM SPSS statistics 25, критерия χ2 Пирсона и Фишера.
Результаты исследования и их обсуждение
При клиническом обследовании выявлено, что у пациентов зарегистрированы интоксикационный и бронхопульмональный синдромы (рис. 1).
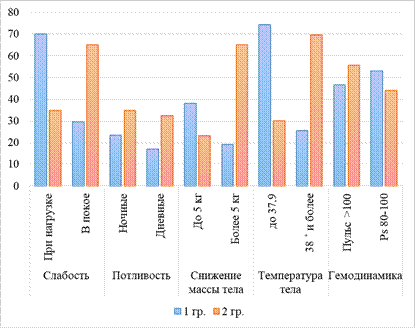
Рис. 1. Показатели синдрома интоксикации
По данным клинического обследования обнаружено, что умеренные признаки интоксикации (фебрильная температура, умеренная слабость, легкое потоотделение, умеренная неустойчивость) регистрировались среди пациентов с впервые возникшими формами (основная группа). У данных пациентов выраженность синдрома интоксикации соответствовала первой степени. У пациентов с рецидивными формами ТБ проявление интоксикации (температура 38˚С и более, снижение массы тела на 5 кг и более) соответствовало второй и третьей степеням тяжести (вторая группа) (рис. 1).
При изучении параметров бронхопульмонального синдрома продемонстрировано, что легкая респираторная депрессия (I степень) c такими признаками, как редкий кашель, мокрота 50–100 мл/сут, дыхательная недостаточность I степени, диагностирована у больных первой группы. Более тяжелые степени (II и III) бронхопульмонального синдрома, симптомы которых – выраженный кашель, мокрота >100 мл/сут, дыхательная недостаточность II и III степени, зарегистрированы у пациентов второй группы (рис. 2).
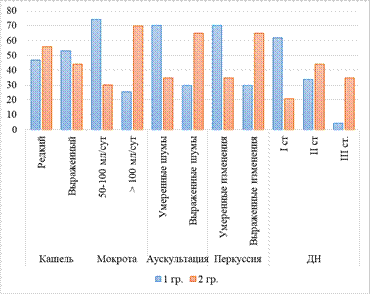
Рис. 2. Показатели бронхопульмонального синдрома
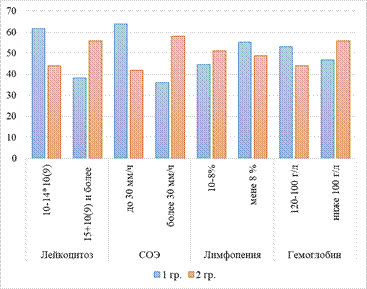
Рис. 3. Показатели общего анализа крови
Результаты исследования анализа крови показали, что у исследуемых больных с впервые выявленным ТБ отмечены лейкоцитоз (до 15х109) у, легкий палочкоядерный сдвиг – у 38 (38,0%), 8%-ная лимфопения – у 15 (15,0%) и повышение СОЭ (до 30 мм/ч). С-реактивный белок, АЛТ и АСТ превышали норму на 15,6, 21,1, 18,5 и 16,3% соответственно (р<0,05) (рис. 3).
У пациентов группы сравнения лабораторные сдвиги превышали аналогичные показатели пациентов первой группы в значительной степени. В данной группе уровень лейкоцитоза превышал 15х109, палочкоядерный сдвиг – тяжелый, 10%-ная лимфопения, рост СОЭ выше 30 мм/ч, увеличение С-реактивного белка, АЛТ и АСТ – на 26,4, 32,7 и 25,9% соответственно (р<0,05).
Результаты лучевой диагностики выявили, что среди клинических форм ТБ в основной группе чаще регистрировался инфильтративный (у 31 (66,0%)) и кавернозный (у 16 (34,0%)) туберкулез. В группе сравнения формы патологического процесса диагностированы в инфильтративной, фиброзно-кавернозной и диссеминированной формах – у 7 (16,2%), 26 (60,4%) и 10 (23,2%) человек соответственно.
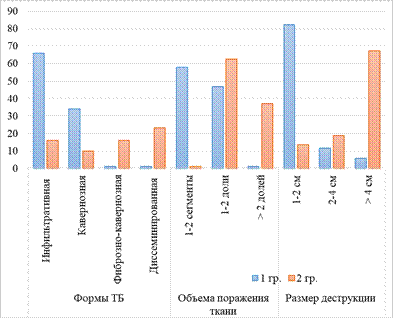
Рис. 4. Формы и объемы поражения легких при ТБ
Особый интерес уделяется сравнительным данным объема поражения ткани легких. По данным рентгенологического исследования выявлено, что у 25 (58,1%) больных основной группы патологические проявления обнаружены в 1–2-м сегментах, а у 22 (46,8%) поражены не более 2 долей легкого (р<0,05). В группе клинического сравнения зарегистрированы обширные поражения (более 2 долей легкого) среди 27 (62,7%) пациентов и ограниченные (в пределах одного сегмента) – у 16 (37,2%) пациентов (рис. 4).
Количество и размеры полостей распада у пациентов группы исследования различались. У 34 (72,3%) пациентов первой группы выявлены полостные образования, в том числе единичные выявлены у 22 (64,7%), а множественные – у 12 (35,2%). Во второй группе полости распада диагностированы у 37 (86,0%) человек, при этом единичные полости распада – у 28 (75,6%), а множественные – у 9 (24,3%) больных.
По размеру различали полости 1–2 см, 2–4 см и >4 см. В основной группе они составили 28 (82,3%), 4 (11,7%) и 2 (5,8%), в группе сравнения – 5 (13,5%), 7 (18,9%) и 25 (67,5%) соответственно.
По патогенетическим различиям полостные образования регистрировались в начинающей, пневмониогенной, ригидной, эластичной, фибрознозной формах. В первой группе обнаружены первые 4 вида, они соответственно отмечены у 8 (23,5%), 20 (58,8%), 4 (11,7%) и 2 (5,8%) больных. Во второй группе встречались пневмониогенный (у 3 (8,1%)), ригидный (5 (13,5%)), эластичный (7 (18,9%)), фибрознозный (22 (59,4%)) виды.
Анализ микробиологических особенностей течения туберкулеза с лекарственной устойчивостью (ТБ-ЛУ) показал, что результаты микроскопии и посева выявили скудное бактериовыделение у 36 (76,5%), р<0,05) и 33 (70,2%, р<0,05) пациентов первой группы соответственно. Во второй группе отмечено массивное бактериовыделение – у 31 больного (72,0%, р<0,05) по микроскопии и у 34 (79,0%, р<0,05) по посеву.
Спектр лекарственной устойчивости возбудителя у больных ТБ-ЛУ широкий. Спектры ЛУ+1 включили комбинацию HRAmKFq и HRAmCmFq, ЛУ+2 – HRAmEKFq + HRAmECmFq + HRAmKCmFq + HRAmKPtFq, ЛУ+3 – HRAmKEFqPAS + HRAmKFqPASCs + HRAmKPtCmFq + HRAmKPtPASFq, ЛУ+4 – HREKCmPtFq + HREKCsFqPASLzd + HRAmKECmFqPAS + HRKPtCmFqPAS, ЛУ+5 – HREKPtCmFqPASCs + HRKPtCmFqCsPAS. Итак, в первой группе ЛУ+1 диагностирована у 20 (42,5%), ЛУ+2 – у 12 (25,5%), ЛУ+3 – у 10 (21,2%), ЛУ+4 – у 4 (8,5%), а ЛУ+5 – у 1 (2,1%) больного. В группе сравнении показатели составили соответственно 8 (18,6%), 10 (23,2%), 13 (30,2%), 7 (16,2%) и 4 (9,3%) (рис. 5).
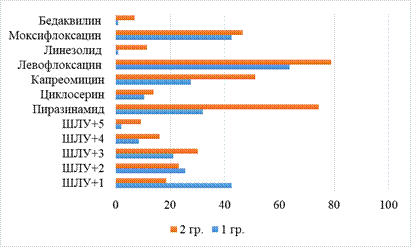
Рис. 5. Спектр лекарственной устойчивости возбудителя
Лекарственная устойчивость к химиопрепаратам у пациентов группы исследования регистрирована в разнообразных формах. В основной группе установлена устойчивость к левофлоксацину (30 (63,8%)), моксифлоксацину (у 20 (42,5%)), пиразинамиду (у 15 (31,9%)), капреомицину (у 13 (27,6%)), циклосерину (у 5 (10,6%)).
У пациентов второй группы лекарственная устойчивость регистрировалась к левофлоксацину (у 34 (79,0%)), пиразинамиду (у 32 (74,4%)), капреомицину (у 22 (51,1%)), моксифлоксацину (у 20 (46,5%)), циклосерину (у 6 (13,9%)), и линезолиду (у 5 (11,6%)) и бедаквилину (у 3 (6,9%)).
При изучении терапевтической эффективности применяемых методов лечения ТБ по сроку исследования выявлено, что применение разных схем терапии привело к разному исходу (табл. 1).
Таблица 1
Эффективность лечения по сроку наблюдения
|
Показатель |
Срок, месяцев |
Подгруппа, n (%) |
|||||
|
1 |
2 |
3 |
4 |
5 |
6 |
||
|
ПБВ |
3 |
5 (10,6) |
15 (31,9) |
9 (19,1) |
4 (9,3) |
10 (23,2) |
7 (13,9) |
|
Заживление деструктивных полостей |
4 (8,5) |
17 (34,0) |
7 (14,8) |
2 (4,6) |
8 (18,6) |
5 (11,6) |
|
|
ПБВ |
6 |
13 (27,6) |
27 (57,4) |
19 (40,4) |
9 (20,9) |
22 (51,1) |
13 (30,2) |
|
Заживление деструктивных полостей |
10 (21,2) |
24 (51,0) |
17 (36,1) |
7 (16,2) |
20 (46,5) |
10 (23,2) |
|
|
ПБВ |
12 |
22 (46,8) |
38 (80,8) |
30 (63,8) |
18 (41,8) |
33 (74,7) |
20 (46,5) |
|
Заживление деструктивных полостей |
19 (40,4) |
35 (74,4) |
27 (57,4) |
14 (32,5) |
30 (69,8) |
16 (37,2) |
|
ПБВ – прекращение бактериовыделения.
Установлено, что самой лучшей комбинацией в лечении как впервые выявленного ТБ, так и рецидивирующего являлась Mfn + Lzd + Bq. В подгруппе 2 бактериовыделение прекратилось у 15 человек (31,9%) спустя 3 месяца, у 27 (57,4%) – спустя 6 месяцев и у 38 (80,8%) – через12 месяцев. У больных подгруппы 5, которым назначена данная комбинация, эти параметры составили 10 (23,2%), 22 (51,1%) и 33 (74,7%) соответственно. В подгруппах 3 и 6, где принимались Lzd + Bq, эффект лечения был ниже, чем в вышеуказанных подгруппах. Критерий прекращения бактериовыделения в подгруппе 3 равнялся 9 (19,1%), 19 (40,4%) и 30 (63,8%) согласно периоду наблюдения, а в подгруппе 6 – 7 (13,9%), 13 (30,2%), и 20 (46,5%) соответственно. Минимальная терапевтическая эффективность выявлена при комбинации Lvf + Lzd. Признаки прекращения бактериовыделения у пациентов подгруппы 1 составили 5 (10,6%), 13 (27,6%) и 22 (46,8%), а в подгруппе 4 – у 4 (9,3%), 9 (20,9%) и 18 (41,8%) соответственно.
Об успешности химиотерапии свидетельствует процесс заживления деструктивных полостей, который в подгруппе 2 отмечался у 17 человек (34,0%) через 3 месяца лечения, у 24 человек (51,0%) – через 6 месяцев и у 35 (74,4%) – спустя 12 месяцев. В подгруппе 5 эти параметры составляли 8 (18,6%), 20 (46,5%) и 30 (69,8%) соответственно. Меньшая эффективность терапии отмечена в подгруппах 3 и 6, где симптомы заживления деструкций отмечались у 7 (14,8%), 17 (36,1%) и 27 (57,4%) человек и у 5 (11,6%), 10 (23,2%) и 16 (37,2%) соответственно на аналогичных сроках исследования. Успешность терапии при заживлении деструктивных поражений легочной ткани в подгруппах 1 и 4 была минимальной. В подгруппе 1 заживление полости наблюдалось у 4 (8,5%), 10 (21,2%) и 19 (40,4%), а в подгруппе 4 – у 4 (9,3%), 7 (16,2%) и 14 (32,5%) человек через 3, 6, 12 месяцев соответственно.
Выводы
1. Клинические и инструментальные признаки туберкулеза легких в условиях лекарственной устойчивости возбудителя сопровождаются проявлением инфильтративной формы, скудным бактериовыделением и наличием деструктивных полостей не более 2 см в основном у впервые выявленных пациентов; и признаками фиброзно-кавернозной формы, массивного бактериовыделения и деструктивных изменений легочной такни более 2 см – у рецидивирующих больных.
2. Спектры лекарственной устойчивости микобактерий у впервые выявленных больных ЛУ ТБ регистрируются в пределах 1–3 противотуберкулезных препаратов, а среди рецидивирующих пациентов – 3 препаратов и более.
3. Комплексное лечение пациентов со впервые выявленным ТБ-ЛУ, в которое включены линезолид, бедаквилин и моксифлоксацин, способствует быстрому снижению симптоматики (прекращению бактериовыделения и ускорению заживления деструктивных процессов). Терапия уже с 3-го месяца применения была выше других химиотерапий без бедаквилина.



