В настоящее время тканевая инженерия использует научные знания и достижения в разработке новых лекарственных средств и методов лечения в различных областях медицины для ускорения регенерации или замены тканей, таких как кости, хрящи, сухожилия и связки [1, 2]. Стандартный подход тканевой инженерии к решению задач репарации и регенерации тканей предполагает совместное использование композиционных материалов в виде трехмерных матриц, факторов роста и мультипотентных стволовых клеток [3].
Стволовые клетки – это неспециализированные клетки, обладающие способностью дифференцироваться (становиться другим типом клеток) и самообновляться (воспроизводиться без дифференцировки).
Определение стволовых клеток основано на их врожденных свойствах, таких как самообновление и дифференцировка. В научной литературе подробно рассматриваются различные способы дифференцировки стволовых клеток [4]. Процесс дифференцировки клеток реализуется под влиянием как внутренних, так и различных внешних факторов. К ним относятся нейрогуморальная регуляция и внешние факторы в виде ритма активности, света и температуры, электромагнитного излучения [5].
Следует подчеркнуть, что стволовые клетки находятся в среде электромагнитного поля информационного уровня, исходящего от функционирующих клеток тканей. Необходимо отметить, что стволовые клетки существуют также и в среде хронобиологических ритмов, таких как циркадианные ритмы, циклы гемодинамики, дыхания, микроциркуляции, периоды элонгации белка на рибосомах. Фундаментальные хронобиологические принципы биоуправления отражены в истории развития технических средств информационного воздействия на различные биологические объекты, а также ткани и органы человека.
В 1990-е гг. была получена, а в начале первого десятилетия XXI в. подтверждена информация о принципиально новых механизмах взаимодействия биологических объектов со сверхмалыми дозами биологически активных веществ и сверхслабыми электромагнитными излучениями [6, 7].
Следует особо подчеркнуть, что авторы [8, 9] совместного российско-итальянского научного исследования выявили факты краткосрочного и сверхнизко интенсивного воздействия микроволн на генетический аппарат человека.
Вместе с тем обращает на себя внимание отсутствие сведений в научной литературе о влиянии сверхслабых микроволновых излучений на стволовые клетки человека и животных. Это связано, прежде всего, с отсутствием как научно обоснованных методологических приемов изучения сформулированной проблемы, так и необходимых технических средств реализации комплекса таких исследований.
В связи со сказанным изучение влияния сверхслабых микроволн на стволовые клетки является актуальной задачей.
Цель исследования была сформулирована как установление факта воздействия сверхслабого электромагнитного поля частотой 1 ГГц и мощностью менее 10 мкВт на мезенхимальные стволовые клетки: в режиме непрерывной генерации и в режиме низкочастотной модуляции биотропными параметрами человека.
Задачи исследования включают:
1) создание структуры биоуправляемого генератора сантиметровых волн сверхнизкой интенсивности;
2) разработку моделей низкочастотной модуляции сверхнизко интенсивного СВЧ-излучения посредством паттерна сигналов, включающих частоту сердечных сокращений, сигналы метрономизированного дыхания, ритмы микроциркуляции и ритмы элонгации белка на рибосомах;
3) разработку структуры циклического алгоритма управления СВЧ-излучением с заданной длительностью сигнала и функционирующего посредством микроконтроллера и блока таймера;
4) исследование влияния СВЧ-облучения в сверхнизко интенсивном режиме на пролиферацию и активность мезенхимальных стволовых клеток;
5) сравнение влияния на стволовые клетки сверхнизко интенсивного СВЧ-излучения частотой 1 ГГц в режиме низкочастотной биомодуляции и в режиме непрерывной генерации.
Материалы и методы исследования
Исследование проводили с использованием мезенхимальных стволовых клеток (МСК) человека, выделенных из жировой ткани. Культура клеток была приобретена у ООО«Биолот», Россия.
Разработанный нами аппарат Synchropulsar AQUA был использован в качестве источника сверхнизко интенсивного <10 μW электромагнитного излучения частотой 1 ГГц. Другие технические характеристики прибора в данной публикации не рассматриваются.
Продолжительность опыта составила 9 дней. Один раз в сутки флаконы опытной группы устанавливали на 15 минут на рамочную антенну. Мезенхимальные стволовые клетки (МСК) культивировали в колбах с полноценной питательной средой DMEM/F12 с 10%-ной эмбриональной телячьей сывороткой (ПанЭко, Россия). После облучения культуральные флаконы с МСК помещали в СО2-инкубатор и культивировали при 37°С, 5% СО2, 100% влажности.
После завершения эксперимента пролиферацию клеток оценивали путем подсчета количества клеток с помощью счетчика клеток Scepter 2.0 с наконечниками 40 мкм (Millipore, Merck/Sigma-Aldrich, США).
Митохондриальную активность изучали с помощью флуоресцентного микроскопа Nikon Ti-S (Nikon (Япония) со специализированным программным обеспечением Nikon EZ-C1 FreeViewer (Nikon, Япония) с использованием флуоресцентного красителя MitoTracker™ Red CMXRos (ThermoFisher MitoTracker Red CMXRos – красный флуоресцентный краситель, который окрашивает митохондрии в живых клетках. Данный краситель является флуоресцентным только при окислении в клетке, к этому красителю присоединена алкилирующая хлорметильная группа. Благодаря своему мембранному потенциалу функциональные митохондрии поглощают краситель.
Статистическую обработку результатов проводили с помощью пакета статистических программ STATISTICA 6.0 (StatSoft Inc., США). Данные считались значимыми при p<0,05. Использовался непараметрический критерий Вилкоксона, который нечувствителен к конкретному статистическому закону распределения.
Результаты исследования и их обсуждение
Интерфейс программы Nikon EZ-C1 FreeViewer (Nikon, Япония) позволял получить цветные изображения с оконтуренными стволовыми клетками.
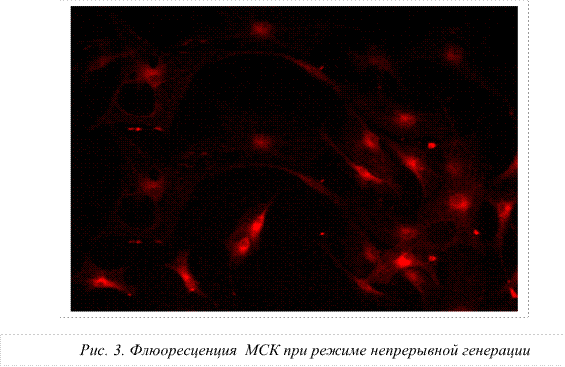
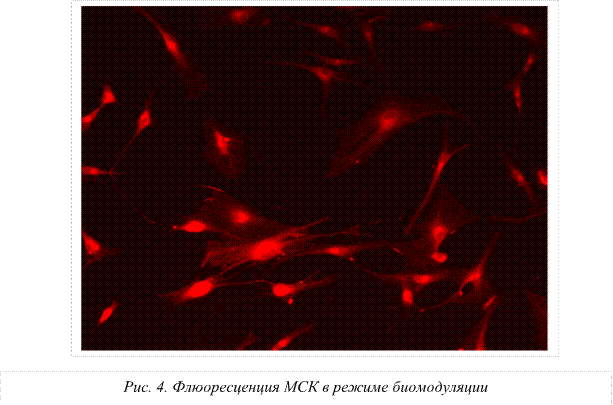
Как было указано выше, надежный подсчет количества делящихся стволовых клеток после проведенных экспериментов обеспечивал специальный счетчик Scepter 2.0. В ходе исследования было установлено снижение количества клеток в опытных группах по сравнению с контролем. На рисунке 1 представлены данные о влиянии микроволн на процессы пролиферации МСК. В контроле вычислено 3,1х106 кл/мл, в режиме низкочастотной биомодуляции – 2,5х106 кл/мл; в режиме непрерывной генерации выявлено 2,1х106 клеток/мл.
 |
 |
 |
|||
 |
|||
Рассмотрим, каковы механизмы наблюдаемых изменений мезенхимальных стволовых клеток, происходящих под влиянием сверхнизко интенсивного СВЧ-излучения?
В начале XXI в. модели живого состояния клетки изучались многими известными биологами. Однако сообщалось, что биологи в то время не учитывали проблемы биоэнергетики клетки. В связи с этим рассматриваемые модели не стали общепринятыми теориями.
Как известно, все биохимические и физиологические процессы реализуются в водной среде. Только в 2009 г. петербургскими учеными была предложена новая концепция молекулярного механизма передачи энергии, а также восприятия сверхслабых воздействий живыми системами [10]. В дальнейшем все положения этой концепции были обоснованы.
Далее рассматриваются взгляды цитированных выше авторов на так называемую молекулярную ячейку, или молекулярный модуль. В основу концепции ими были положены методы нелинейной математической физики при описании движения энергии по молекулярным цепочкам и квантово-механические представления о формировании сигналов в анизотропных средах. Было рассмотрено представление о молекулярной единице как едином структурном модуле, интегрированном в биологическую систему, которая проявляет коллективные свойства единства молекул, объединенных водной средой и окружающих ее физических полей, в процессах восприятия и переноса энергии. Также было показано, что межмолекулярный перенос энергии и усиление сверхслабых эффектов являются элементами единого энергетического процесса в живой системе, а физической основой обоих процессов служит единство молекулярного и водно-полевого окружения молекулярного модуля. Таким образом, в последнем случае молекулярный модуль определяется авторами «как временное образование двух или более биополимеров, находящихся некоторое время наиболее близко друг к другу, но все же разделенных водной средой».
Был рассмотрен и «жизненный процесс» молекулярного модуля. Как стало известно, в состав молекулярного модуля входят три обязательных участника: биополимеры, водная среда (так называемая фрактальная «шуба») и электромагнитное поле в виде солитонных волн. Все они взаимодействуют на основе нелинейных законов, в результате чего молекулярный модуль и проявляет свойства «живой системы». Молекулярные модули входят в состав клеточных структур, которым необходим постоянный приток энергии из внешней среды. Такая энергия выделяется солитонами в режиме так называемого разряда. В результате вода, окружающая биополимеры в живых системах, модифицируется с образованием фрактальных структур, закрепленных на гидрофильных участках биополимеров. Водные фракталы по сути являются антеннами и переизлучают часть энергии на остальные биополимеры молекулярного модуля. Таким способом осуществляется и коррекция нарушенных функций в процессе патологии за счет восстановления информационной и структурной составляющей биополимеров молекулярного модуля.
Фактически мы только что рассмотрели двухструктурную динамическую фрактально-кластерную модель надмолекулярной организации жидкой фазы воды. Модель включает шестимолекулярные молекулы (Н2О)6 – гексагоны и мономолекулы Н2О – триады. В процессе метаболизма может происходить двусторонняя миграция триад в полости гексагонов с образованием комплексов [(H2O)6 + H2O], или так называемых клатратов. Динамическое объединение клатратов в кластеры n-го порядка приводит к появлению фрактальных ассоциатов 6n [(Н2О)6 + Н2О]. В результате получается структура, напоминающая матрешку, в которой при внешнем воздействии микроволнового сверхнизко интенсивного излучения происходит резонансное возбуждение ассоциата, как целого, так и независимых от него молекул, а именно: триад, гексагонов, клатратов и кластеров. После прекращения внешнего воздействия сразу начинается переизлучение кластерных структур на присущей им частоте в окружающую среду. Это переизлучение сохраняется сколь угодно долго после прекращения внешнего воздействия. Процесс непрерывно продолжается в связи с постоянным поступлением свежей воды и превращением ее в цепочку кластеров и ассоциатов.
Ассоциированная вода, помимо всего вышеперечисленного, обеспечивает высокую степень гидратации белковых и белково-липидных структур в клетках, а также позволяет стимулировать эффективный внутриклеточный перенос электронов и транспорт внутриклеточных метаболитов, а также оказывать стабилизирующее действие и регулирующее влияние на клеточный цикл.
Следовательно, первичной мишенью для воздействия сверхслабым СВЧ-полем являются структурные образования воды: гексагоны, клатраты, кластеры и ассоциаты, которые, видоизменяясь, приводят к трансформации свойств мембраны и, как следствие, к изменению функционального состояния и активности стволовых клеток. При использовании режима низкочастотной модуляции СВЧ-излучения на основе биоритмов сердечного цикла, резонансного дыхания и ритмов элонгации белка на рибосомах получены признаки увеличения интенсивности свечения митохондрий. Это, по-видимому, связано с процессами синхронизации окислительного и энергетического обмена и, в свою очередь, свидетельствует о повышении активности митохондрий.
Снижение количества МСК в опытной группе при использовании режима непрерывной генерации может свидетельствовать о начале процесса дифференцировки МСК.
Выводы
1. Разработан специальный прибор «Synchropulsar Aqua» для изучения воздействия сверхнизко интенсивного электромагнитного излучения на мезенхимальные стволовые клетки человека.
Устройство работает на частоте 1 ГГц и мощности излучения менее 10 мкВт и включает два режима: непрерывную генерацию и низкочастотную модуляцию с использованием биотропных параметров пульса, метрономизированного дыхания, циклической микроциркуляции и ритмов элонгации белка на рибосомах.
2. Установлено статистически значимое снижение количества мезенхимальных стволовых клеток при обоих режимах воздействия. Однако при использовании режима низкочастотной модуляции биотропными параметрами сверхнизко интенсивного СВЧ-излучения отмечено достоверно меньшее снижение количества мезенхимальных стволовых клеток.
3. Выявлено усиление флуоресценции мезенхимальных стволовых клеток, когда воздействующими факторами являлись микроволны с низкочастотными ритмами модуляции, а именно: частоты пульса, метрономизированного дыхания, периодики микроциркуляции и элонгации белка на рибосомах. Полученные факты свидетельствуют об активации митохондрий мезенхимальных стволовых клеток.
4. Снижение количества МСК в опытной группе при использовании режима непрерывной генерации, возможно, свидетельствует о начале процесса дифференцировки МСК.



